磁性纳米材料合成表征及浓度测定——综合化学实验
2014-12-25程世博吴卫兵龚淑玲
谢 敏,程世博,吴卫兵,黄 驰,龚淑玲
(武汉大学 化学与分子科学学院,国家级化学实验教学示范中心,湖北 武汉 430072)
20世纪八九十年代,人们研究发现,当材料尺寸缩小到纳米级别时,材料的许多宏观性能发生很大改变,具有很多特殊性质,如:表面效应、量子尺寸效应、小尺寸效应、宏观量子隧道效应等[1]。在纳米材料研究领域中,磁性材料的研究受到诸多学者的关注。磁性纳米材料具有常规粗晶体材料所不具备的磁特性,主要表现在超顺磁性、高矫顽力和磁化率等方面。磁性纳米粒子种类多样,如:γ-Fe2O3、Fe3O4、FePt、CoPt、NiPt等,粒径可以从几纳米到上百纳米,广泛用于DNA、蛋白质、细胞等的分离及分析、磁共振成像、药物靶向运输、癌症治疗等领域[2]。
磁性纳米材料的制备和应用涵盖了化学、生物、物理、医学等领域,因此设计了本综合化学实验,涵盖磁性纳米材料的合成及表征方法,可以使学生较早地接触前沿研究领域,激发学生的科研兴趣,更好地了解现代化学的发展方向,有利于高素质人才培养[3-4]。本综合设计实验包括:(1)查阅资料考察磁性纳米材料合成方法及表征手段;(2)磁性纳米材料的合成;(3)运用多种大型仪器对磁性纳米材料进行表征[5-6]。
1 磁性纳米材料制备方法
磁性纳米材料的制备大致可以分为两类:物理法和化学法。物理法有球磨法、溅射法等;化学法有共沉降法、辐射合成法、液相沉积法、热液法等。实际应用中,为合成粒径均一、单分散性好、饱和磁化强度高、超顺磁性好的磁性纳米颗粒一般采用化学法制备[7-8],其中常见的是盐溶液在水解剂中发生水解,经加热分解后制备氧化物磁性纳米颗粒,如FeCl2·4H2O和FeCl3·6H2O的混合盐溶液在NH4OH的作用下经水解可以制备Fe3O4纳米粒子[9]。但是利用水解沉淀法制备的磁性纳米颗粒其分散性较差、粒径分布较宽,限制了其应用领域。除水解沉淀法外,比较常用的还有有机液相高温还原法。该方法主要是使用沸点较高的有机溶剂,使得金属盐在高温下发生分解,在多元醇的作用下发生还原而制备磁性纳米颗粒。例如,以苯醚为溶剂,乙酰丙酮铁在1,2-十六烷二醇、油酸和油胺存在的条件下发生分解和还原,生成粒径均一、分散性好的Fe3O4纳米颗粒[10]。
本实验采用的一缩二乙二醇溶剂具有较高的沸点,且具有羟基官能团,不仅可以作为还原剂将金属离子还原又可以作为配体用来螯合金属离子,从而起到调节纳米粒子生长的作用[11]。在加热回流过程中,乙酰丙酮铁在高温下分解产生铁离子可以与一缩二乙二醇形成螯合物,同时一缩二乙二醇可以各向同性地吸附铁离子,最终形成近似球形的磁性纳米粒子。用本方法制备磁性纳米颗粒简单可靠,重现性好,是对已有文献方法的改进和完善[12]。
2 实验药品与仪器
药品:一缩二乙二醇 (分析纯)、乙酰丙酮铁(分析纯)、KBr(分析纯)、Fe(NO3)3(分析纯)、浓硝酸(分析纯)、透析袋(剪切分子量3 500)、温度计、球形冷凝管、50mL三口烧瓶、容量瓶、试管、0.22μm滤膜、注射器及离心管。
仪器:X射线衍射仪(日本岛津XRD6000)、傅里叶变换红外光谱仪(Nicolet is10,美国Thermo公司)、原子发射光谱仪(IRIS Intrepid II型,美国 Thermo公司)、热重-差热分析仪(法国,SETARAM)。
3 实验方法
3.1 磁性纳米材料的制备
准确称取0.706g乙酰丙酮铁加入到50mL三口圆底烧瓶中,并向其中加入10mL一缩二乙二醇,磁力搅拌作用下缓慢加热升温至180~185℃(此时溶液由红棕色变为黑褐色),在该温度下保持稳定10min后迅速升至238~240℃,回流4h(注意反应体系的温度,尽量控制在238℃以上);停止反应,将圆底烧瓶从加热套中提起,自然冷却至室温;随后8 000r/min离心3min,取上层清液,上层清液4℃冰箱中保存备用。
3.2 磁性纳米材料的前处理
因为一缩二乙二醇比较黏稠,为了后续的表征处理,需将分散于一缩二乙二醇中的磁性纳米颗粒于透析袋中透析,用于除去多余的反应溶剂。具体过程如下:将反应后的溶液,装入透析袋中(注意要预留两倍空间,因为充分透析后溶液体积会增大),透析过程持续3d,每天更换去离子水2次;之后取15mL分散在去离子水中的样品,经冷冻干燥得固体粉末并称量,计算磁性纳米颗粒的质量浓度为3.86g/L。
3.3 磁性纳米材料的表征
3.3.1 X射线衍射(XRD)
取15mg以上磁性纳米颗粒固体样品,装入玻璃样品槽中,压平,在X射线粉末衍射仪(日本岛津XRD6000)中进行测定,使用Cu Kα辐射源,入射波长为0.154 056nm,X射线管的工作电压和电流分别为40kV和100mA。扫描角度为10°~80°,扫速为4°/min。
3.3.2 热重-差热分析仪(TG-DSC)
取10mg冷冻干燥后的磁性纳米颗粒置于热重差热分析仪(法国,SETARAM)上测定其TG-DSC图谱(Al2O3为参比)。TG-DSC的测定需要在氮气和空气的条件下分别进行,测定范围为室温至800℃,升温速率为10℃/min。
3.3.3 傅里叶变换红外光谱(FTIR)
取冷冻干燥的磁性纳米颗粒与KBr按照体积比为1∶150的比例进行研磨,之后经压片机压片,于傅里叶红外光谱仪上(Nicolet is10,美国Thermo公司)测定样品的FTIR光谱,扣除空白背景后,分析磁性纳米颗粒的FTIR图谱。
3.3.4 原子发射光谱法测定磁性颗粒中铁离子的含量(ICP-AES)
取1mL透析后的包含磁性纳米颗粒的溶液,加入稀硝酸后在加热条件下进行硝化;用0.22μm滤膜过滤除去少量难溶杂质;最后,将样品稀释于50mL容量瓶中定容(做实验之前建议学生查阅资料,熟悉ICP-AES样品制备方法)。以Fe(NO3)3为原料配制标准溶液,质量浓度分别为0.01、0.5、1、5、50、100 μg/mL,选择Fe 238.2nm,Fe 239.5nm 和 Fe 259.9 nm测定其发射光谱的强度并绘制工作曲线,最后测定样品中铁离子的含量。
4 实验结果及分析
4.1 磁性纳米材料的表征
4.1.1 XRD图谱
经高温裂解法制备的磁性纳米颗粒,其衍射图谱(见图1)与Fe3O4和γ-Fe2O3的衍射图谱都具有极高的匹配度。由于Fe3O4和γ-Fe2O3的晶体结构很相似,仅存在约1%的差异,二者主要晶面的晶面距也十分接近,所以单纯从产物的XRD衍射图谱很难判断它到底是γ-Fe2O3还是Fe3O4。然而,Fe3O4在一定条件下可以被氧化成γ-Fe2O3,继而在更高的温度下进一步发生相转换而生成α-Fe2O3,如式(1)所示。依据这一特性,需借助热重-差示扫描量热法进一步判断磁性纳米颗粒的晶型。

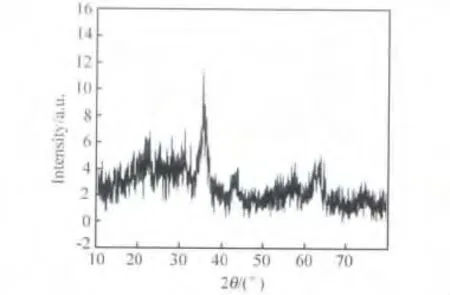
图1 XRD图谱
4.1.2 TG-DSC图谱解析
测得的TG-DSC图谱见图2。

图2 TG曲线和DSC曲线
在氮气氛围下,磁性纳米颗粒呈现缓慢且连续的失重过程,主要是磁性纳米材料吸附的水分子以及配体丢失产生的失重,失重达23.25%。具体而言,水分子丢失主要表现在加热初期(室温~200℃),而配体丢失产生的失重则表现在整个升温过程。水分子以及配体的失重在氮气条件下体现为弱的放热过程。
在空气氛围下,磁性纳米材料的失重过程分为两部分,即200℃之前磁性纳米材料吸附的少量水分子产生的失重以及200~400℃期间磁性纳米材料表面配体分解产生的失重,失重为16.99%。与在氮气下,失重过程呈弱的放热反应相比,空气氛围下测定的DSC曲线在250℃和500℃有2个明显的放热峰,放出大量热是由于磁性纳米颗粒表面包覆的有机配体氧化及磁性纳米颗粒在空气中发生晶型转换所致。在250℃附近,磁性纳米颗粒由Fe3O4转换为γ-Fe2O3发生氧化反应,呈现一个明显的放热过程;随后,在500℃附近,γ-Fe2O3转换为α-Fe2O3型,呈现另一个放热过程(在TG图上没有明显的质量变化)。在空气条件下,磁性纳米颗粒的失重为16.99%,小于氮气条件下的23.25%的失重,这说明Fe3O4在空气条件下产生氧化增重,证实磁性纳米颗粒在空气条件下发生了晶型转换。因此,通过测定氮气和空气条件下的TG-DSC图谱,并结合XRD衍射谱,可以确定用上述高温裂解法制得的磁性纳米颗粒为Fe3O4。
4.1.3 FTIR图谱解析
FTIR图谱见图3,从高波数到低波数区,第1峰区3 421.35cm-1有一中等强度且宽而散的吸收峰,初步 判 断 样 品 中 含 有 羟 基。 在2 919.88cm-1及1 384.07cm-1附近可以观察到饱和碳氢键的吸收峰,结合1 074.83cm-1处C—O—C键伸缩振动峰,说明一缩二乙二醇作为配体包覆在磁性纳米颗粒表面。此外,在590.50cm-1处观察到铁氧键伸缩振动的特征吸收峰,与文献值相近[12]。除此之外,可见1 636.67 cm-1处C=O的吸收峰,这是由于乙酰丙酮铁分解产生的乙酸等小分子吸附在磁性纳米颗粒上所致。由FTIR数据可知,纳米氧化物主要成分是一缩二乙二醇包被的磁性Fe3O4纳米材料。
4.1.4 磁性纳米材料的粒径分析
磁性纳米颗粒的粒径可依据XRD衍射图谱(见图1)利用Scherrer公式:D=Kλ/(βcosθ)进行测定,K为Scherrer常数,其值为0.89(球形);D为晶粒尺寸(nm);β为积分半高宽度,在计算的过程中,需转化为弧度 (rad);θ为 衍 射角;λ为 X 射 线波 长,λ为0.154 056nm(Cu靶)。由Scherrer公式计算得出纳米材料粒径为3.47nm。如果实验条件允许,可以建议学生用透射电子显微镜测定样品的粒径(选做),从图4可见,磁性纳米颗粒的粒径小于5nm,经Scion Image或Corel Draw软件统计结果显示,其平均粒径为3.82nm,与Scherrer公式计算的结果基本一致。

图3 FTIR图谱

图4 TEM成像
4.1.5 ICP-AES测定磁性纳米颗粒中铁离子的含量
图5为Fe离子ICP-AES标准曲线。

图5 Fe离子的ICP-AES标准曲线
标准曲线的线性拟合方程为y=1.379x-0.477,R2=0.999 3(R为 相 关 系 数)。样 品 的 光 强 度 值(64.557)带入公式,计算出稀释50倍的样品液中Fe离子的浓度为47.16g/L,则样品液中Fe离子的浓度为2 358mg/L,最终推算出Fe3O4固体颗粒的浓度为4.24g/L(包含配体质量)。由冷冻干燥法(干燥称重)测得样品的浓度为3.86g/L,两种方法测得的结果基本一致。
4.1.6 磁性纳米材料的摩尔浓度(纳米粒子颗粒浓度)计算
(1)利用晶胞参数计算。Fe3O4属立方晶系结构,晶格常数a=0.839 8nm。Fe3O4是由 Fe2+、Fe3+、O2-通过离子键而组成的复杂离子晶体。习惯上将四氧化三铁用Fe3O4来表示,但不能把它看成是FeO和Fe2O3的混合氧化物,其化学式为FeO·Fe2O3。四氧化三铁晶体是由许多O2-离子堆积起来的骨架构成,它有正四面体和正八面体两种堆积方式,Fe2+和Fe3+存在于骨架的空隙之中。每个晶胞中都含有32个O2-离子、16个 Fe3+离子和8个 Fe2+离子:(Fe2+8Fe3+16O2-32),其中8个Fe2+离子和8个Fe3+离子占据八面体空隙位,另外8个Fe3+离子占据四面体空隙位。ICP测定结果显示磁性纳米颗粒中Fe离子的含量为2 358mg/L,利用(2)式,即可计算出磁性纳米粒子的颗粒浓度。

式中,Np为所取1mL磁性纳米粒子的个数,Ns是ICP-AES测定的水溶液中Fe3+的含量,Vp为磁性纳米粒子的单颗粒体积(通过粒径计算,料径为3.47 nm),Vc为磁性纳米粒子的晶胞体积(通过晶胞参数计算),nc为磁性纳米粒子单个晶胞中Fe离子的个数。由上述方法计算纳米颗粒为6.74×1015个/mg,纳米粒子浓度约为4.75×10-5mol/L。
(2)利用Fe3O4密度计算。氮气条件下的热重曲线测得磁性纳米材料的配体含量为23.25%,所以1mL磁性纳米材料样品里Fe3O4质量为3.25mg(以4.24g/L为基准)。块状Fe3O4密度为5.18g/cm3,由此可以计算出3.25mg样品中Fe3O4的体积,单个Fe3O4的体积可以由粒径3.47nm计算,最终可得纳米颗粒为6.78×1015个/mg,Np约为4.78×10-5mol/L。可见,两种计算方法所得磁性纳米颗粒的浓度基本一致。
综上所述,磁性纳米材料的质量浓度可以通过干燥称量或ICP-AES两种方法测定。干燥称量法相对简单,但会存在一定的误差;以ICP-AES为基础计算磁性纳米颗粒的质量浓度,准确度较高,但测量方法和计算方法都相对复杂(需考虑配体的失重百分比)。对于磁性纳米材料摩尔浓度的计算,可以根据晶胞参数计算,也可依据块状固体的密度计算,两种算法求得磁性纳米材料的摩尔浓度具有较高的匹配度。
5 教学要求
5.1 预习要求
(1)了解纳米材料的主要化学制备技术,重点了解化学沉淀法和有机高温还原法。
(2)查阅相关参考文献,了解磁性纳米材料的常规表征手段。
(3)熟悉X射线光电子能谱、热重-差热分析仪、红外光谱仪及原子发射光谱仪等大型仪器的原理和操作方法。
5.2 实验结果要求
(1)根据XRD曲线,对磁性纳米材料的晶型进行初步分析并计算其粒径。
(2)根据热重-差示扫描量热图谱并结合XRD曲线确定磁性纳米材料的晶型。
(3)根据傅里叶变化红外光谱分析磁性纳米颗粒表面的配体组成。
(4)根据原子发射光谱计算磁性纳米颗粒水溶液中铁离子的含量。
(5)根据磁性纳米材料的晶型和密度,结合原子发射光谱的结果计算水溶液中磁性纳米颗粒的浓度。
5.3 思考和讨论
(1)高温条件下合成磁性纳米颗粒的优越性?
(2)TG-DSC测定为什么需要分别于氮气和空气条件下进行?
(3)影响磁性纳米颗粒浓度测定准确性的影响因素有哪些?
6 结束语
本综合实验结合了基础化学实验、无机化学及结构化学等知识,涉及多种大型仪器的使用,可以培养学生的动手能力和综合分析能力。在实际教学中可以达到以下效果:首先,因为实验内容靠近科技前沿,能很好地调动学生实验的积极性和创造性;其次,通过大型仪器综合运用可以使学生掌握多种实验技能,使其意识到仪器分析实验并不是按键式操作,需要对样品进行前处理及数据的再分析才能得到所需的结果;最后,通过该综合实验可以使学生从中体验科学研究的具体过程,提高实际科研过程中分析问题和解决问题的能力,使综合实验起到学生从本科学习过程到研究创造过程的桥梁纽带作用。
(
)
[1]张立德,牟季美.纳米材料和纳米结构[M].北京:科学出版社,2002.
[2]侯仰龙.磁性纳米材料的化学合成、功能化及其生物医学应用[J].大学化学,2010,25(2):1-11.
[3]张霞,桑晓光.纳米材料制备技术在化学综合实验课程中的应用[J].大学化学,2011,26(2):34-37.
[4]戚洪彬,梁树平,姜浩.大学化学实验课程体系的建设[J].实验技术与管理,2011,10(28):122-124.
[5]刘永红,叶发兵,岳霞丽,等.铁氧化物的合成及其表征[J].化学与生物工程,2006,23(7):10-12.
[6]郑志刚,钟喜春,余红雅,等.Fe3O4磁性纳米颗粒的制备及性能表征[J].电子元件与材料,2010,29(7):27-29.
[7]付佳,许启明,李宁.纳米四氧化三铁化学法制备及其应用[J].无机盐工业,2007,39(10):5-7.
[8]张效岩,王英,张亚非.磁性纳米粒子的制备及应用[J].磁性材料及器件,2004,35(6):14-17.
[9]邱星屏.四氧化三铁磁性纳米粒子的合成及表征[J].厦门大学学报:自然科学版,1999,38(5):711-715.
[10]Sun S,Zeng H.Size-Controlled Synthesis of Magnetite Nanoparticles[J].Journal of the American Chemical Society,2002,124(28):8204-8205.
[11]Douglas F J,MacLaren D A,Murrie M.A study of the role of the solvent during magnetite nanoparticle synthesis:tuning size,shape and self-assembly[J].RSC Advances,2012,2(21):8027-8035.
[12]Jia X,Chen D,Jia X,et al.Environmentally-friendly preparation of water-dispersible magnetite[J].Chemical Communications,2009(8):968-970.
