直接发酵法生产L-丝氨酸高产菌株的选育
2014-12-25徐国强窦文芳许泓瑜张晓梅
徐国强 , 窦文芳 , 许泓瑜 , 张晓梅 *
(1.江南大学 药学院,江苏 无锡,214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
L-丝氨酸(L-serine)是一种非必需氨基酸,具有重要的生理功能,在医药、食品、化妆品及化工等领域具有重要的应用价值。L-丝氨酸的市场需求量很大[1]。目前,L-丝氨酸的主要生产方法有化学合成法、蛋白质水解法和前体转化法,而这些方法存在成本较高、产率较低及环境污染较大等问题,限制了L-丝氨酸的规模化生产。相比之下,以可再生资源糖为原料的微生物发酵法生产L-丝氨酸则受到广泛关注。
目前,发酵生产L-丝氨酸的微生物主要有黄色短杆菌[2]、重组大肠杆菌[3]和谷氨酸棒杆菌[4-5]。其中谷氨酸棒杆菌(Corrynebacterium glutamicum)已广泛地用于各种氨基酸的生产,由于谷氨酸棒杆菌的生理学、生物化学及遗传学信息已较为丰富[6],对其进行进一步的代谢工程改造也较为方便,因此,采用谷氨酸棒杆菌来生产L-丝氨酸具有诸多的优势。
谷氨酸棒杆菌中L-丝氨酸的合成途径见图1。主要有3个关键酶:包括3-磷酸甘油酸脱氢酶(PGDH,serA)、 磷 酸 丝 氨 酸 氨 基 转 移 酶 (PAST,serC)、磷酸丝氨酸磷酸酶(PSP,serB)。 降解途径包括2个关键酶,分别是L-丝氨酸羟甲基转移酶(SHMT,glyA)和 L-丝氨酸脱氢酶(L-serDH,sdaA)。Peters-Wendisch P等[7]证实了高浓度的L-丝氨酸对C.glutamicum中的PGDH存在反馈抑制作用。他们对L-丝氨酸代谢途径中的关键酶进行了改造,使得模式菌株C.glutamicum ATCC13032可以积累L-丝氨酸到[4,8-9]。而关于野生型谷氨酸棒杆菌产L-丝氨酸却鲜有报道。作者所在实验室前期从土壤中筛选获得一株可以利用糖质原料发酵生产L-丝氨酸的野生型C.glutamicum SYPS-062,并对该菌株展开了一系列的研究[5,10-14]。但还是存在L-丝氨酸产量较低发酵周期较长等问题,拟采用L-丝氨酸结构类似物D-丝氨酸抗性平板筛选突变株从而解除L-丝氨酸对PGDH的反馈抑制,促进L-丝氨酸的进一步积累。
利用诱变育种技术获得具有优良性状的突变株,然后通过全基因组测序找出引起优良性状的遗传差异,进而运用代谢工程的手段对菌株进行定向改造[15],这种利用反向代谢工程改造菌株的策略将具有明显的优势。作者旨在通过传统诱变育种的方法,获得L-丝氨酸产量等发酵特性明显变化的C.glutamicum突变株,为下一步进行反向代谢工程研究提供有价值的实验材料。

图1 谷氨酸棒杆菌中L-丝氨酸的代谢途径Fig.1 Metabolic pathway of L-serine in C.glutamicum
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 C.glutamicum SYPS-062:可直接利用糖质原料发酵生产L-丝氨酸,由江南大学制药工程研究室保藏。
1.1.2 培养基
1) 斜面培养基:Peptone 10 g/L,Beef extract 10 g/L,Yeast extract 5 g/L,NaCl 3 g/L,Agar 20 g/L;pH 7.0,121℃灭菌 20 min。
2)种子培养基:Glucose 30 g/L,corn steep liquor 20 g/L, (NH4)2SO420 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,CO(NH2)21.5 g/L,cottonseed flour 20 g/L;pH 7.0,121 ℃灭菌 20 min。
3)发酵培养基:Sucrose 60 g/L,(NH4)2SO430 g/L,KH2PO43 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.02 g/L,MnSO4·H2O 0.02 g/L,biotin 50 μg/L,streptomycin 10 μg/L,CaCO330 g/L, 维生素 B1450 μg/L;pH 7.0,121 ℃灭菌 10 min。
4)抗性筛选培养基:Peptone 10 g/L,Beef extract 10 g/L,Yeast extract 5 g/L,NaCl 3 g/L,Agar 20 g/L,在此基础上加入D-serine,使其在培养基中的终质量浓度为150 g/L。
1.1.3 试剂 DES:为上海试剂厂产品;D-serine:为美国Sigma公司产品;其他均为国产分析纯试剂。
1.2 方法
1.2.1 培养方法
1)斜面活化及种子培养:将保存在4℃冰箱中的斜面菌种接种到新鲜斜面,30℃静置培养24 h;然后将活化后的菌种接入种子培养基(装液量为30 mL/250 mL 三角瓶),115 r/min、30 ℃振荡培养 18 h。
2)摇瓶发酵:按5%的接种体积分数将种子培养液接入发酵培养基 (装液量为20 mL/250 mL三角瓶),115 r/min、30 ℃振荡培养 96 h。
1.2.2 诱变方法及D-serine抗性变异株的检测方法 先将种子培养到对数生长期中后期,再以50%的接种体积分数转接到新鲜的种子培养基中培养5 h,使所有细胞达到同步生长。将培养液无菌离心,收集菌体,用无菌的0.1 mol/L、pH 7.0的磷酸缓冲液将菌体制成108个/mL的菌悬液,离心洗涤3次,转入无菌的带玻璃珠的三角瓶中打散,得单细胞悬液。取1 mL的菌悬液,加入硫酸二乙酯,使其终体积分数为2%,30℃振荡反应20 min,诱变结束后快速离心终止反应,用无菌的0.1 mol/L、pH 7.0的磷酸缓冲液洗涤3次,将诱变后的单细胞悬液接种到新鲜的种子培养基培养8 h,然后直接涂布抗性筛选平板,30℃恒温培养3~5 d,长出的大菌落即为D-serine r,挑选这些菌落进行初筛。
1.2.3 分析方法 细胞干重的测定 (dry cell weight,DCW):取发酵液 5 mL,加 12 mL 0.25 mol/L的稀盐酸,待反应完毕后,经8 000 r/min离心5 min后倾去上清液,用去离子水洗涤两次,置于105℃烘箱干燥至恒质量后称量;蔗糖测定方法:采用间苯二酚法;L-丝氨酸定量测定方法:采用日立835-50氨基酸自动分析仪。色谱条件如下:柱温为40℃;流速为 1.0 mL/min;紫外检测器:338、262 nm (Pro,Hypro;荧光检测器:激发波长340 nm,发射波长450 nm;激发波长 266nm,发射波长 305nm (Pro,Hypro)。
2 结果与分析
2.1 出发菌株及诱变培养时间的确定
将C.glutamicum SYPS-062的斜面保藏菌种划线分离,挑选菌落形态较大的32个单菌落转接到斜面上,培养24 h后接种至摇瓶进行产酸能力的初筛,再将产酸较高的5株菌进行复筛,结果发现36号菌产酸最高,然后将该突变株连续传代5次考察其遗传稳定性,发现其产酸未见明显变化。表明其遗传稳定性较好,因此,确定菌株C.glutamicum SYPS-062-36为诱变的出发菌株,用于后续相关实验。
出发菌株的生长曲线见图2。从种子生长曲线上可以看出,该菌经过16~18 h的培养后,到达对数生长中后期,此时细胞代谢活力最为旺盛,并且处在这个时期的细胞对诱变剂更为敏感。因此,确定诱变所用细胞的培养时间为16~18 h。
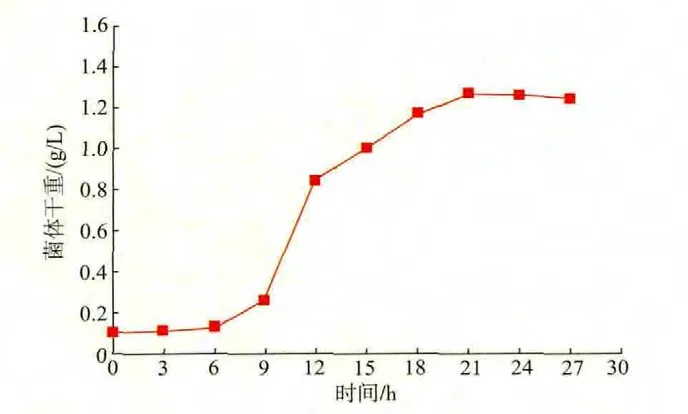
图2 出发菌的种子生长曲线Fig.2 Growth curve in the seed medium of parent strain
2.2 诱变育种
以硫酸二乙酯(DES)为诱变剂,诱变时间为20 min,测定了诱变剂浓度与致死率的关系,结果见表1。从表1可以看出,选择诱变剂体积分数为2%比较合适,此时致死率为71.8%。
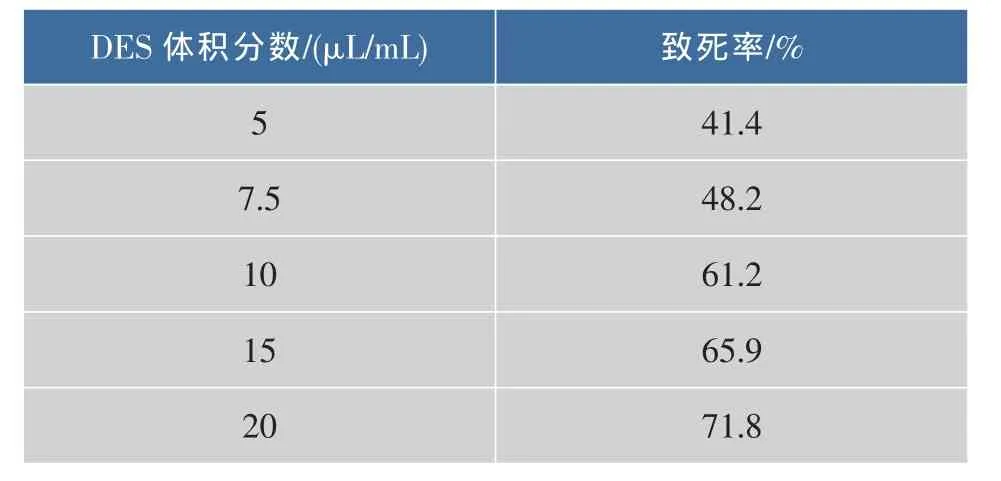
表1 对菌株C.glutamicum SYPS-062-36 DES诱变致死率Table 1 Determination of the lethality on C.glutamicum SYPS-062-36 treated by DES
对出发菌株SYPS-062-36(图3a)进行诱变,在150 g/L D-丝氨酸抗性平板上随机挑选突变株,获得一株产酸较高P3,其产酸为(7.35±0.21)g/L,然后对突变株P3在同样的条件下进行第二轮诱变,经摇瓶复筛,获得一株高产L-丝氨酸菌株SYPS-062-33a,将该突变株划线分离,得到一株遗传稳定的高产菌株SYPS-062-33a-18,其显微图像见图3b。

图3 谷氨酸棒杆菌SYPS-062-36及其突变株SYPS-062-33a-18的显微镜图Fig.3 Microscope images of C.glutamicum SYPS-062-36 and its derivative SYPS-062-33a-18
2.3 高产菌株的发酵特性
高产菌与出发菌在发酵过程中生物量、L-丝氨酸产量、残糖含量的变化见图4。由图4可以看出,菌体进入对数生长后期时,高产菌的生物量明显高于出发菌,发酵结束时,生物量为(6.56±0.23)g/L,而出发菌株为(5.61±0.24)g/L,较出发菌株提高了17.9%。高产菌在90 h时L-丝氨酸产量达到最高,为(11.0±0.25)g/L,L-丝氨酸产量较出发菌(6.65±0.23)g/L提高了65.4%,且发酵周期提前约6 h;高产菌株在对数生长前期(24~60 h)糖耗速率不及出发菌株,但在对数生长中后期(60~78 h)的糖耗速率高于出发菌株。
文献[16-17]报道,在谷氨酸棒杆菌胞内,大约7.5%的碳流是用于细胞生长和代谢所需(如蛋白质的合成、甘氨酸、半胱氨酸、色氨酸、磷脂的合成及一碳单元的产生)。本课题组前期研究发现:出发菌株C.glutamicum SYPS-062积累L-丝氨酸的原因可能与SHMT活性较低有关[10]。在本研究中,高产菌株C.glutamicum SYPS-062-33a-18的L-丝氨酸对蔗糖的转化率为0.183±0.009 mol/mol,较出发菌株C.glutamicum SYPS-062提高了64.9%,说明诱变使得更多的碳流流向L-丝氨酸。
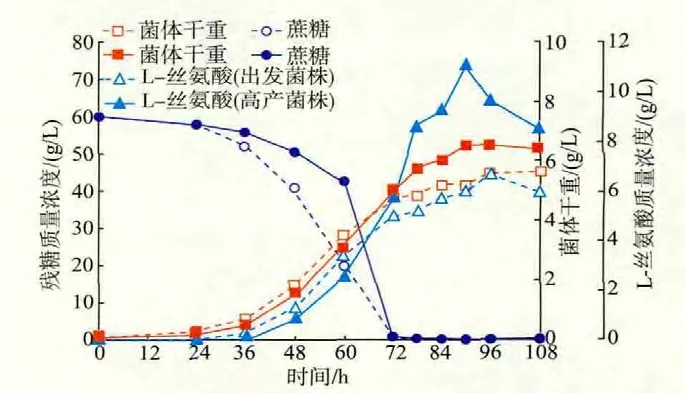
图4 出发菌株谷氨酸棒杆菌SYPS-062-36和其突变株SYPS-062-33a-18的发酵过程曲线Fig.4 Time course of L-serine fermentation by the parental strain C.glutamicum SYPS-062-36 and the mutant C.glutamicum SYPS-062-33a-18 in shake-flask fermentation
此外,将出发菌及高产菌分别发酵96 h和90 h,发酵液经过预处理后,在相同条件下测定氨基酸组分及含量。结果表明:出发菌的丙氨酸(Ala)产量为(2.05±0.15) g/L,缬氨酸 (Val)的产量为(1.51±0.19)g/L;相比之下,高产菌株的丙氨酸产量为(6.56±0.24) g/L,缬氨酸的产量为(3.00±0.20)g/L,分别较出发菌株提高了220%和99%。甘氨酸(Gly)、苏氨酸(Thr)、赖氨酸(Lys)等的产量也有了较大幅度的提高。
3 结语
以谷氨酸棒杆菌C.glutamicum SYPS-062-36为出发菌株,经DES逐级诱变处理,获得对D-丝氨酸有一定抗性的突变株C.glutamicum SYPS-062-33a-18,其 L-丝氨酸产量为(11.0±0.25) g/L,较出发菌株产酸量提高了65.4%。此外,突变株C.glutamicum SYPS-062-33a-18可以积累更多的丙氨酸、缬氨酸等其它氨基酸。本研究不仅以D-丝氨酸作为抗性平板筛选得到高产L-丝氨酸的突变株,而且为下一步进行反向代谢工程的研究提供了良好的实验材料。
[1]Ikeda M.Amino acid production processes[J].Adv Biochem Eng Biotechnol,2003,79:1-35.
[2]杨慧,包慧芳,王宁,等.响应面法优化黄色短杆菌c-11产L-丝氨酸发酵培养基[J].新疆农业科学,2011,48(11):2071-2077.YANG Hui,BAO Huifang,WANG Ning,et al.Optimization of fermentation medium for L-serine production by Brevibacterium flavum by using response surface methodology[J].Xinjiang Agricultural Sciences,2011,48(11):2071-2077.(in Chinese)
[3]Li Y,Chen G K,Tong X W,et al.Construction of Escherichia coli strains producing L-serine from glucose[J].Biotechnol Lett,2012,34(8):1525-1530.
[4]Peters-Wendisch P,Stolz M,Etterich H,et al.Metabolic engineering of Corynebacterium glutamicum for L-serine production[J].Appl Environ Microbiol,2005,71(11):7139-7144.
[5]Zhang X,Xu G,Li H,et al.Effect of cofactor folate on the growth of Corynebacterium glutamicum SYPS-062 and L-serine accumulation[J].Appl Biochem Biotechnol,2014,173(7):1607-1617.
[6]Eggeling L,Bott M.(2005) Handbook of Corynebacterium glutamicum[M].Boca Raton:CRC Press,USA.
[7]Peters-Wendisch P,Netzer R,Eggeling L,et al.3-phosphoglycerate dehydrogenase from Corynebacterium glutamicum:the C-terminal domain is not essential for activity but is required for inhibition by L-serine[J].Appl Microbiol Biotechnol,2002,60(4):437-441.
[8]Netzer R,Peters-Wendisch P,Eggeling L,et al.Cometabolism of a nongrowth substrate:L-serine utilization by Corynebacterium glutamicum[J].Appl Environ Microb,2004,70(12):7148-7155.
[9]Stolz M,Peters-Wendisch P,Etterich H,et al.Reduced folate supply as a key to enhanced L-serine production by Corynebacterium glutamicum[J].Appl Environ Microb,2007,73(3):750-755.
[10]林琳,窦文芳,张晓梅,et al.直接利用糖质原料产L-丝氨酸谷氨酸棒杆菌glyA基因序列分析[J].生物技术通报,2008(5):176-180.LIN Lin,ZHANG Xiaomei,DOU Wenfang,et al.Analysis of glyA gene from Corynebacterium glutamicum SYPS-062 which can produce L-serine from sugar substances[J].Biotechnology Bulletin,2008(5):176-180.(in Chinese)
[11]任建洪,张晓梅,窦文芳,等.不同来源的谷氨酸棒杆菌氨基脱氧分支酸合成酶的活性分析[J].中国生物工程杂志,2009,29(8):57-61.REN Jianhong,ZHANG Xiaomei,DOU Wenfang,et al.The activity study of aminodeoxychorismate synthase of different Corynebacterium glutamicum[J].China Biotechnology,2009,29(8):57-61.(in Chinese)
[12]张晓梅,窦文芳,许泓瑜,等.产L-丝氨酸菌株SYPS-062的鉴定及碳源对发酵的影响[J].微生物学通报,2009,36(6):789-793.ZHANG Xiaomei,DOU Wenfang,XU Hongyu,et al.Identification of L-serine producer SYPS-062 and the effect of different carbon source[J].Microbiology,2009,36(6):789-793.(in Chinese)
[13]金雪霞,张晓梅,窦文芳,等.谷氨酸棒杆菌SYPS-062 L-丝氨酸脱水酶活性分析及其基因敲除对L-丝氨酸积累的影响[J].中国生物工程杂志,2011,31(1):29-34.JIN Xuexia,ZHANG Xiaomei,DOU Wenfang,et al.Activity analysis of L-serine dehydratase and effect of the gene knock out on L-serine accumulation in Corynebacterium glutamicum SYPS-062[J].China Biotechnology,2011,31(1):29-34.(in Chinese)
[14]Zhang X,Dou W,Xu H,et al.Metabolic flux analysis of L-serine synthesis by Corynebacterium glutamicum SYPS-062[J].Chinese Journal of Biotechology,2010,26(10):1363-1371.
[15]Nevoigt E.Progress in metabolic engineering of Saccharomyces cerevisiae[J].Microbiol Mol Biol Rev,2008,72(3):379-412.
[16]Marx A,de Graaf A A,Wiechert W,et al.Determination of the fluxes in the central metabolism of Corynebacterium glutamicum by nuclear magnetic resonance spectroscopy combined with metabolite balancing[J].Biotechnol Bioeng,1996,49(2):111-129.
[17]Stauffer G V.Biosynthesis of Serine,Glycine,and One-Carbon Units[M].Washington DC:ASM Press,1996.
