高速逆流色谱法分离制备中药诃子中的没食子酸
2014-12-24李忠琴李秋云江兴龙关瑞章
李忠琴, 李秋云, 江兴龙, 张 坤, 关瑞章
(集美大学水产学院,鳗鲡现代产业技术教育部工程研究中心,福建 厦门361021)
诃子为使君子科植物诃子(Terminalia chebula Retz.)的干燥成熟果实,化学成分主要为鞣质及多元酚类、三萜类、黄酮类、脂肪类化合物及氨基酸等,具有抗菌、抗肿瘤、抗氧化、强心等作用。诃子主要活性成分鞣质具有收敛性,有沉淀蛋白或凝集蛋白的作用,因而具有抑菌作用[1,2]。其所含的活性成分没食子酸与诃子的生理作用密切相关[3]。没食子酸具有抗肿瘤、抑菌、抗病毒、保肝等[4]药理作用,在水产病害防治[5]上也具有一定的发展前景。
高速逆流色谱(high speed counter-current chromatography,HSCCC)最早的研究、应用者是美国国立卫生院的Ito 博士[6]。这是一种较新型的液液分配色谱技术,无须任何固体支撑体,可避免固定相对样品的不可逆吸附作用而造成的样品损失,无论是一次制备的量,还是制备纯度均得到极大的提高[7],被广泛应用于植物天然活性成分的分离制备[8-12],但尚未见其用于分离纯化诃子中没食子酸。本研究应用高速逆流色谱建立了分离制备中药诃子中没食子酸(见图1)的方法,该法操作简单,分离时间短,产物纯度高,对没食子酸功能活性的进一步研究具有重要意义。
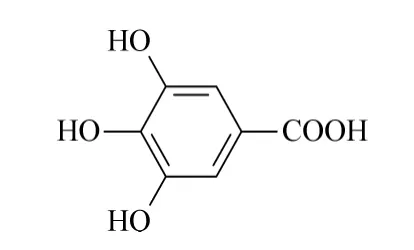
图1 没食子酸结构式Fig.1 Chemical structure of gallic acid
1 实验部分
1.1 仪器与试剂
高速逆流色谱仪(TBE-20A,TBE-300B,上海同田生化技术有限公司);高效液相色谱仪(Angilent 1100,美国安捷伦公司);冷冻超微粉碎机(SQW-601,山东三清不锈钢设备有限公司);超声破碎仪(XODL-1000N,南京先欧仪器制造有限公司);多样品平行蒸发仪(Multivapor P-6,瑞士BÜCHI 公司);超纯水机(Millipore 公司)。
中药诃子购于福建铭远制药有限公司;HSCCC分离中所用的正己烷、乙酸乙酯、甲醇、正丁醇、醋酸、无水乙醇等试剂均为分析纯(西陇化工股份有限公司);HPLC 分析中所用甲醇为色谱纯(美国TEDIA 公司),磷酸为分析纯(国药集团化学试剂有限公司),水为超纯水。没食子酸对照品(纯度≥98%,北京世纪奥科生物技术有限公司)。
1.2 实验方法
1.2.1 诃子粗提物的制备
将中药诃子用超微冷冻粉碎机粉碎至80 目左右,收集超微药粉备用。称取诃子超微粉7.5 g,加入60% (v/v)乙醇水溶液150 mL,料液比为1∶20,50 ℃下超声50 min,过滤药渣,将药液置于多样品平行蒸发仪中减压浓缩,得到乙醇粗提浸膏,4 ℃下保存备用。
1.2.2 高速逆流色谱溶剂体系的确定
根据分离物质的性质及溶剂极性的大小,采用分析型HSCCC(TBE-20A)确定选用正己烷-乙酸乙酯-甲醇-水(1∶5∶1∶5,v/v/v/v)体系。上相为固定相,下相为流动相,超声脱气20 min,紫外检测波长254 nm。
1.2.3 高速逆流色谱分离制备
采用制备型HSCCC(TBE-300B)进行分离制备。将固定相以30 mL/min 的流速迅速泵入HSCCC螺旋管柱中,待固定相流出约30 mL 后停泵,主机正转,转速调至850 r/min,再以2 mL/min的流速泵入流动相,待流动相流出且两相溶剂达到动态平衡时将制备好的20 mL 样品注入HSCCC 仪中,开启色谱工作站开始采集数据。紫外检测波长254 nm,柱温25 ℃。根据色谱图收集各组分,真空冷冻干燥。
1.2.4 纯度分析及结构鉴定方法
采用HPLC 对HSCCC 分离的各组分进行检测,根据面积归一法判断其纯度。流动相组成:A(甲醇)-B(0.1% 磷酸水溶液)(5∶95,v/v),流速1 mL/min,柱温25 ℃,紫外检测波长270 nm。组分Ⅲ质量浓度为0.015 mg/mL,标准品质量浓度为0.020 mg/mL,进样量20 μL。结合电喷雾电离质谱(ESI-MS)负离子模式分析,推断其质量数,并与标准品的HPLC 谱图对比,鉴定产物结构。
2 结果与讨论
2.1 HSCCC 分离体系的筛选
采用分析型HSCCC 考察了5 个分离体系(见表1)。结果发现,采用正己烷-乙酸乙酯-甲醇-水(1∶5∶1∶5,v/v/v/v)的分离效果最好(见图2),得到4个峰(组分Ⅰ/Ⅱ/Ⅲ/Ⅳ),分离时间为50 min,固定相保留率为45%,达到逆流色谱分离要求。实验中还发现,适当降低流速、提高转速可提高保留率,但流速太小时分离时间过长,转速过大时体系易出现乳化现象。进样量也影响各峰的分离度,进样量太大会导致峰间距变窄,峰形变宽,分离度降低。因此,最终确定分析型HSCCC 的流速为1 mL/min,转速为1 800 r/min,进样量为2 mg。
2.2 HSCCC 分离制备结果
以分析型HSCCC 优化的溶剂体系正己烷-乙酸乙酯-甲醇-水(1∶5∶1∶5,v/v/v/v)为参考,经微调流速和转速后可直接用于制备型HSCCC 进行放大制备,重复2 次进样,分离图谱见图3。该体系放大应用于制备型HSCCC,重现性好,也可分离出4个组分峰,各组分的保留时间、分离度及峰形与分析型色谱的结果基本一致,且第一次进样和第二次进样分离的峰形也一致,表明该溶剂体系稳定性好,线性放大方法具有可行性及高效性。在确定溶剂体系后,通过综合各参数的影响,确定制备型HSCCC 的流动相流速为2 mL/min,转速为850 r/min。进样量对各峰的分离度影响最大,当制备型HSCCC 进样量达到100 mg 以上时,前3 个峰的分离度大大降低。因此每次最大进样量为100 mg,并采用多次连续进样,这样可以省去平衡时间,节约溶剂,提高产
物得率。各分离组分的含量见表2。在该条件下,体系的固定相保留率为63%,较分析型的有所增加,分离得到8.6 mg 没食子酸。与制备型HSCCC相比,分析型HSCCC 的灵敏度高、分离时间短,样品的进样量、流动相的流速、转速对分离效果的影响更大。但由于分析型HSCCC 主要用于筛选分离溶剂体系,本研究中未对分析型HSCCC 的分离条件进行再优化,而只优化了制备型HSCCC 的分离条件。故从图谱上可以明显看出制备型的分离效果好于分析型。
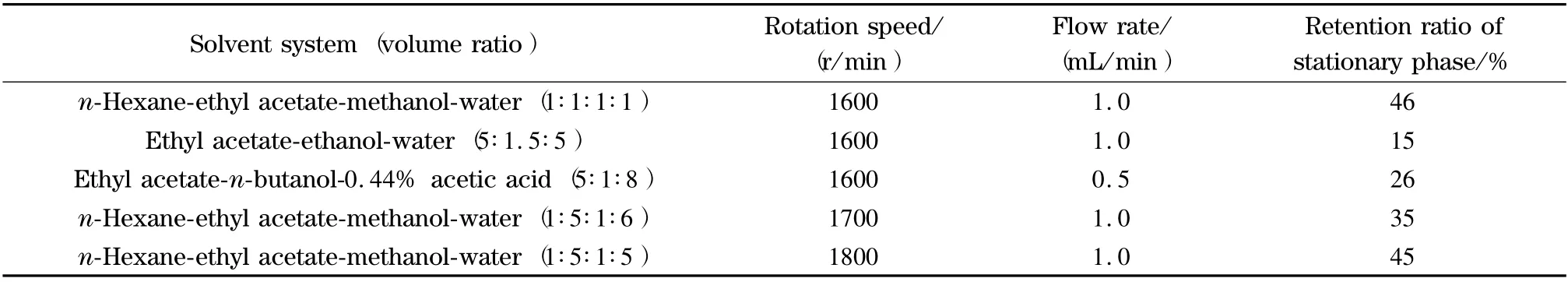
表1 诃子主要成分分离的HSCCC 溶剂系统的优化Table 1 Optimization of the solvent systems of HSCCC for the separation of main constituents from Terminalia chebula Retz.
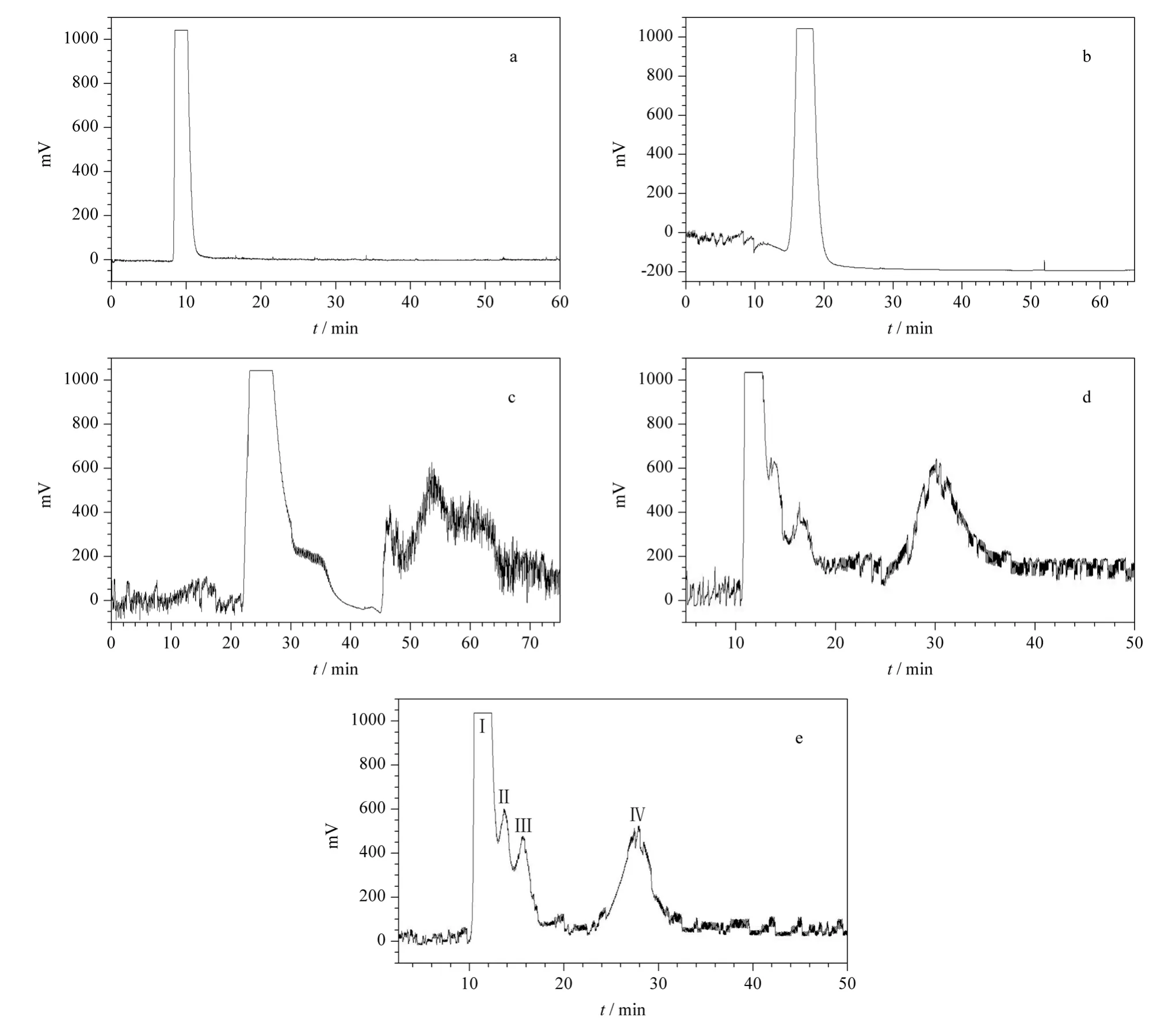
图2 分析型高速逆流色谱分离诃子醇提物的色谱图Fig.2 Chromatograms of crude extract from Terminalia chebula Retz. by analytical HSCCC
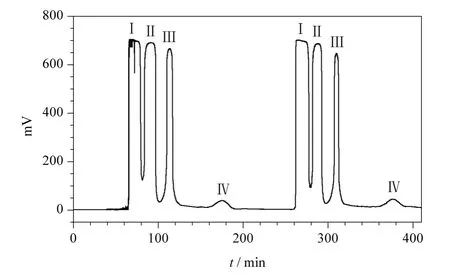
图3 制备型HSCCC 分离诃子没食子酸色谱图Fig.3 Chromatograms of gallic acid extracted from Terminalia chebula Retz. by preparative HSCCC
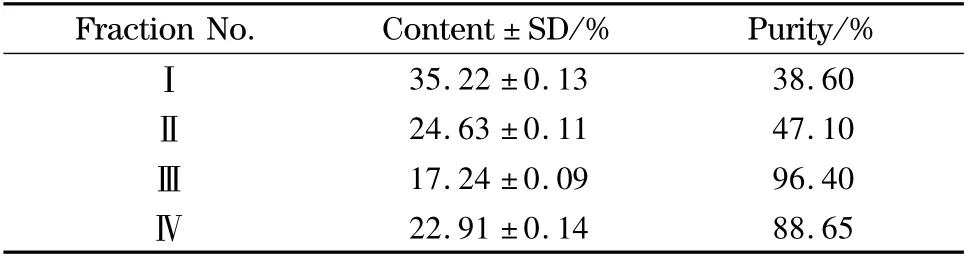
表2 制备型高速逆流色谱分离诃子的各主要组分的分析结果(n =3)Table 2 Analysis results of the main constituents from Terminalia chebula Retz. by preparative HSCCC (n =3)
2.3 纯度分析及结构鉴定
采用1.2.4 节中的色谱条件对收集的各组分进行检测的结果见表2,按照峰面积归一法计算,得到组分Ⅲ的纯度为96.4%,HPLC 谱图见图4a。将该组分与没食子酸标准品(见图4b)进行HPLC 对比分析,结果表明两者的峰形及保留时间完全一致。对组分Ⅲ进行电喷雾电离质谱分析(见图5),结果显示[M-H]-(m/z 169)、[M -H -CO2]-(m/z 125)与文献[13]中报道的没食子酸质谱数据一致,即没食子酸的相对分子质量为170,在负离子模式下脱去一个H 后为169,脱去一个CO2后为125。另外,计算分子离子峰的同位素相对丰度比,并与Iso-Pro 3.0 软件计算得到的没食子酸同位素相对丰度比相比较,发现两者的比值一致。因此,可以确定组分Ⅲ为没食子酸,且纯度达到96.4%。与已报道文献中的研究结果比较,如Lu 等[14]采用逆流色谱并结合制备液相色谱法从石榴皮中纯化没食子酸,采用乙酸乙酯-甲醇-水(50∶1∶50,v/v)体系,分离得到的没食子酸纯度为26.7%,再经制备液相色谱纯化后没食子酸的纯度达到96%,而本文方法可以一步纯化得到高纯度的没食子酸。
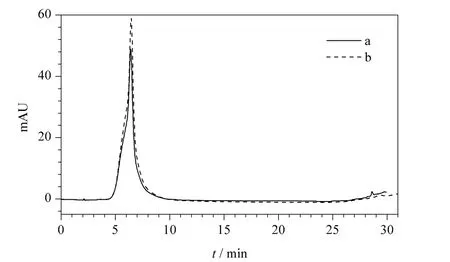
图4 (a)组分Ⅲ和(b)没食子酸标准品的HPLC 谱图Fig.4 HPLC chromatograms of (a)fraction Ⅲand(b)gallic acid standard substance
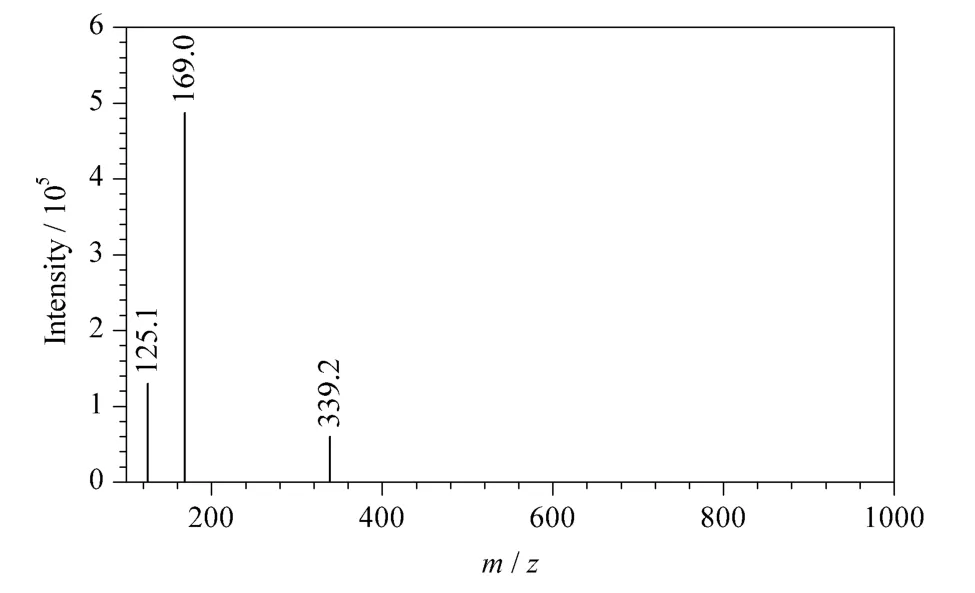
图5 组分Ⅲ的质谱图Fig.5 MS spectrum of fraction Ⅲ
3 结论
本研究通过分析型HSCCC 获得了分离诃子中没食子酸的溶剂体系为正己烷-乙酸乙酯-甲醇-水(1∶5∶1∶5,v/v/v/v),并成功放大于制备型HSCCC,通过一步纯化从100 mg 诃子醇提物中获得8.6 mg 没食子酸,纯度达到96.4%,分离时间为2 h,证明了线性放大的可行性及高效性。本文方法可以一步纯化得到高纯度的没食子酸,更省时、简便,可为没食子酸标准品的制备及扩大生产提供参考,并为其药理作用的进一步研究提供物质基础。
[1] Guo J,Yang H L. Journal of Pathogen Biology (郭军,杨恒林. 中国病原生物学杂志),2013,8(1):89
[2] Zhang R. Animal Husbandry and Feed Science (张蕊. 畜牧与饲料科学),2013,34(5):13
[3] Pan G Q,Lu Y C,D J C M. Chinese Traditional and Herbal Drugs (潘国庆,卢永昌,德吉措姆. 中草药),2006,37(9):1350
[4] Ke F M,Zhang K L. Journal of Luzhou Medical College (柯发敏,张开莲. 泸州医学院学报),2011,34(4):440
[5] Lu J,Wang Z N,Chen R,et al. Acta Hydrobiologica Sinica(卢静,王振宁,陈锐,等. 水生生物学报),2013,37(6):1128
[6] Ito Y. J Chromatogr A,2005,1065(2):145
[7] Chen S W,Pan Y Q,Cai J Q. Tianjin Pharmacy (陈苏伟,潘勇琴,蔡纪青. 天津药学),2008,20(1):74
[8] Li X D,Li X G,Song S H,et al. Chinese Journal of Chromatography (李小多,李学刚,宋尚华,等. 色谱),2012,30(9):971
[9] Han Q B,Song J Z,Qiao C F,et al. J Sep Sci,2006,29(11):1653
[10] Yao S,Li Y,Kong L Y. J Chromatogr A,2006,1115(1/2):64
[11] Liu Y L,Chen T,Chen C,et al. Chinese Journal of Chromatography (刘永玲,陈涛,陈晨,等. 色谱),2014,32(5):543
[12] Tian G L,Zhang T Y,Yang F Q. J Chromatogr A,2000,886(1/2):309
[13] Chen X X,Zhang L Y,Wan J Z,et al. China Journal of Chinese Materia Medica (陈欣霞,张丽艳,万金志,等. 中国中药杂志),2010,35(15):1957
[14] Lu J J,Wei Y,Yuan Q P. Sep Purif Technol,2007,55(1):40
