Matrigel胶对大鼠海马神经干细胞增殖及分化的影响*
2014-12-17宋来君郭新宾
邓 鑫,宋来君,郭新宾
郑州大学第一附属医院神经外科郑州450052
#通讯作者,男,1952年9月生,教授,主任医师,研究方向:神经外科的基础与临床,E-mail:laijunsong@126.com
神经干细胞(neural stem cells,NSCs)是一类具有分裂潜能和自我更新能力的母细胞,可以通过不对等的分裂方式产生神经组织的各类细胞,如神经元细胞、星形胶质细胞、少突胶质细胞等[1],周围外环境可对其分裂增殖以及分化等产生显著影响。以往对神经干细胞的体外培养通常采用普通平面培养方式,与其体内生长环境有较大差异。Matrigel 胶是从富含胞外基质蛋白的EHS 小鼠肿瘤中分离出的一种细胞外基质,包含如层连接蛋白、Ⅳ型胶原等细胞外基质[2],可构建适于细胞生长的三维立体支架。Irons 等[3]将神经元和星形胶质细胞嵌入到Matrigel 胶基底膜基质中,构建适于细胞生长的三维平台,结果显示Matrigel 胶中的神经元伸出长的突起,表达成熟神经元特异性的细胞骨架蛋白,且用膜片钳检测到了电生理学信号,表明了功能性突触的形成。同样有研究[4]表明,Matrigel 胶有助于雪旺细胞的延伸和生长。作者通过将体外培养的海马NSCs 接种于Matrigel 胶内,观察Matrigel 胶形成的立体支架对于NSCs 的影响,以研究立体培养对于NSCs 增殖及分化的作用。
1 材料与方法
1.1 实验动物及试剂 出生24 h 内的SD 大鼠,SPF 级,雌雄不限,由郑州大学实验动物中心提供。DMEM/F12 培养基(Hyclone 公司),B27 Supplement(50×,Gibco 公司),碱性成纤维细胞生长因子(bFGF,Invitrogen 公司),表皮细胞生长因子(EGF,Gibco公司),青-链双抗(Solarbio 公司),小鼠抗大鼠巢蛋白(Nestin)单克隆抗体、羊抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体(Santa Cruz 公司),兔抗大鼠β-tubulinⅢ蛋白单克隆抗体(EPITOMICS 公司),SABC 标记山羊抗小鼠IgG多克隆抗体、SABC-HRP、SABC-FITC(武汉博士德公司),Dylight594 标记驴抗羊多克隆抗体、FITC 标记驴抗兔多克隆抗体(Immunoreagents 公司)。Matrigel 胶(美国BD 公司)订购于2013年3月,有效期3 个月,冰上融化分装为1 mL 后置于-20℃保存。
1.2 NSCs 的培养 取新生SD 大鼠,乙醇消毒后于超净工作台内去头处死,取海马区脑组织剪碎,胰蛋白酶消化8 min 后加入胎牛血清终止,轻柔吹打后以1 200 r/min离心4 min,弃上清,沉淀以PBS 混悬液吹打、离心,重复2 次后以正常培养基(DMEM/F12 培养基按体积比1∶50 比例加入B27 Supplement 和20 ng/L bFGF、20 ng/L EGF、40 U/mL 肝素)混悬,200 目筛网过滤后进行细胞计数,以1×106mL-1接种25 cm2培养瓶中,置37℃、体积分数5% CO2培养箱中培养。每天观察,每3 d 换液1 次。原代培养7 d 后进行传代,传代后每3 d 换液1 次,每7 d 传代1 次。
1.3 NSCs 的鉴定 将传至第3 代的细胞接种至包被多聚赖氨酸的24 孔板中,过夜后去除培养基,PBS冲洗3 次后用多聚甲醛固定,4℃过夜,吸弃多聚甲醛,PBS 冲洗5 min,连续3 次后加入体积分数3%H2O2甲醇溶液作用10 min,PBS 冲洗5 min(3 次),吸去PBS,加入50 g/L BSA 室温封闭1 h 后吸去BSA,加入以抗体稀释液稀释至1∶200 的小鼠抗大鼠Nestin 蛋白单克隆抗体(对照组仅加入抗体稀释液),4℃过夜后,吸弃抗体,PBS 冲洗5 min,连续3 次,加入SABC 标记山羊抗小鼠IgG 多克隆抗体(1∶100 稀释),37℃30 min 后,吸弃抗体,PBS 冲洗5 min,连续3 次,加入SABC-HRP 作用20 min,PBS 冲洗5 min,连续4 次后,加入DAB 显色液显色,显微镜下控制显色,约2 min 后吸弃显色液,镜下观察,拍照。
1.4 NSCs 的接种培养 24 孔板第1、2 排12 孔内加入200 μL 多聚赖氨酸静置过夜包被。将传至第3 代的NSCs 吹打混匀,取一半均匀接种至包被多聚赖氨酸的孔内;另一半1 200 r/min 离心4 min,离心管内保留0.5 mL 上清液,玻璃吸管轻柔吹打混匀后与2 mL Matrigel 胶混匀,以200 μL/孔接种于第3、4排孔内。接种完成后放入培养箱内培养3 h,显微镜下观察神经球贴壁、Matrigel 胶凝固后去除原培养基,在第1、3 排孔内加入正常培养基,分别标记为A组、C组;第2、4 排孔内加入血清培养基(DMEM/F12 培养基+体积分数10%胎牛血清),分别标记为B组、D组,置37℃、体积分数5% CO2培养箱中培养,每天换液,连续培养1 周。
1.5 NSCs 接种培养后细胞中Nestin、β-tubulinⅢ、GFAP 蛋白的免疫荧光染色检测 NSCs 接种1 周后,吸弃培养基,40 g/L 多聚甲醛固定过夜后,4组各取6 孔,分别进行Nestin、β-tubulinⅢ、GFAP 蛋白免疫荧光染色,一抗均按1∶200 稀释,并以DAPI进行细胞核染色后,在200 倍荧光显微镜下观察、拍照。通过Image-Pro Plus 6 软件分析所得图片,以阳性荧光染色细胞个数比DAPI 蓝色荧光染色的细胞核个数,得到阳性率。
1.6 统计学处理 采用SPSS 16.0 进行分析,应用2×2 析因设计的方差分析比较4组NSCs 中Nestin、β-tubulinⅢ、GFAP 蛋白免疫荧光染色阳性率的差异,检验水准α=0.05。
2 结果
2.1 NSCs 的培养及鉴定结果 显微镜下观察,原代提取细胞刚接种时呈单个悬浮圆形细胞,边界清楚,胞核大,胞质折光性强(图1A);3 d 后开始出现小的细胞球,由5~8 个细胞组成(图1B);原代培养4~5 d,细胞球增大,形成约几十个细胞组成的细胞球(图1C);第7 天左右,形成约几百个细胞组成的细胞球(图1D)。NSCs 传代后形成单细胞和少量小细胞球组成的细胞悬液,传代第2~3 天小细胞球形成,至第5 天形成约几百个细胞组成的细胞球。第3 代细胞经Nestin 免疫细胞化学染色后,镜下可见神经球大部分细胞胞质深棕色染色,呈阳性(图2A),对照组神经球细胞呈淡黄色(图2B)。免疫细胞化学染色显示神经球内细胞Nestin 蛋白高表达,证实为NSCs。

图1 海马NSCs 形态学观察(A:×200;B、C、D:×400)
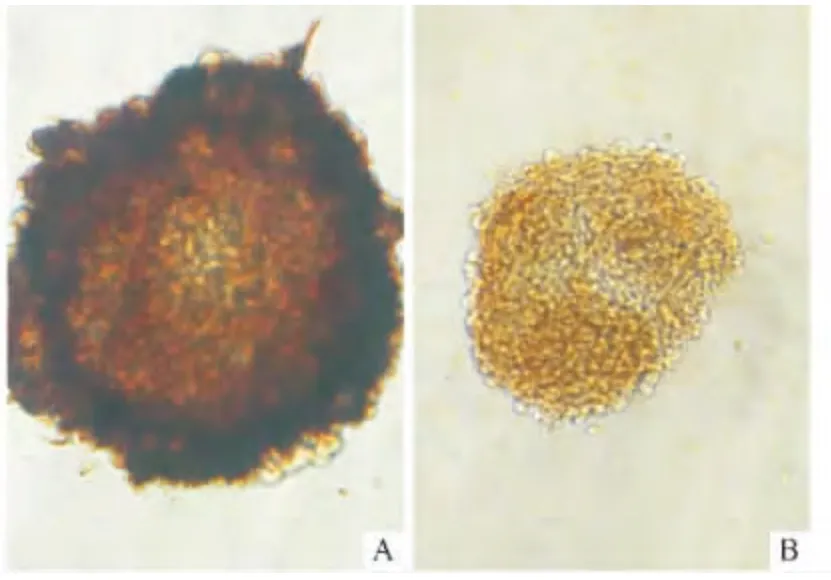
图2 Nestin 免疫细胞化学染色结果(SABC-HRP 法,×400)
2.2 4组NSCs 第3 代细胞培养结果 A组NSCs贴壁后,分化较为缓慢,迁出细胞较其他3组少,神经球结构保留,迁出细胞以神经球为中心沿孔底平面放射状迁出(图3A);B组细胞分化迅速,神经球结构大多消失,分化细胞形成平面的网状结构(图3B);C组细胞分化较A组明显,迁出细胞明显增多,神经球结构存在,较A组偏小,迁出细胞以神经球为中心,向各方向立体放射(图3C);D组细胞分化明显,神经球结构消失,形成立体的网状结构(图3D)。
2.3 4组NSCs 中Nestin、β-tubulinⅢ、GFAP 蛋白表达的比较 见图4、表1。

图3 4组NSCs 形态学观察(×200)

图4 Nestin、β-tubulinⅢ、GFAP 蛋白免疫荧光染色结果
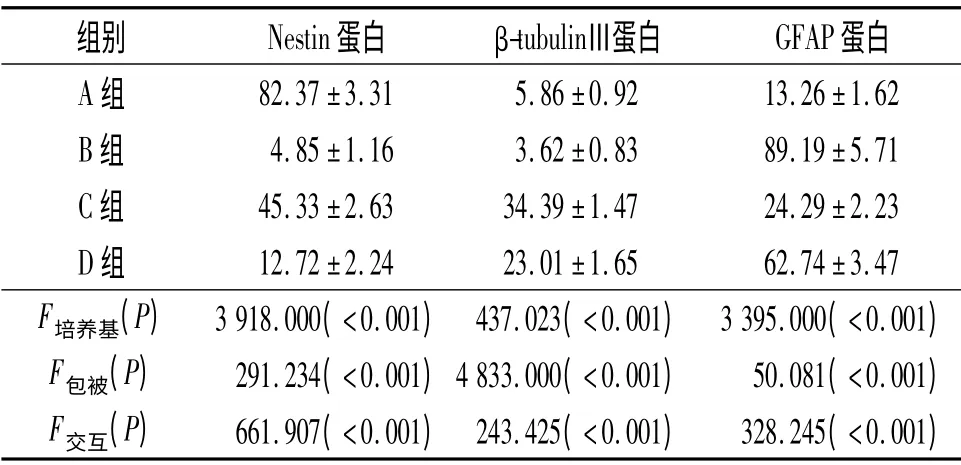
表1 4组NSCs 中Nestin、β-tubulinⅢ、GFAP 蛋白的表达(n=6)%
3 讨论
干细胞最早接触的细胞外基质就是基底膜,在胚胎发育中,基底膜成分是最早合成的细胞外基质,在二细胞期就有Lamrnin 表达。Lamrnin 是一种可溶性的大分子糖蛋白,分布在细胞外基质中,其分子上存在某些细胞表面粘附分子的结合位点,以此促进细胞的粘附、生长与分化[5],众多体外培养实验证明,Lamrnin 可以促进轴突的生长,被广泛地应用于引导轴突损伤后的定向生长、再生,以及细胞的迁移等组织工程研究[6]。Lamrnin 是Matrigel 胶中主要的促进分化的因子。Matrigel 胶能促进很多不同类型的细胞系或原代培养细胞在形态学上和基因表型中表现出分化的表型[7]。有研究[8-9]报道Matrigel 胶中细胞分化的情况与具体的细胞种类有关,细胞与细胞间可发生三维立体联系,组成与组织来源近似的结构。此外,Matrigel 胶还含有多种细胞外基质、蛋白酶和生长因子等,均能参与调节细胞的生长、分化、迁移,且Matrigel 胶的最大优点在于其组成成分以及比例与体内基质膜相同,可以塑造与体内相似的生长环境,是理想的体外培养平台。
作者在实验中应用Matrigel 胶为NSCs 创造三维立体培养环境,以观察在模拟体内环境的条件下NSCs 的生长与分化情况。Nestin 是一种中间丝类型的蛋白,能够特异性地表达在神经上皮干细胞上[10-11]。A组采用多聚赖氨酸促使NSCs 贴壁,添加正常培养基培养,细胞球结构仍保留完好,部分细胞因贴壁迁出细胞球分化,Nestin 免疫荧光染色大多数细胞呈阳性反应,表明细胞分化程度低,仍存在细胞增殖。B组细胞同样采取多聚赖氨酸促使NSCs 贴壁,并添加体积分数10%胎牛血清诱导分化,细胞球结构迅速解离,Nestin 免疫荧光染色仅少量细胞呈阳性反应,表明细胞分化迅速完全。C组NSCs 接种到Matrigel 胶内,与A组相比,Nestin 染色阳性细胞集中于细胞球中,迁出细胞明显增多,大多呈Nestin 阴性,Nestin 阳性率低于A组,说明Matrigel 胶可能存在促进NSCs 分化的作用。D组NSCs接种到Matrigel 胶后给予胎牛血清促进分化,与B组相比,Nestin 阳性率提高,且存在较小的细胞球结构,表明Matrigel 胶在促进NSCs 分化的同时,可能能够为NSCs 生长提供良好的生长环境,且存在一定的促进NSCs 增殖能力。
β-tubulinⅢ是一种微管蛋白,特异性地分布于神经元和睾丸细胞中,是一种理想的神经元标志物[12]。A组β-tubulinⅢ阳性细胞散在细胞球外,阳性率较低;B组则仅有少量细胞呈β-tubulinⅢ阳性;C组β-tubulinⅢ阳性细胞率高于A组,D组高于B组,表明Matrigel 胶可以促进NSCs 向神经元分化。
GFAP 是一种中间丝蛋白,其主要存在于星形胶质细胞内,可以作为胶质细胞的标志物。通过GFAP 免疫荧光染色比较,A组GFAP 阳性细胞主要分布于细胞球外,球内表达较少;B组则呈现大量GFAP 阳性细胞;C组GFAP 阳性率高于A组,表明Matrigel 胶可促进NSCs 分化;D组细胞GFAP 阳性率远低于B组,表明Matrigel 胶促进NSCs 分化作用中,神经元诱导分化倾向要强于胶质细胞倾向。
综上所述,Matrigel 胶可以为NSCs 的增殖与分化提供良好的三维支架支撑作用,使NSCs 立体生长,并能促进NSCs 的增殖与分化,且能够诱导NSCs向神经元方向分化。因此,Matrigel 胶对于研究NSCs 的生长分化规律有实际的研究价值,并且在移植NSCs 治疗的研究中具有广阔的前景。
[1]Gage FH.Mammalian neural stem cells[J].Science,2000,287(5457):1433
[2]Kleinman HK,McGarvey ML,Hassell JR,et al.Basementmembrane complexes with biological-activity[J].Biochemistry,1986,25(2):312
[3]Irons HR,Cullen DK,Shapiro NP,et al.Three-dimensional neural constructs:a novel platform for neurophysiological investigation[J].J Neural Eng,2008,5(3):333
[4]Dewitt DD,Kaszuba SN,Thompson DM,et al.Collagen Ⅰ-matrigel scaffolds for enhanced Schwann cell survival and control of three-dimensional cell morphology[J].Tissue Eng Part A,2009,15(10):2785
[5]Patton BL,Miner JH,Chiu AY,et al.Distribution and function of laminins in the neuromuscular system of developing,adult,and mutant mice[J].J Cell Biol,1997,139(6):1507
[6]Kleinman HK,Philp D,Hoffman MP.Role of the extracellular matrix in morphogenesis[J].Curr Opin Biotechnol,2003,14(5):526
[7]Kleinman HK,Martin GR.Matrigel:basement membrane matrix with biological activity[J].Semin Cancer Biol,2005,15(5):378
[8]Li ML,Aggeler J,Farson DA,et al.Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells[J].Proc Natl Acad Sci USA,1987,84(1):136
[9]Baker JH,Huxham LA,Kyle AH,et al.Vascular-specific quantification in an in vivo Matrigel chamber angiogenesis assay[J].Microvasc Res,2006,71(2):69
[10]Zhu J,Gu H,Yao Z,et al.The nestin-expressing and nonexpressing neurons in rat basal forebrain display different electrophysiological properties and project to hippocampus[J].BMC Neurosci,2011,12:129
[11]Xu R,Wu C,Tao Y,et al.Nestin-positive cells in the spinal cord:a potential source of neural stem cells[J].Int J Dev Neurosci,2008,26(7):813
[12]Graham V,Khudyakov J,Ellis P,et al.SOX2 functions to maintain neural progenitor identity[J].Neuron,2003,39(5):749