慢性阻塞性肺疾病患者痰液小巨噬细胞中单核细胞趋化蛋白CCL的基因表达
2014-12-05赵晓峰
赵晓峰
(内蒙古医科大学附属人民医院呼吸科,呼和浩特 010050)
痰液小巨噬细胞是一种高度活跃的细胞,该细胞可增加慢性阻塞性肺疾病(COPD)患者呼吸道内炎症性反应[1]。COPD患者痰上清液细胞因子、趋化因子和蛋白酶水平表现为经常性增加,其痰液小巨噬细胞可能会带来上清蛋白和其他细胞特定的趋化因子表达模式。为此,本院研究了COPD患者和LPS刺激后健康者中痰小巨噬细胞趋化因子的表达,现报告如下。
1 资料与方法
1.1 临床资料
选取3组人群,健康对照者8例,男3例,女5例,年龄(32.2±9.4)岁;COPD组11例,男10例,女1例,年龄(66.6±11.1)岁,预计平均 FEV1值(41±8.3)%;以及吸入20μg LPS的健康招募者4例(以下简称LPS组),男2例,女2例,年龄(47.2±20.9)岁,通过肺活量和身体体积描记法测定呼吸系统症状和肺功能参数。3组在性别、年龄方面差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
1.2.1 痰诱导处理 收集各组诱导痰之前需对LPS组事先作处理,24h之内对4例健康者行诱导痰收集与检查,经LPS刺激性吸入24h后再次进行痰液采集,吸入次数计算以20μg LPS沉积于呼吸道为准。LPS组纳入标准为健康者吸入最高剂量乙酰甲胆碱时均表现出微弱的不良反应或几乎无不良反应(气道阻力增加不到2倍)。COPD组和健康对照组患者雾化吸入经过灭菌的生理盐水,COPD患者吸入0.9%~3%,健康对照组吸入0.9%~5%。吸入者要求用力用鼻吹气,并洗净嘴巴,对准培养皿方向用力咳嗽。COPD患者和对照组雾化生理盐水吸入时间不超过15min,对咳痰立即作冷冻处理。为排除其他干扰因素,COPD组、LPS组与健康对照组的咳痰于同一条件统一处理。痰液用4倍量二巯基苏糖醇(sputolysin)稀释使溶液均匀,痰液/Sputolysin放置于37℃水浴中维持20min,随后加入等体积的磷酸盐缓冲溶液(PBS)(PH=7.4)。产生的细胞悬浮液,通过100μm和40μm的细胞筛过滤大分子凝聚物,将细胞800g在4°C下离心10min。收集上清液检测蛋白,并用台盼蓝染色排除法对粒细胞进行存活力分析。分离细胞前,将细胞颗粒和悬浮分散于PBS(2%FCS)中用流式细胞仪对其染色。
1.2.2 痰巨噬细胞的分离 为了获得高纯度的痰巨噬细胞,下一步分离将采用RosetteSep细胞分离法。将细胞悬液3mL、滤除红细胞的单核细胞和50μL富集单核细胞混合,在室温条件下孵育20 min。细胞用组织培养等级PBS液1∶1稀释,用超过1∶1的淋巴细胞分离液分层,以800g离心30 min产生一个单核层。将单核细胞层抽滤洗净,悬浮于游离态LPS的PBS/2%FCS溶液中。对细胞计数,用台盼蓝排除染色法检测细胞存活力。隔离的痰液巨噬细胞再次通过流式细胞仪分析检查总纯度,为接下来的RT-PCR应用做准备。
1.3 观察指标
分离前后分别经RosetteSep法对小型和大型痰巨噬细胞分离测定;RT-PCR检测CCL系列基因和分析小巨噬细胞纯度。酶联免疫吸附(ELISA)法对单核细胞趋化蛋白(CCL2、CCL7、CC13和CCL22)作定量测定。
1.4 统计学方法
采用SPSS 10.0统计软件进行数据处理,两组均数比较用t检验,计量资料用均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 各组样本痰液小巨噬细胞的单核细胞趋化蛋白表达
据报道[2]发现,诱导痰样本中小巨噬细胞数目与COPD患者呼吸道中都检测到明显水平升高。而本研究中小巨噬细胞在8例健康对照组中的比例为4.9%,而11例COPD患者中小巨噬细胞比例达到80.6%。COPD组和LPS组小巨噬细胞水平明显高于对照组(P<0.01),LPS未吸入前小巨噬细胞水平也明显低于吸入LPS后(P<0.05)(见表1)。
表1 各组样本痰中小巨噬细胞水平(±s)
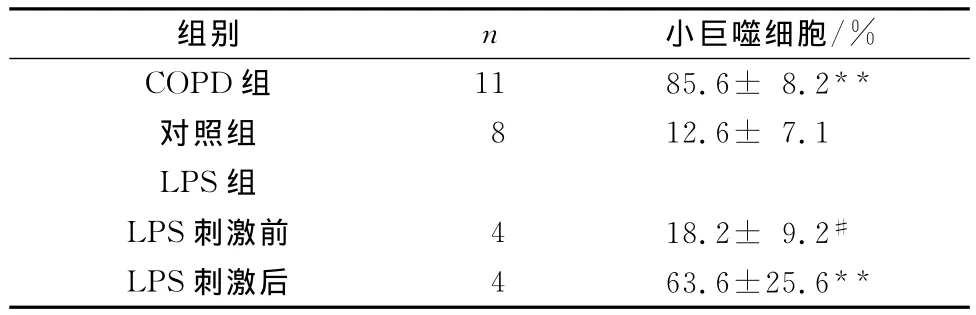
表1 各组样本痰中小巨噬细胞水平(±s)
与对照组比较,**P<0.01;与LPS组刺激后比较,#P<0.05
组别 n 小巨噬细胞/%COPD组 11 85.6± 8.2**对照组 8 12.6± 7.1 LPS组LPS刺激前 4 18.2± 9.2#LPS刺激后 4 63.6±25.6**
2.2 巨噬细胞中单核细胞趋化蛋白CCL系列表达
本研究发现与对照组相比较,COPD患者中CCL2、CCL7、CCL13和CCL22的mRNA明显高水平表达。COPD组患者CCL2水平约是对照组的16倍,CCL7水平约为对照组的13倍,CCL2为对照组的12倍。与对照组相比,COPD痰液小巨噬细胞中CCL表达水平增长最多的是CCL13,其水平增加了100多倍。LPS诱导痰液小巨噬细胞趋化因子表达模式中,CCL2、CCL7向上调节,而CCL13向下调节(见表2)。
表2 各组痰液巨噬细胞中单核细胞趋化蛋白CCL系列表达水平(倍)(±s)
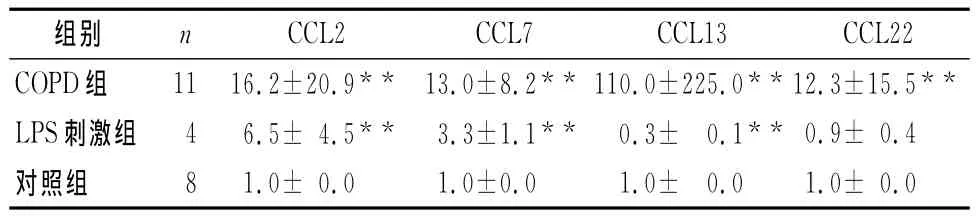
表2 各组痰液巨噬细胞中单核细胞趋化蛋白CCL系列表达水平(倍)(±s)
与对照组相比,**P<0.01
组别 n CCL2 CCL7 CCL13 CCL22 COPD组 11 16.2±20.9** 13.0±8.2** 110.0±225.0**12.3±15.5**LPS刺激组 4 6.5± 4.5**3.3±1.1**0.3± 0.1** 0.9± 0.4对照组8 1.0± 0.0 1.0±0.0 1.0± 0.0 1.0± 0.0
3 讨论
痰液分析是一种通过非侵入分析法了解炎症呼吸道疾病的过程[3,4]。关注于细胞游离痰上清液,以及细胞因子、趋化因子、蛋白酶水平增加的报道有很多,以COPD呼吸道炎症为例,患者中性粒细胞水平往往骤然增加[5]。在COPD患者与囊性纤维化患者中可以看到,患者体内大巨噬细胞往往会转变成小巨噬细胞,这些细胞虽然对LPS受体(CD14)基因和抗组织相容性抗原-DR有持续高水平表达,但也下调了巨噬细胞表面清道夫受体的表达,降低了细胞吞噬功能[6]。
通过对炎症疾病的研究[7]发现:诱导痰样本的炎症患者中小巨噬细胞百分比显然高于健康对照组。小巨噬细胞是COPD患者经LPS刺激诱导的呼吸道炎症模型中一类重要的细胞。本研究对纯化痰小巨噬细胞的基因表达做研究并集中讨论趋化因子,趋化因子可以引起其他白细胞比如中性粒细胞(CXC-趋化因子)、淋巴细胞和单核细胞(CC-趋化因子)定向移动。
趋化因子可以分成两大类,即CXC趋化因子和CC趋化因子,它们的受体分别称CC受体和CXC受体。对15种趋化因子表达时的研究发现,COPD患者中CCL2、CCL7、CCL13和CCL22表达增加,而剩下的11种趋化因子表达未明显增加。CCL2(单核细胞趋化蛋白-1,MCP-1)通过多种类型细胞产生[8],其中包括成纤维细胞、内皮细胞、上皮细胞、平滑肌、系膜、星形胶质细胞、单核细胞和小胶质细胞。CCL7也称为单核细胞趋化蛋白-3(MCP-3),由多种炎症细胞因子诱导,而CCL7在COPD中的作用模式还未可知。CCL13也称为单核细胞趋化蛋白-4(MCP-4),它是一个有力的嗜酸性粒细胞趋化活性的CC趋化因子。Taha等[9]在哮喘患者诱导痰标本中检测出CCL13表达水平明显高于对照组。CCL22最初叫 MDC(巨噬细胞源性趋化因子),是由巨噬细胞和树突状细胞产生的趋化因子。LPS是革兰氏阴性菌细胞壁的组成部分[10],LPS通过与Toll样受体4(TLR-4)结合并激活 NF-κB信号通路,诱导炎症反应,包括各种趋化因子的表达。LPS诱导的炎症反应,包括全身反应如发烧、局部血液粒细胞增多、痰液中细胞因子增加和血液白细胞涌入增多。已证明LPS对肺呼吸道入侵会导致大量小巨噬细胞的涌入。与COPD患者痰巨噬细胞趋化因子的表达相比,经LPS刺激导致明显不同的趋化因子表达模式,表明不同诱导环境会导致痰液小巨噬细胞呈现出不同的特性。
Traves等[11]研究发现,COPD 患者诱导痰中CCL2蛋白水平明显增高,而支气管肺泡灌洗液则无此现象,这与本实验研究结果一致。目前对CCL7在COPD患者中的作用不明确,本研究中可见COPD患者痰巨噬细胞中CCL7、CCL2、CCL13和CCL22水平增加数倍,4种趋化因子水平增加最高的是CCL13,提示CCL13可能具有调节各类白细胞的作用。但趋化因子在炎症性疾病中的作用还值得进一步研究。
LPS组痰液小巨噬细胞明显增加,这些水平的增加可能是炎症非特异性反应的结果。虽然本研究中炎症患者的痰液小巨噬细胞水平均一致性升高,可COPD患者和LPS组患者之间的趋化因子细胞基因表达模式却不尽相同:COPD组趋化因子水平升高,而LPS组一些趋化因子水平却有下降,LPS组CCL13的表达水平比对照组小,而COPD组的CCL13水平却为正常对照组的100多倍。从研究结果来看,实验证实了COPD组患者和经LPS刺激后的健康者痰液小巨噬细胞水平都有明显增高;COPD组趋化因子基因表达模式对CCL2、CCL7、CCL13和CCL22都有诱导作用,而经LPS刺激后的健康者仅对CCL2、CCL7和CCL22有诱导作用。
[1]方利洲,李兴文.慢性阻塞性肺疾病稳定期痰中白细胞介素及细胞分类测定的意义[J].昆明医学院学报,2002,23(1):77-79,84.
[2]Wright AK,Rao S,Range S,et al.Pivotal Advance:Expansion of small sputum macrophages in CF:failure to express MARCO and mannose receptors[J].Journal of Leukocyte Biology,2009,86(3):479-489.
[3]朱金星,刘扣英,李莉,等.低流量和高流量超声雾化在COPD患者诱导排痰中的疗效比较[J].实用临床医药杂志:护理版,2008,3(6):3-4.
[4]Nicholas B,Djukanovic R.Induced sputum:a window to lung pathology[J].Biochemical Society Transactions,2009,37(Pt 4):868-872.
[5]Rutgers SR,Timens W,Kaufmann HF,et al.Comparison of induced sputum with bronchial wash,bronchoalveolar lavage and bronchial biopsies in COPD [J].European Respiratory Journal,2000,15(1):109-115.
[6]Rao S, Wright AK, Montiero W,et al. Monocyte chemoattractant chemokines in cystic fibrosis[J].Journal of Cystic Fibrosis,2009,8(2):97-103.
[7]Frankenberger M,Menzel M,Betz R,et al.Characterization of a population of small macrophages in induced sputum of patients with chronic obstructive pulmonary disease and healthy volunteers[J].Clinical &Experimental Immunology,2004,138(3):507-516.
[8]Deshmane SL, Kremlev S,Amini S,et al. Monocyte chemoattractant protein-1(MCP-1):an overview[J].Journal of Interferon &Cytokine Research,2009,29(6):313-326.
[9]Taha RA,Laberge S,Hamid Q,et al.Increased expression of the chemoattractant cytokines eotaxin,monocyte chemotactic protein-4,and interleukin-16in induced sputum in asthmatic patients[J].Chest,2001,120(2):595-601.
[10]Ying S,O'Connor B,Ratoff J,et al.Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease[J].The Journal of Immunology,2008,181(4):2790-2798.
[11]Traves SL,Culpitt SV,Russell RE,et al.Increased levels of the chemokines GROalpha and MCP-1in sputum samples from patients with COPD[J].Thorax,2002,57(7):590-595.
