作物遗传育种研究进展Ⅳ.双单倍体育种与反向育种
2014-12-05刘忠松
刘忠松
(湖南农业大学,长沙410128)
杂交是重要的育种手段。杂交的基础是基因重组。基因重组的基础是减数分裂时同源染色体的配对、形成交叉和姊妹染色单体的交换。一次减数分裂可实现的遗传重组程度取决于2个因素:(1)染色体数目(染色体自由组合);(2)同源染色体发生交换的数目和位置(交换重组)。染色体的交换和重组并不是随机发生的,有些区段易发生重组(热区),有些不易发生重组(冷区)。影响交换发生频率和位置的因素包括内在的基因型、性别和外在的温度、化学处理等因素[1]。
交换和重组由基因控制,著名的例子是小麦能阻止减数分裂前着丝点联会的Ph1基因。现在控制交换和重组的许多基因已经分离和克隆,如水稻中已经分离出28个减数分裂相关基因[2]。这些基因突变或表达改变(如超表达、沉默)都可能导致重组频率改变[3,4]。因而育种上可调控交换重组的发生频率,利用交换重组的差异开发新的育种方法。
1 双单倍体育种新方法
减数分裂的结果是产生配子,配子是具有单倍体染色体数目的细胞。由这种细胞发育成的植株是单倍体。单倍体染色体加倍后成为双单倍体。双单倍体具有纯合速度快、用于选择的群体小和隐性基因也能表达的优点,因而在育种上有重要应用价值。育种应用的关键是如何获得大量的单倍体植株。自从花药培养取得成功后,利用花药、小孢子或胚珠(未授粉子房)培养再生单倍体的方法被广泛采用,并取得显著效果[5~7]。但由花药、小孢子培养诱导产生单倍体需要离体培养设施、应用于育种存在基因型依赖性、分离扭曲、白化苗和体细胞变异等问题,更简便的单倍体诱导方法是育种家追求的目标。
1.1 球茎大麦技术
Kao和Kasha(1970)发现栽培大麦用球茎大麦花粉授粉,F1代中球茎大麦染色体选择性自动消失,出现了高频率的双单倍体(15.5%)和单倍体(11.0%),从而创建了球茎大麦技术。采用球茎大麦技术诱导产生单倍体的步骤如下:(1)种植做母本的栽培大麦材料(如F1),必要时进行春化处理;(2)将花粉亲本球茎大麦进行春化处理,以保证与栽培大麦材料花期同步;(3)栽培大麦去雄,当2~3 d后开花时用球茎大麦花粉适时授粉,保持温度高于18℃;(4)授粉1 d后用“75∶2∶1”(GA375 mg/L+2,4-D 2 mg/L+麦草畏(dicamba)1 mg/L)加Tween20TM12滴/L喷施到授粉后的小花上。如有必要喷施杀虫剂。用褐纸袋代替硫酸纸袋给麦穗套袋;(5)当胚长达1.5 mm时,剥取种子用次氯酸钠稀释液进行种子表面灭菌;(6)在无菌条件下分离出胚,然后将充分发育的胚转移到不含2,4-D的B5培养基上,并使盾片面朝下;(7)首先进行暗培养,直至苗长1~2 cm时再转移至光照培养,20~25℃都是适宜的培养温度;(8)当主分蘖达到50 mm长时,将小植株移栽到盆钵中,置于温室;(9)形成了3个分蘖时用秋水仙碱(0.05%)和DMSO(2%)溶液在30℃下处理5 h进行加倍,处理结束后用自来水冲洗;(10)重新盆栽加倍处理的植株,让其返青,成熟时收获双单倍体种子[8]。
受球茎大麦技术的启发,后来发现普通小麦与球茎大麦、玉米、Tripsacum dactyloides、Pennisetum glaucum、Coix lacryma - jobi、Imperata cylindrica、燕麦与玉米、小黑麦与Imperata cylindrica等植物属间杂交、马铃薯与S.phureja种间杂交也能诱导染色体选择性消除,从而诱导母本单倍体产生[9]。
1.2 玉米花粉授粉诱导小麦单倍体技术
Niu等(2014)详细评述了小麦利用玉米花粉授粉诱导单倍体的过程和影响因子,并建立玉米花粉杂交诱导小麦单倍体的途径:(1)在小麦杂种F1种植前10~14 d种植甜玉米(如杂种品种Early Sunglow),每隔5~7 d种植一批,共种植5~6批;(2)在种植第3批甜玉米时种植小麦杂种F1;(3)小麦抽穗时人工去雄;(4)去雄后2~3 d用新鲜的玉米花粉给去雄的小麦穗授粉;(5)授粉后24 h用2,4-D(213.05 mg/L,pH=10.36)溶液喷施授过粉的小麦穗;(6)2,4-D处理后14~16 d将麦穗切下,分离种子用于胚挽救;(7)用70%乙醇将种子灭菌1 min,然后用20%Clorox(商用消毒液)灭菌20 min,用无菌蒸馏水清洗3次;(8)在无菌条件下分离胚,将胚接种在附加了50 g/L蔗糖和8%琼脂的MS基本培养基上,在室温(20~24℃)暗中培养大约2周;(9)胚萌发后将幼嫩的小苗转移到附加了30 g/L蔗糖和8 g/L琼脂的1/2 MS培养基上,在20~24℃、16 h/8 h光周期条件下培养大约2周;(10)当幼苗长至5~6 cm时移栽到盆钵中,在18~20℃、16 h/8 h光周期条件下生长,并施缓释肥;(11)当植株有2~3个分蘖时将植株从盆钵中挖出,根系彻底冲洗干净,将根系和根茎浸于秋水仙碱溶液(秋水仙碱0.45 g/L+DMSO 20 mL/L+GA3100 mg/L+Tween80 0.3 mL/L,pH=5.5)中,20 ~22℃暗中加倍处理8 h。加倍时要给秋水仙碱溶液提供轻柔的气流;(12)加倍处理后,用流水将植株冲洗过夜,然后栽回到盆钵中,并施缓释肥;(13)将植株在14~16℃、16 h/8 h光周期生长室生长大约2周直至植株返青(长出新的分蘖),再将植株搬到温室(20~24℃、16 h/8 h 光周期)种植直至成熟[10]。
1.3 玉米单倍体诱导技术
玉米的单倍体诱导不是通过种属间杂交,而是通过利用种内特殊的基因型即诱导系杂交进行,不仅能诱导母本(雌配子)单倍体,而且能诱导父本(雄配子)单倍体。不管诱导哪种类型的单倍体,都需要培育高效的单倍体诱导系、利用遗传标记高效鉴定单倍体和建立有效的染色体加倍技术。
玉米母本单倍体诱导最先使用的诱导系是Stock 6,后来培育出单倍体诱导率达10%的诱导系RWS及其姊妹系RWK-76。用这些诱导系在杂交时作父本,与拟诱导单倍体的玉米材料(如F2代植株)杂交所结的籽粒只有很少部分具有单倍体胚和三倍体胚乳,而大多数是正常的二倍体胚和三倍体胚乳。广泛利用的遗传标记是R1-nj基因,它与A1、A2、C1和C2同时存在于诱导系时使得正常籽粒胚和胚乳均呈深紫色,而具有单倍体胚的籽粒胚乳呈紫色,但胚无色。选留的具有单倍体胚的籽粒萌发后用0.06%的秋水仙碱处理进行染色体加倍。加倍后选择雄性可育植株自交获得双单倍体株系[11,12]。值得指出的是,这种方式获得的母本单倍体可能导入了诱导系的染色体片段[13]。
玉米父本单倍体诱导用具有ig1(位于3号染色体)和R1-nj纯合基因型诱导系作母本,与拟诱导单倍体的玉米材料(通常是r1/r1纯合体)进行杂交,对所结的籽粒按照前述方法根据胚有无颜色进行选择,选留无色胚作为雄配子单倍体,进行染色体加倍和自交处理[11]。
利用染色体易位系将ig1和R1-nj基因导入到不育细胞质中,培育细胞质雄性不育(CMS)ig1和R1-nj纯合基因型诱导系,利用这种具有不育细胞质的诱导系作母本,与拟诱导单倍体的玉米自交系(几乎全是r1/r1纯合体)进行杂交,通过选留无色胚的籽粒种植,只要鉴定出一株或几株雄配子单倍体植株,并用原来的优良自交系回交,就能将优良自交系转育成二倍体CMS系,所以转育CMS系只需2个世代,单倍体不需要加倍,而且育成的CMS系基因组与自交系完全相同[11]。
1.4 染色体选择性消除机制和着丝粒介导的单倍体诱导技术
上述通过杂交诱导单倍体的技术,亲本之一的染色体在授粉后几天(如玉米母本单倍体诱导在授粉后7 d、球茎大麦技术在授粉后5~9 d)内就选择性消失。为什么会发生这种染色体选择性消失目前尚不完全清楚[13]。Sanei等[14]研究发现,栽培大麦用球茎大麦花粉授粉后球茎大麦染色体分裂异常,落后于栽培大麦染色体,1周内完全消失,是因为这些落后的染色体没有CENH3(着丝粒特有的组蛋白H3变型)蛋白质,导致球茎大麦染色体着丝粒钝化,因而认为着丝粒CENH3蛋白质的丧失与染色体选择性消除有关,并提出了染色体选择性消除的机制(图1),即栽培大麦用球茎大麦花粉授粉后,在合子中双亲的CENH3基因均转录,并且栽培大麦的CENH3基因转录后还翻译为蛋白质,在细胞分裂周期的G2期上载到栽培大麦染色体的着丝粒,但不上载到球茎大麦染色体的着丝粒,导致球茎大麦的染色体由于着丝粒钝化在有丝分裂后期落后,形成微核,最终被降解,发育成栽培大麦的单倍体胚。
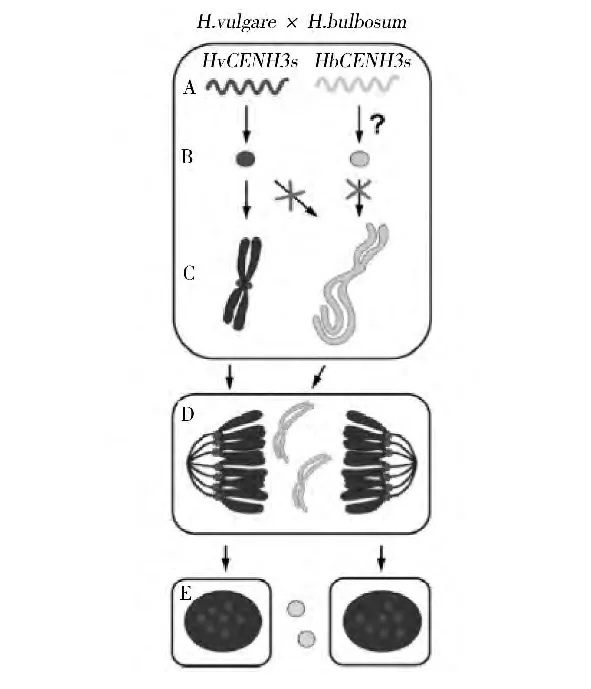
图1 球茎大麦授粉诱导栽培大麦单倍体的机制[14]
CENH3是着丝粒特有的蛋白质。Ravi和Chan[15]将CENH3蛋白进行改造,保持其 C端组蛋白折叠结构域,但在其N端连接上绿色荧光蛋白(GFP),并用H3.3变型替代H3变型,使CENH3变成了GFP-tailswap,具有GFP-tailswap基因型的植株育性低,尤其是雄性育性低。当GFP-tailswap植株用野生型植株花粉授粉,后代中25% ~45%的植株是父本单倍体(细胞质来自母本),其余是二倍体或非整倍体。当野生型植株用GFP-tailswap植株花粉授粉,后代中既有母本单倍体,也有非整倍体,但单倍体和非整倍体频率低于野生型植株花粉授粉。单倍体植株无需加倍,能自交结实,获得少量二倍体种子(拟南芥50~2 500粒种子)。由于每种作物都有CENH3蛋白质,因此从理论上看,通过调控CENH3基因来诱导单倍体都有可能。实践表明,用这种方法可以快速获得大量单倍体[16]。
不同单倍体诱导方法的主要特点和广泛应用的作物如表1。
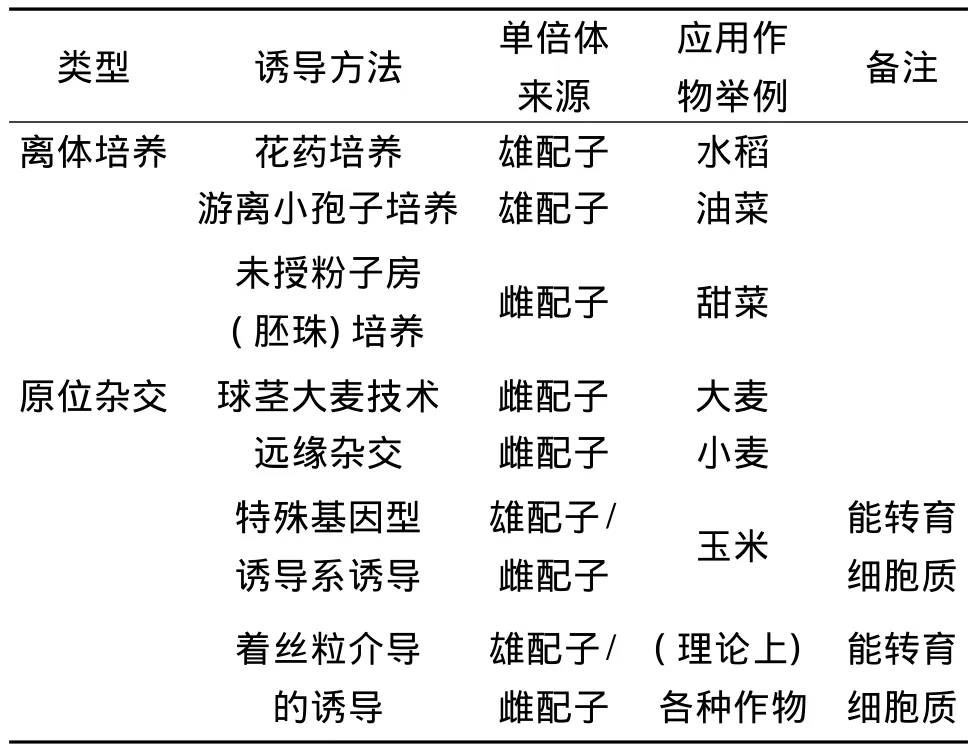
表1 不同单倍体诱导方法的主要特点和应用作物
2 反向育种
杂交育种期望在减数分裂时通过促进同源染色体的交叉、交换,实现基因重组,打破有利基因与不利基因之间的遗传重组,最终将有利基因聚集到一起。反向育种正好与此相反,期望完全阻止同源染色体的交叉、交换,使得同源染色体在减数分裂中期Ⅰ和后期Ⅰ如同单价体一样随机分离。如何阻止杂种F1减数分裂时同源染色体配对,Dirks等曾设想了多种途径,如通过RNA干扰或病毒诱导的基因沉默敲除减数分裂过程中某些关键基因的表达或施用基因表达的抑制剂[17]。Wijnker等通过RNA干扰敲除DMC1(交换形成必需的减数分裂特异重组酶)基因,获得的50株转基因植株,从正常可育到几乎不育的都有,不育植株在粗线期没有观察到染色体配对,只有单价体,染色体随机分离,很少形成有活力的平衡配子和种子[18]。由于单价染色体随机分离,形成有活力的平衡配子的比例取决于作物的单倍体染色体数目(x),平衡配子的比例为1/2x,说明作物单倍体染色体数目越多,有活力的配子比率越低。另一个方面是配子的数目,如果减数分裂形成的配子数目多,即使有活力的配子比率低,也能获得足够有活力的平衡配子。理论分析认为如果作物单倍体染色体数目超过12,难以获得足够的平衡配子。关于平衡配子的利用,在反向育种中是通过诱导形成单倍体实现的。Wijnker等将DMC1基因RNA干扰转基因植株与野生型植株杂交获得F1,然后用F1植株的花粉给GFP-tailswap植株授粉,诱导单倍体,这种单倍体中少数具有亲本同样的染色体组成,多数有1或几条染色体被替换,由单倍体植株收获自交种子,下一代就是可育的二倍体。具有5对染色体的拟南芥染色体随机分离最多能形成32(25)种基因型,从65个诱导的单倍体中观察到其中21种基因型,并包括了亲本类型。这21种基因型中,有6对是互补的,这些互补的双单倍体系遗传组成不同,也不同于原亲本,但杂交后可重建原亲本配制的杂种[18]。因为双单倍体系可自交繁殖,用互补的双单倍体系杂交可重建原亲本配制的杂种,因而能固定杂种基因型,从而固定杂种优势。一种作物通过反向育种能培育的双单倍体(DH)系数目最多为2x个,2个DH系能形成互补的一对亲本的概率为1/2x[2x/(2x)2],不能互补的概率为(2x-1)/2x,如有n个DH系,假设正反交表型一样,它们所能配制的组合数目为n(n-1)/2,这n个DH系中至少某2个 DH系能形成互补的概率为[(2x-1)/2x]n(n-1)/2。对于一个单倍体染色体数目为x的作物而言,要想通过反向育种找到1对互补DH系重建原始杂种,至少需要诱导的染色体非重组的DH系数目(n)见表2。
通过反向育种进行杂种重建包括以下步骤(图2):(1)通过转基因(如DMC1基因RNAi干扰)选育染色体不交叉、半不育的亲本;(2)用野生型亲本给半不育亲本授粉,从半不育亲本上收获杂种F1种子;(3)用杂种F1植株的花粉给GFP-tailswap植株授粉,诱导单倍体形成,从GFP-tailswap植株上收获种子;(4)种植从GFP-tailswap植株上收获的种子,选留单倍体植株,单倍体植株自交后收获自交种子,成为DH系;(5)选择互补的染色体被替换的DH系进行杂交重建原始杂种,固定杂种优势。
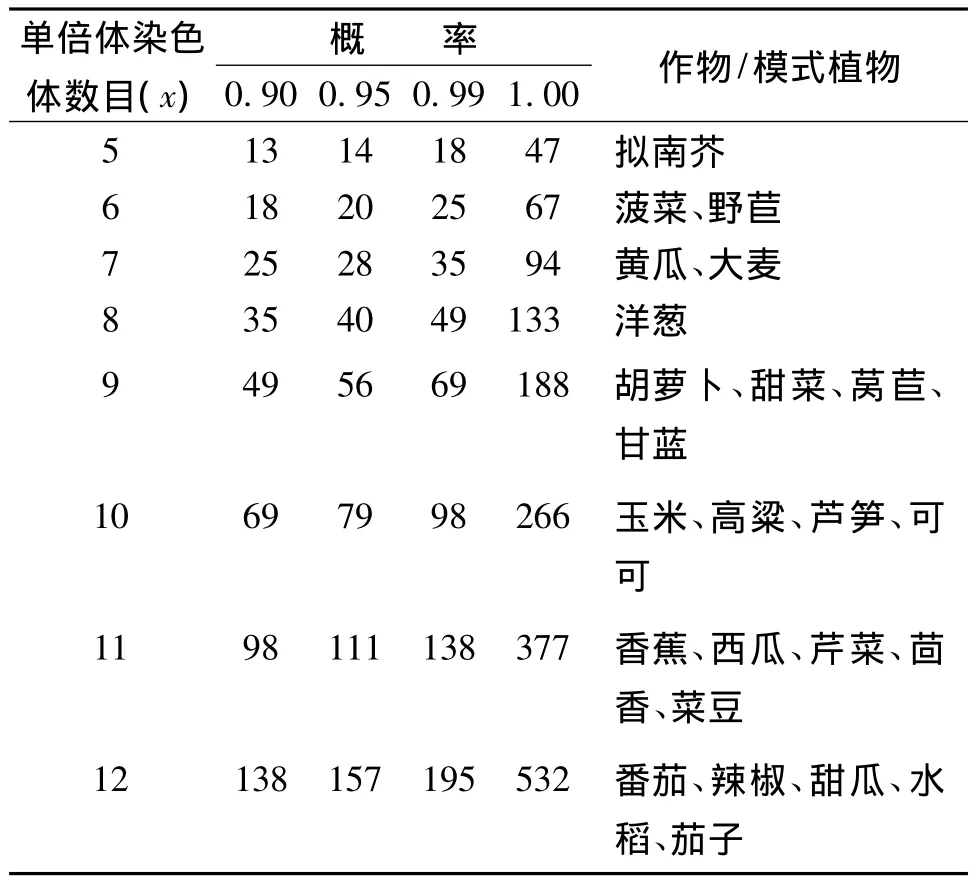
表2 不同作物不同概率下重建原始杂种需要培育的染色体非重组的DH系数目(n)[17]
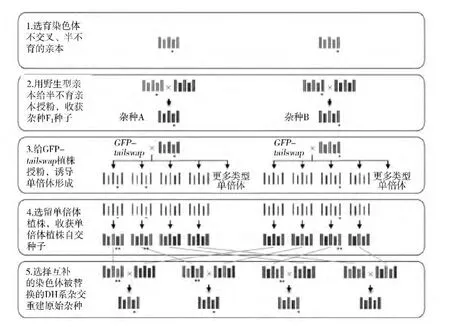
图2 通过反向育种进行杂种重建的程序[19]
反向育种在固定杂种优势这一点上类似于无融合生殖,但优于无融合生殖。因为反向育种不仅能固定杂种基因型,而且能通过对亲本的改良而改良杂种,而无融合生殖不能改良杂种。
3 无性种子繁殖
无融合生殖能固定杂种优势,但在主要作物中没有一种作物能进行无融合生殖。育种上期望将作物近缘植物的无融合生殖基因转移到作物中,但是至今也未能取得成功[20]。无融合生殖是二倍体体细胞(如大孢子母细胞)不经减数分裂直接发育为种子,能否模拟这一过程阻断减数分裂?减数分裂有三个特点:(1)DNA只复制1次,但进行2次细胞分裂;(2)同源染色体配对,形成交叉,发生交换重组;(3)在第一次分裂时姊妹染色单体共分离。控制同源染色体配对的基因SPO11、调控染色单体分离的基因REC8和控制进入第二次分裂的基因OSD1的三重突变体MiMe减数分裂的第一次分裂类似于有丝分裂,且不经历第二次分裂,因而形成不减数的雌、雄配子(2n配子),自交产生四倍体,与野生型回交产生三倍体,说明所产生的配子是有功能的[21]。进一步的遗传标记分析表明这种配子保持了母体植株的基因型,说明减数分裂已被有丝分裂所取代。
无融合生殖不仅没有减数分裂,而且还需要卵细胞不依赖受精能发育为胚(孤雌生殖)和形成胚乳。MiMe三重突变体能形成有活力的配子,自交也能结实,但后代染色体不断加倍,形成多倍体(四倍体、八倍体),降低育性[21]。为了解决这一问题,将GFP-CENH3和GFP-tailswap导入到cenh3-1突变体,培育出共表达CENH3不同变型、能消除染色体组的GEM系,用GEM系给MiMe三重突变体授粉,能结种子(拟南芥平均每角果结14粒种子),由于父本染色体消除,后代中34%为母本来源的二倍体;也可用MiMe的花粉给GEM系授粉,由于母本染色体的消除,后代中42%为父本来源的二倍体[22],从而实现通过种子进行无性繁殖的目的。
[1]Wijnker E,de Jong H.Managing meiotic recombination in plant breeding [J].Trends Plant Sci,2008,13:640 -646.
[2]Luo Q,Li Y,Shen Y,et al.Ten years of gene discovery for meiotic event control in rice [J].J Genet Genomics,2014,41:125 -137.
[3]Wijnker E,Schnittger A.Control of the meiotic cell division program in plants[J].Plant Reprod,2013,26:143-158.
[4]Henderson IR.Control of meiotic recombination frequency in plant genomes[J].Curr Opin Plant Biol,2012,15:556-561.
[5]Forster BP,Thomas WTB.Doubled haploids in genetics and plant breeding[J].Plant Breed Rev,2005,25:57 -88.
[6]Dunwell JM.Haploids in flowering plants:origins and exploitation[J].Plant Biotech J,2010,8:1 -48.
[7]Chen J,Cui L,Malik AA.In vitro haploid and dihaploid production via unfertilized ovule culture[J].Plant Cell Tiss Organ Cult,2011,104:311 -319.
[8]Houben A,Sanei M,Pickering R.Barley doubled - haploid production by uniparental chromosome elimination[J].Plant Cell Tiss Organ Cult,2011,104:321 - 327.
[9]Chaudhary HK,Kaila V,Rather SA,et al.Distant hybridisation and doubled - haploidy breeding[C]//Pratap A,Kumar J.Alien Gene Transfer in Crop Plants,Vol.1:Innovations,methodsand risk assessment.New York:Springer Science+Business Media,2014.143 -164.
[10]Niu Z,Jiang A,Hammad WA,et al.Review of doubled haploid production in durum and common wheat through wheat maize hybridization[J].Plant Breed,2014,133:313-320.
[11]Weber DF.Today’s use of haploids in corn plant breeding[J].Adv Agron,2014,123:123 -144.
[12]Prasanna BM,Chaikam V,Mahuku G.Doubled Haploid Technology in Maize Breeding:Theory and Practice[M].Mexico DF:CIMMYT,2012.
[13]Zhao Xi,Xu X,Xie H,et al.Fertilization and uniparental chromosome elimination during crosses with maize haploid inducers[J].Plant Physiol,2013,163:721 -731.
[14]Sanei M,Pickering R,Kumke K.Loss of centromeric histone H3(CENH3)from centromeres precedes uniparental chromosome elimination in interspecific barley hybrids[J].PNAS,2011,108:498 -505.
[15]Ravi M,Chan SWL.Haploid plants produced by centromere - mediated genome elimination[J].Nature,2010,464:615-618.
[16]Seymour DK,Filiault DL,Henry IM,et al.Rapid creation of Arabidopsis doubled haploid lines for quantitative trait locus mapping[J].PNAS,2012,109:4227 -4232.
[17]Dirks R,van Dun K,de Snoo CB,et al.Reverse breeding:a novel breeding approach based on engineered meiosis[J].Plant Biotech J,2009,7:837 -845.
[18]Wijnker E,van Dun K,de Snoo CB,et al.Reverse breeding in Arabidopsis thaliana generates homozygous parental lines from a heterozygous plant[J].Nat Genet,2012,44:467 -470.
[19]Wijnker E,Deurhof L,van de Belt J,et al.Hybrid recreation by reverse breeding in Arabidopsis thaliana[J].Nat Protocols,2014,9:761 -772.
[20]Hand ML,Koltunow AMG.The genetic control of apomixis:asexual seed formation[J].Genetics,2014,197:441-450.
[21]d’Erfurth I,Jolivet S,Froger N,et al.Turning meiosis into mitosis[J].PLoS Biol,2009,7:e1000124.
[22]Marimuthu MPA,Jolivet S,Ravi M,et al.Synthetic clonal reproduction through seeds [J].Science,2011,331:876.
