六味地黄汤对慢性肾衰大鼠肾小管上皮细胞EMT的影响*
2014-12-01周忠志何泽云徐文峰
陈 丽,张 熙,周忠志,何泽云△,唐 群,徐文峰
(1.湖南中医药大学病理教研室,长沙 410208;2.湖南中医药大学第一附属医院,长沙 410007)
慢性肾功能衰竭(chronic renal failure,CRF)是目前不容忽视的重大疾病之一[1]。肾间质纤维化(renal interstitial fibrosis,RIF)是多种慢性肾脏病向终末期肾病进展的重要过程,是CRF的主要病理 改 变[2]。 上 皮-间 充 质 转 分 化 (epithelialmesenchymal transition,EMT)是指上皮细胞分化为间充质细胞[3]。目前研究证实,肾小管上皮细胞EMT是RIF形成的关键环节[4],肾小管上皮细胞可通过 EMT转分化为肌成纤维细胞(myofibroblast,MF),MF可分泌大量的胶原,导致肾脏结构重塑,同时MF也分泌TIMP,使ECM增加而降解减少,促进肾脏纤维化[5]。六味地黄汤是目前临床运用治疗慢性肾脏病的有效方剂[6],六味地黄汤减轻RIF也有广泛的实验研究,我们前期对六味地黄汤和CRF致RIF做了大量的研究[7~10],但以往未从 EMT角度对六味地黄汤减缓RIF机理进行深层次研究。
本研究以5/6肾切除CRF大鼠模型为平台,用免疫组化、Western Blot、RT-PCR技术检测肾小管上皮细胞标志物E-cadherin、肌成纤维细胞标志物α-SMA、FSP-1的表达水平,观察大鼠5/6肾切除致CRF肾间质纤维化中的EMT现象,探讨肾RIF的发生机理和六味地黄汤的干预机理,为六味地黄汤的临床疗效提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性SD大鼠60只,体质量180±20 g,由湖南中医药大学实验动物中心提供。
1.1.2 药物 六味地黄汤(熟地黄24 g(河南)、山茱萸12 g(湖南)、山药12 g(河南)、牡丹皮9 g(安徽)、泽泻9 g(湖南)、茯苓9 g(湖南))中的中药材均一次性购自湖南中医药大学第一附属医院药剂科。先将药材用相当于药材5倍的自来水浸泡2 h煮沸后再微火煎熬30 min,过滤后收集煎液,原药渣加少量水煎煮,取二煎液。将两煎液混合,于水浴恒温器上浓缩至含生药1 g/ml,高压灭菌、分装,4℃保存备用。
1.1.3 主要试剂 兔抗大鼠E-cadherin(120kDa)试剂盒、兔抗大鼠 α-SMA(42kDa)试剂盒、兔抗大鼠 FSP-1(64kDa)试剂盒:Bloassay Technology Laboratory;十二烷基硫酸钠(SDS)、过硫酸胺(AP):北京鼎国昌盛生物技术有限责任公司;琼脂糖、甲双丙烯酰胺 (Bic)、二硫苏糖醇 (DTT)、TEMED(1568A14)、Phosphatase Inhibitor Cocktail 2:Sigma-Alorich;Trizol:美国MRC公司;RT试剂盒、Taq DNA聚合酶、dNTPs:美国Fermentas公司;逆转录试剂盒和GoTaq Green Master Mix:Promega公司;100 bp DNA Ladder:北京鼎国生物技术发展中心。

RT-PCR引物列表
1.1.4 主要仪器 Motic BA410T生物显微镜、Moticam Pro 285A CCD IMAGING SUOLUTION、Motic Medical 6.0数码显微图像分析系统软件:德国;MultiphorII Nova Blot:pharmacia Biotech;PROTEAN II Xi Cell:BIO-RAD;721B型分光光度计:上海第三分析仪器厂;鼎国py-120水平脱色摇床,北京鼎国生物技术有限责任公司;UMAX扫描仪:台湾;PCR仪(2400型):美国PERKIN ELMER公司;紫外分光核酸蛋白蛋白分析仪:美国Beckman公司;电泳凝胶图像分析仪:上海Tanon公司;电泳转膜仪(TE 52X-230V):美国Hoefer公司。
1.2 方法
1.2.1 造模与分组 (1)造模:按照文献[11]报道方法造模。(2)分组:SD大鼠适应性喂养1周后,随机分为正常组、假手术组、手术组,手术组术前禁食,均在无菌条件下进行5/6肾切除术,六味组给予以六味地黄汤灌胃(生药含量按公式:人的剂量×0.018×5/kg体质量计算),每天1次,至处死为止;模型组、假手术组和正常组以等容积蒸馏水灌胃,各组每天灌胃1次,给药8周后所有动物一次性处死。(3)免疫组化步骤:4 μm石蜡切片,切片后经过如下程序处理:①常规处理石蜡切片;②滴加适量试剂A:内源性过氧化酶封闭液(约50 ul),37℃孵育20 min、PBS洗5 min×3次;③滴加适量试剂B:封闭用正常山羊血清工作液(约50 ul),37℃孵育20 min、甩干;④滴加适量一抗工作液(约50 ul)稀释度分别是 E-cadherin(1∶200)、α-SMA(1∶300)、FSP-1(1∶700),切片置于免疫组化保湿盒37℃ 2 h、PBS洗5 min×3次;⑤滴加适量试剂C:生物素标记二抗工作液(约50 ul),37℃孵育15 min、PBS洗5 min×3次;⑥滴加适量试剂D:HRP标记链霉亲和素(约50 ul),37℃孵育15 min、PBS洗5 min×3次;⑦DAB显色(室温,镜下控制反应时间);⑧终止显色:用蒸馏水终止显色反应;⑨苏木素轻度复染、脱水透明、封片。(4)Western Blot步骤:实验前先配好裂解液、G-250考马斯亮蓝溶液、12%分离胶和5%浓缩胶、上样缓冲液、电泳液缓冲液、转膜缓冲液、TBS缓冲液、TBST缓冲液、封闭液。①总蛋白的样品制备;②蛋白含量的测定:制作标准曲线、检测样品蛋白含量;③SDS-PAGE电泳:清洗玻璃板、灌胶与上样、电泳;④转膜;⑤免疫反应;⑥化学发光、显影、定影;⑦凝胶图像分析。(5)RTPCR步骤:①约100 mg重的肾脏置于研钵中,并加入少量液氮及0.1 mlTrizol,仔细研磨、混匀;迅速移入1.5 mlEP离心管(先已加入0.9 mlTrizol),在漩涡混合器上剧烈震荡30 s,完全混匀,冰上静置5 min;②加入200 μl氯仿混匀,室温使之分层。13000 rpm离心5 min;小心将上层水相转移到无菌RNase-free的1.5 ml eppendorf管中;③加入一半体积的RNA沉淀试剂和异丙醇混匀,室温放置5 min,13000 rpm离心5 min;④小心去除上清,加入1 ml 75%乙醇洗涤沉淀,13000 rpm离心5 min;⑤小心去除上清,离心数秒吸去残余液体,60℃烤箱内放置5 min去除乙醇;⑥适当体积RNase-free H2O溶解,60℃烤箱内放置5 min使其溶解充分;⑦电泳观察抽提效果和估计含量;⑧约1 ug的总RNA进行逆转录;⑨PCR反应,总体系15 ul,94℃变性5 min,循环采用94℃变性0.5 min,56℃退火 0.5 min,72 ℃ 延伸0.5 min,35 个循环后,72 ℃延伸10 min,4℃存放;⑩电泳分析:凝胶成像系统中观察并拍照。
1.3 统计学方法
2 结果
2.1 免疫组化染色结果与分析
表1显示,E-cadherin的表达:正常组肾小球肾间质均无表达,肾近曲小管胞浆管腔面、肾远曲小管浆、核内均有大量棕黄色物质沉积,着色深且着色面积大,表达量明显(图1),假手术组与正常组比较,表达量无显著差别(图2),面密度值及平均灰度值差异无统计学意义(P>0.05);模型组与假手术组比较,肾小球内无表达、部分被膜纤维、肾近曲小管细胞胞浆、肾远曲小管胞浆、核内少量表达,肾间质内可见棕黄色物质沉积,着色深且着色面积大,表达量显著增多(图3),面密度值降低,平均灰度值增加,2组比较差异均有统计学意义(P<0.01);六味组与模型组比较,肾近曲小管、肾远曲小管胞浆有棕黄色物质增多,着色加深且着色面积增大,表达量显著增多(图4),面密度值增大,平均灰度值减少,差异均有统计学意义(P<0.01)。
表2显示,α-SMA的表达:正常组肾小球、肾小管均无α-SMA蛋白表达(图5);假手术组与正常组比较,α-SMA蛋白的表达量无显著差别(图6),面密度值及平均灰度值差异无统计学意义(P>0.05);模型组与假手术组比较,被膜纤维、肾小球、肾小管上皮细胞胞浆、肾间质内均有大量棕黄色物质沉积,着色深且着色面积大,α-SMA蛋白的表达量显著增多(图7),面密度值增加,平均灰度值降低,2组比较差异有统计学意义(P<0.01);六味组与模型组比较,被膜纤维、肾小球、肾小管上皮细胞胞浆、肾间质内棕黄色物质减少,着色变浅且着色面积变小,α-SMA蛋白的表达量减少(图8),面密度值减少,平均灰度值增大,差异均有统计学意义(P<0.01)。

注:以上图片均为免疫组化染色,放大倍数为10 ×40。图1、5、9 为正常组,图2、6、10 为假手术组,图3、7、11 为模型组,图4、8、12 为六味组
表1 E-cadherin面密度值及平均灰度值定量分析(±s)

表1 E-cadherin面密度值及平均灰度值定量分析(±s)
注:与正常组比较:▲P<0.01;与假手术组比较:●P<0.01;与模型组比较:★P<0.01
组 别 例数 面密度值(‰)平均灰度值正 常 组10 118.62±35.03 100.70±11.36假手术组 10 114.06±34.26 103.73±12.64模 型 组 14 16.74± 3.87▲● 157.70±11.65▲●六 味 组 17 69.28±23.89▲●★ 120.04±11.71▲●★
表2 α-SMA面密度值及平均灰度值定量分析(±s)

表2 α-SMA面密度值及平均灰度值定量分析(±s)
注:与正常组比较:▲P<0.01;与假手术组比较:●P<0.01;与模型组比较:★P<0.01
组 别 例数 面密度值(‰)平均灰度值正 常 组10 0.65±0.03 152.20±25.41假手术组 10 1.54±0.05 151.60±28.34模 型 组 14 39.64±1.21▲● 80.60±20.57▲●六 味 组 17 6.05±0.19▲●★ 129.80±21.13▲●★
表3显示,FSP-1的表达:正常组肾小球、肾小管均无FSP-1蛋白表达(图9);假手术组与正常组比较,FSP-1蛋白的表达量无显著差别(图10),面密度值及平均灰度值差异无统计学意义(P>0.05);模型组与假手术组比较,被膜纤维、肾小球、肾小管上皮细胞胞浆、肾间质内均有大量棕黄色物质沉积,着色深且着色面积大,FSP-1蛋白的表达量显著增多(图11),面密度值增加,平均灰度值降低,2组比较差异有统计学意义(P<0.01);六味组与模型组比较,肾小球、肾小管上皮细胞胞浆、肾间质内棕黄色物质减少,着色变浅且着色面积变小,FSP-1蛋白的表达量减少(图12),面密度值减少,平均灰度值增大,差异均有统计学意义(P<0.01)。
表3 FSP-1面密度值及平均灰度值的定量分析(±s)

表3 FSP-1面密度值及平均灰度值的定量分析(±s)
注:与正常组比较:▲P<0.01;与假手术组比较:●P<0.01;与模型组比较:★P<0.01
组 别 例数 面密度值(‰)平均灰度值正 常 组10 2.69±0.33 171.30±21.91假手术组 10 3.58±0.48 168.56±22.21模 型 组 14 88.93±3.14▲● 91.90±10.77▲●六 味 组 17 26.69±1.57▲●★ 143.42±22.18▲●★
2.2 Western Blot免疫印迹结果与分析
2.2.1 E-cadherin免疫印迹结果与分析 本实验结果显示,正常组表达水平高,假手术组与正常组比较,E-cadherin蛋白的表达量差异无统计学意义(P>0.05);模型组与假手术组比较,表达量明显降低,差异有统计学意义(P<0.01);六味组与模型组比较表达量增高,差异有统计学意义(P<0.01)(见图 13)。以 β-actin蛋白作为内参,计算 E-cadherin/β-actin比值并进行统计分析(表4)。
2.2.2 α-SMA免疫印迹结果与分析 图14表4显示,正常组表达水平低,假手术组与正常组比较,α-SMA蛋白的表达量无显著差别,差异无统计学意义(P>0.05);模型组与假手术组比较表达量明显增高,差异有统计学意义(P<0.01);六味组与模型组比较表达量降低,差异有统计学意义(P<0.01)。以 β-actin蛋白作为内参,计算 α-SMA/βactin比值并进行统计分析。
2.2.3 FSP-1免疫印迹结果与分析 图15表4显示,正常组表达水平低,假手术组与正常组比较,FSP-1蛋白表达量无显著差别,差异无统计学意义(P>0.05);模型组与假手术组比较,表达量明显增高,差异有统计学意义(P<0.01);六味组与模型组比较表达量降低,差异有统计学意义(P<0.01)。以 β-actin蛋白作为内参,计算 FSP-1/βactin比值并进行统计分析。
表4 E-cadherin、α-SMA、FSP-1 蛋白表达水平比较(±s)

表4 E-cadherin、α-SMA、FSP-1 蛋白表达水平比较(±s)
注:与假手术组比较:▲P<0.01;与模型组比较:●P<0.01
组别-actin正 常 组 10 5.8703±0.0014 0.1080±0.0021 2.0235±0.00例数 E-cadherin/β-actin α-SMA/β-actin FSP-1/β 34假 手 术 组 10 5.8821±0.0115 0.1381±0.0044 2.0140±0.0028模 型 组 14 0.8274±0.0026▲ 11.8257±0.0052● 7.1556±0.0043▲六 味 组 17 4.2986±0.0033▲● 4.9631±0.0037●★ 4.5765±0.0052▲●
2.3 RT-PCR结果与分析
2.3.1 E-cadherin结果与分析 图16、表5显示,正常组表达水平高,假手术组与正常组比较,E-cadhenrin的mRNA表达量差异无统计学意义(P>0.05);模型组与假手术组比较,表达量明显降低,差异有统计学意义(P<0.01);六味组与模型组比较表达量增高,差异有统计学意义(P<0.01)。以β-actin蛋白作为内参,计算E-cadherin/β-actin比值并进行统计分析。
表5 E-cadherin、α-SMA、FSP-1 mRNA 表达水平比较(±s)

表5 E-cadherin、α-SMA、FSP-1 mRNA 表达水平比较(±s)
注:与假手术组比较:▲P<0.01;与模型组比较:●P<0.01
组别-actin正 常 组 10 1.5024±0.0052 0.3191±0.0018 0.5402±0.00例数 E-cadherin/β-actin a-SMA/β-actin FSP-1/β 33假 手 术 组 10 1.4967±0.0029 0.3187±0.0044 0.5396±0.0019模 型 组 14 0.5346±0.0037▲ 0.8710±0.0026▲ 1.4261±0.0053▲六 味 组 17 0.6787±0.0046▲● 0.7142±0.0035▲● 1.1504±0.0061▲●
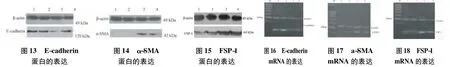
注:1.正常组;2.假手术组;3.模型组;4.六味组(图14~18同)
2.3.2 α-SMA结果与分析 图17表5显示,正常组表达水平低,假手术组与正常组比较,α-SMA的mRNA表达量差异无统计学意义(P>0.05);模型组与假手术组比较表达量明显增高,差异有统计学意义(P<0.01);六味组与模型组比较表达量降低,差异有统计学意义(P<0.01)。以β-actin蛋白作为内参,计算a-SMA/β-actin比值并进行统计分析。
2.3.3 FSP-1结果与分析 图18、表5显示,正常组表达水平低,假手术组与正常组比较,FSP-1的mRNA表达量差异无统计学意义(P>0.05);模型组与假手术组比较表达量明显增高,差异有统计学意义(P<0.01);六味组与模型组比较表达量降低,差异有统计学意义(P<0.01)。以β-actin蛋白作为内参,计算 FSP-1/β-actin比值并进行统计分析。
3 讨论
目前认为肾间质纤维化的发展过程主要分为4个阶段,第一阶段是细胞的活化和损伤,第二阶段是纤维化相关因子的释放,第三阶段是纤维化的形成,第四阶段是肾脏结构和功能的损伤。
肾小管EMT是肾间质纤维化发展过程的第一阶段,是肾脏纤维化形成的关键环节[3,4]。EMT 的可能机制如下:①某些间充质细胞决定基因的激活:在病理条件下,某些间充质细胞决定基因如FSP-1基因的激活,而上皮细胞基因如E-钙黏素(E-cadherin)基因、细胞角化蛋白(Cytokerin)基因关闭,不表达上皮细胞标志物,转而表达间充质细胞标志物,发生上皮细胞转分化;②某些细胞因子及代谢产物参与上皮细胞转分化的发生,并可能是上皮细胞转分化发生的重要机制;③基质胶原成分影响上皮细胞转分化的发生[12]。Yang等将 EMT高度概括为4个主要步骤:一是失去上皮细胞黏附特性;二是a-SMA重新表达和肌动蛋白重组;三是基底膜破坏;四是细胞迁移和侵袭。1995年STRUTZ等发现,肾小管上皮细胞可表达成纤维细胞特异蛋白1(fibroblast-specific protein-1,FSP-1),而这种蛋白通常只在成纤维细胞中表达,正常上皮细胞不表达,于是他们提出了EMT假说。随后在体外实验中后观察到这种现象。Zhaoyu Lu等利用大鼠5/6肾切除后12周血清能使HK-2细胞转分化成肌成纤维细胞[13]。在肾病患者肾活检的标本中亦观察到EMT现象[14]。在病理状态下,肾小管上皮细胞具有向间充质细胞转化的能力[15],可通过EMT转分化为肌成纤维细胞(myofibroblast,MF),MF既保留了成纤维细胞分泌胶原的能力,又与平滑肌细胞一样能表达 a-平滑肌肌动蛋白(a-smooth muscle actin,a-SMA)[16]。病理情况下,MF 分泌的胶原量是成纤维细胞的4、5倍,具有强大的收缩能力,导致肾脏结构重塑,促进肾纤维化。
以上研究表明,EMT是RIF的起始环节,为证实在动物体内RIF的第一阶段存在EMT现象,我们以5/6肾切除慢性衰竭大鼠模型为平台,分别用免疫组化、Western Blot、RT-PCR技术检测肾小管上皮细胞标志物 E-cadherin、肌成纤维细胞标志物 α-SMA、FSP-1的表达水平,观察大鼠5/6肾切除致慢性肾衰竭RIF中的EMT现象,本研究结果:与正常组、假手术组比,模型组在蛋白水平和mRNA水平,E-cadherin表达量明显下调,α-SMA、FSP-1表达量均明显上调,以上组间的差异均具有显著统计学意义(P<0.01),3种方法检测结果一致,表明在5/6肾切除慢性衰竭大鼠RIF纤维化过程出现EMT现象,我们的实验结果与相关文献一致[17]。
六味地黄汤主治肾阴虚证,本方功效为滋阴补肾。熟地黄滋阴补肾,填精益髓、壮水之主,为君药;山萸肉温补肝肾,并能涩精;山药补脾阴,兼能固精缩尿,两者共为臣药。三药相配伍,滋养肝脾肾,用以治本。其中,肝肾同源,养肝阴即能补肾阴;脾主运化,滋脾阴即能益肾阴,故山萸肉、山药共助熟地黄滋补肾阴。但此三药补而滞腻,并因阴虚常能致虚火上炎,故用泽泻泻肾火、利湿泄浊,以防熟地黄之腻;丹皮泻肝火,以除山萸肉温敛肝阴之滞;茯苓能淡渗利湿,以除山药滋脾之壅。六药合用,三补三泻,补而不滞,泻而不伤,以补为主,以泻为辅,形成甘淡平和、不温不燥的平补之剂。六味地黄汤是目前临床运用广泛的治疗慢性肾脏病的方剂。现代常用本方治疗慢性肾炎、高血压、糖尿病等病具有肝肾阴虚证候者。如在慢性肾炎、慢性肾功能衰竭、糖尿病肾病、狼疮性肾炎、高血压患者肾功能保护等疾病治疗方面都取得了一定的疗效。
我们长期对慢性肾衰肾间质纤维化机制及六味地黄汤的作用机理做了大量的研究。既往研究表明,六味地黄汤可减轻和抑制肾间质纤维化[7~10],但未从EMT角度对六味地黄汤治疗机理进行研究。本实验从EMT角度,深入阐明六味地黄汤对慢性肾衰竭肾间质纤维化的作用机制,分别采用免疫组化、Western Blot、RT-PCR技术,检测大鼠5/6肾切除经六味地黄汤治疗8周后,E-cadherin、α-SMA、FSP-1表达水平的变化。结果显示,与模型组比较,在蛋白水平和mRNA水平,六味组中E-cadherin表达量均明显上调,α-SMA和FSP-1表达量均明显下调,3种方法检测具有一致性,以上组间的差异均具有显著统计学意义(P<0.01),此结果表明5/6肾切除,经六味地黄汤治疗8周后,大鼠留存肾中EMT现象减轻,六味地黄汤可抑制EMT现象。
以上研究证实大鼠5/6肾切除致CRF模型留存肾中存在EMT现象,六味地黄汤可抑制EMT。
[1]chroijen MA,Dekkers OM,Grootendorst DC,et al.Effects of comorbid and demographic factors on dialysis modality choice and related patient survival in Europe[J].Nephrol Dial Transplant,2011,Sep,26(9):2940-2947.
[2]Bielesz B,Sirin Y,Si H,et al.Epithelial Notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans[J].J Clin Invest,2010,120(11):4040-4054.
[3]张凤霞,万建新,许艳芳.肾脏纤维化中间充质转分化的新观点[J].临床肾脏病杂志,2011,11(4):187-189.
[4]Winbanks CE,Darby IA,Kelynack KJ,et al.Explanting is an ex vivo model of renal epithelial-mesenchymal transition[J]Biomed Biotechnol,2011,212819.
[5]俊霞,吴人亮.肾小管上皮细胞转分化与肾小管间质纤维化[J].中国现代医学杂志,2008,18(11):1561-1564.
[6]程吉东.六味地黄丸对老年性高血压患者肾保护作用的随访调查[J].山东中医杂志,2007,26(2):87-89.
[7]何泽云,徐元美.六味地黄丸治疗肾阴虚型慢性肾小球肾炎的临床研究[J].湖南中医学院学报,2004,24(1):35-37.
[8]彭亚军,何泽云.六味地黄丸方治疗肾脏病研究进展[J].中国中医急症,2009,18(7):1151-1152.
[10]李万斌,何泽云.六味地黄丸延缓5/6肾切除大鼠肾组织纤维化研究[J].中国药师,2009,12(4):411-413.
[11]SM Shea,J Raskova and A.B.Morrison.A stereologic study ofglomerular hypertrophy in the subtotally nephrectmized rat[J].Am J pathol,1978,90:201-211.
[12]Hertig A,Flier S,Kalluri R.Contribution of epithelial plasticity to renal transplantation-associated fibrosis[J].Transplant Proc,2010,42(2):7-12.
[13]Maria P Rastaldi, Franco Ferrario, Laura Giardino, et al.Epithelial-mesenchymal transition of tubular epithelial cells in human renal biopsies[J].Kidney Int,2002,62(1):137-146.
[14]Einecke G,Reeve J,Sis B,et al.A molecular classifier for predicting future graft loss in late kidney transplant biopsies[J].Clin Invest,2010,120:1862-1872.
[15]Wilhelm Kriz,Brigitte Kaissling and Michel Le Hir.Epithelial-Mesenchymal transition(EMT)in kidney fibrosis:fact or fantasy[J].The Journal of Clin Invest,2011,121(2):468-474.
[16]Catherine E.Winbanks,Ian A.Darby,Kristen J.Kelynack,et al.Explanting Is an Ex Vivo Model of Renal Epithelial-Mesenchymal Transition. Journal of Biomedicine and Biotechnology,2011,ID 212819,7 pages doi:10.1155/2011/212819.
[17]Huang B,Pi L,Chen C,Yuan F,et al.WT1 and Pax2 Re-Expression Is Required for Epithelial-Mesenchymal Transition in 5/6 Nephrectomized Rats and Cultured Kidney Tubular Epithelial Cells[J].Cells Tissues Organs,2012,195(4):296-312.
