多孔钛支架表面沉积牛血清白蛋白/钙磷生物活性涂层的构建*
2014-11-23朱晓晶宁成云
朱晓晶 于 鹏 宁成云 王 焱
钛及钛合金具有良好机械性能、抗腐蚀性及生物型容性,目前广泛应用于骨组织工程及口腔种植修复领域。但钛弹性模量与体骨的弹性模量不匹配,在植入人体后具有应力屏蔽的作用,容易造成植入失败。构建具有多孔结构的钛支架能够有效的降低钛植入体的弹性模量,达到消除应力屏蔽的作用[1]。受益于快速成型技术(RapidPrototyping,RP)的发展,利用选择性激光熔覆(selective laser melting,SLM)成型技术可加工出多种具有结构、尺寸可控的的多孔钛支架,研究表明,在减轻应力屏蔽的同时,多孔支架的连通孔结构能够促进骨组织的长入[2,3]。在前期工作中已对选择性激光熔覆加工的多孔支架的力学性能和加工工艺进行探讨和分析,成功制备出孔径结构可控,连通性好的多孔支架[2,4]。但是由于钛本身为生物惰性材料,需对钛进行表面改性处理提高其生物活性[5]。钙磷涂层与骨的成分相近,并已被证明具有良好的生物活性[6,7],在骨组织缺损修复中具有重要的作用,因此在多孔支架表面构建仿生钙磷涂层具有重要的实用价值[8]。而在人体内骨组织的形成是在蛋白调控作用下无机矿物的沉积过程,同时蛋白质也是骨组织的重要组成部分[9]。因此本实验拟通过仿生法在多孔支架表面构建含牛血清白蛋白(albumin bovine serum,BSA)的钙磷涂层,更好的模拟人体骨的矿化,同时研究牛血清白蛋白的加入对涂层形貌、化学成分的影响,为后续多孔支架生物学性能试验奠定基础。
1.材料和方法
1.1 多孔支架制备 使用Magics 11(Materialise,比利时)软件设计具有连通孔的圆柱形多孔支架,支架的樑宽厚度设计为0.3mm,支架单元由八面体结构组成。利用Dimetal-280选择性激光熔覆设备(SLM,华南理工大学)在氩气气氛下利用激光烧结金属钛粉末加工上述多孔支架。支架为圆柱形,直径8mm,高度为8mm。工艺条件如下:铺粉层厚60μm,激光扫描线间距为80μm,扫描速度和激光功率分别设定为700mm/s和150W。利用上述设计的工艺条件加工块体钛样品,样品加工完毕后通过线切割将样品从基台表面切割。将上述样品依次在丙酮,无水乙醇、去离子水中超声清洗20min后,经体积比为1:1(v/v)HF和HNO3混合酸溶液酸洗,在5mol/L NaOH溶液中80℃碱处理48h。去离子水浸泡、高温高压灭菌。
1.2 整合BSA仿生涂层制备 模拟体液(simulated body fluid,SBF)和饱和钙磷溶液(supersaturated calcium phosphate solution,SCP)的配制分别参照以往文献所述[10,11]的方法进行配制,所用试剂均为分析纯(上海国药集团化学试剂有限公司)。在饱和钙磷溶液中加入适量牛血清白蛋白(MP,美国),配制成含BSA浓度为10μg/mL、的牛血清白蛋白-饱和钙磷溶液,0.22μm滤器过滤除菌。
碱处理后的试件竖直浸入SBF溶液中,置于37℃恒温摇床。溶液每24h更换以保证离子浓度。4d后取出样品,去离子水冲洗,37℃干燥过夜。然后将上述试件随机分为2组,分别竖直浸入钙磷溶液(对照组)以及上述10μg/mL牛血清白蛋白-饱和钙磷溶液混合溶液中,于37℃恒温摇床缓慢震荡2d。无菌去离子水冲洗,室温下干燥,4℃密封保存备用。涂层制备过程在无菌环境下进行。
1.3 涂层性能表征 试件表面经180s喷金处理,采用扫描电镜(Zeiss EVO18,德国)在10kV电压下观察涂层表面形貌[能谱];使用傅里叶变换红外光谱分析仪(Vector 33,德国)分析涂层的官能团,将多孔支架表面涂层轻轻刮下1mg加入150mg干燥的KBr粉末中研磨混匀后压成块体,红外光谱的检测范围400-4000cm-1,分辨率4cm-1;X射线衍射分析仪(Bruker D8 ADVANCE,德国)检测与多孔支架相同工艺条件下制备的块体样品表面沉积的钙磷涂层物相组成,扫描范围范围3°-60°,扫描速度3s/步,步长0.05°。
2.结果
2.1 多孔钛支架及涂层电镜形貌 图1(a)(b)显示通过快速成型技术成功制备出多孔钛支架,俯视图显示为正方形的连通孔结构,从主视图中可以看出多孔支架是由八面体的结构单元组合而成的,(c)为碱处理后多孔支架表面的微观形貌,在材料的表面成功构建了一层均匀的纳米多孔膜层。
预矿化后的多孔支架样品浸入到SCP以及含BSA浓度为10μg/mL的SCP中矿化2d(图2),2组样品表面均有均匀的矿化层生成,同时矿化层的覆盖后的多孔支架表面更加平坦。在SCP中沉积的矿化层主要由片状晶体组成,片状晶片为微米级,晶体相互交错排列。而在含BSA浓度为10μg/mL的SCP中矿化的样品表面的晶体则发生卷曲,晶片尺寸变小,为纳米级结构。上述两种涂层的EDS成分分析结果如附表所示,上述两种涂层均主要由钙磷碳氧四种元素组成,蛋白加入后沉积获得钙磷涂层的钙磷比为1.44,高于饱和钙磷溶液中沉积涂层的钙磷比1.39。

图1 选择性激光烧结加工的多孔钛支架3D光学显微镜图

图2 预矿化的多孔支架在SCP及含有10μg/mL牛血清蛋白的SCP中沉积生成的钙磷涂层扫描电镜图
2.2 X射线衍射分析 如XRD图(图3)所示,在含有BSA和不含BSA溶液的SCP中沉积的钙磷涂层最显著的差异为钙磷涂层中的磷酸八钙相。在SCP中沉积的涂层在2θ等于4.7°、16.1°附近存在明显的磷酸八钙的特征峰,而在含BSA浓度为10μg/mL的SCP中则不存在磷酸八钙的晶相结构。XRD结果还表明,两种涂层都主要由羟基磷灰石晶相组成,其特征峰位于2θ等于26.1°、28.2°、32.2°、34.1°、49.7°等附近。通过对XRD峰强度的比较分析,还可以得出蛋白加入SCP后沉积的钙磷涂层的结晶度要明显低于不加入蛋白的SCP中沉积的涂层。
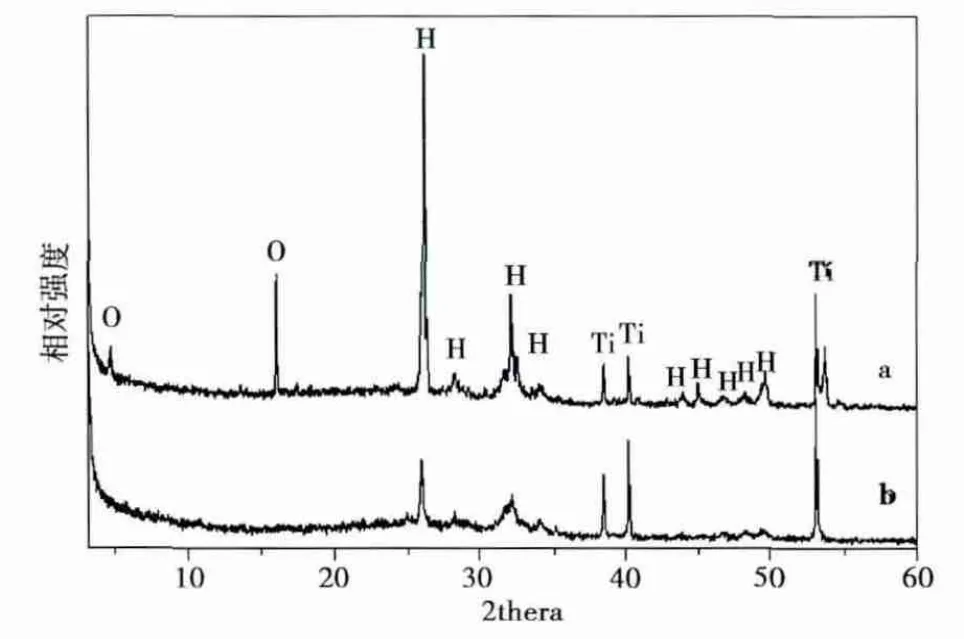
图3 多孔支架表面沉积钙磷涂层的XRD图谱
2.3 傅里叶变换红外光谱分析 傅里叶红外光谱(图4)中显示出多孔支架表面的钙磷涂层含有羟基磷灰石中磷酸根的特征峰,两组涂层在1025cm-1,963cm-1,604cm-1,560cm-1附近均出现的P-O特征峰。另外两者谱图中均在872,1422cm-1附近出现CO32-的特征峰,结合XRD图谱中羟基磷灰石峰的存在表明涂层中含有碳酸化的羟基磷灰石。此外,含BSA的SCP中沉积的涂层的红外图谱中还在911cm-1和1108cm-1处存在的特征峰P-OH,为磷酸八钙晶相的特征峰。另外,在含BSA的SCP中沉积的钙磷涂层中出现了BSA的特征峰酰胺Ⅰ带振动峰(1654cm-1)和酰胺Ⅱ带振动峰(1541cm-1)。

附表 SCP及含BSA浓度为10μg/m L的SCP中沉积的钙磷涂层的能谱成分分析

图4 多孔支架表面涂层FTIR图谱(a)SCP及(b)含BSA浓度为10μg/mL的SCP中沉积的钙磷涂层
3.讨论
选择性激光熔覆技术是利用粉末材料(金属或非金属)在激光照射下烧结的原理,在计算机控制下层层堆积成型。根据计算机辅助设计(computer aided design,CAD)生成的三维实体模型通过分层软件分层获得二维数据驱动控制激光束,有选择性地对铺好钛粉进行烧结,加工出要求形状的薄层,逐层累积形成实体模型。具有制作工艺简单、精度高的特点,现广泛应用于种植体、支架等的制造。本实验利用优化的工艺参数,通过选择性激光熔覆技术成功加工出尺寸可控的多孔支架,获得的多孔钛支架具有良好的连通孔结构,并且保持了设计的结构,具有良好的重复性。
Marco A等通过仿生沉积的方法成功地在多孔支架的表面沉积钙磷涂层[12]。研究表明钙磷涂层具有良好的生物相容性、骨传导性,是良好的无机涂层[13,14]。钙磷涂层的仿生法制备不受形状限制,可以在任意形状支架、种植体表面沉积钙磷涂层,而且该法是在低温下进行,为蛋白等生物活性分子的加入提供了可能。为了提高种植体表面生物活性,在种植体表面构建有机-无机复合涂层是目前骨组织缺损修复领域研究的热点,因此本实验在SCP中加入BSA,期望构建出BSA/钙磷复合涂层。利用酸碱处理技术活化多孔钛支架表面,形成一层利于磷灰石沉积的微纳米多孔膜层,在模拟体液中,钙磷可以快速在微纳米多孔膜层的表面沉积,获得预矿化膜层,为后续的钙磷溶液中的钙磷涂层的成长提供形核位点[15-17]。
结果证明,通过仿生法可成功将BSA整合到钙磷涂层的内部。扫描电镜结果显示,钙磷涂层在多孔支架表面实现了均匀沉积,且SCP中BSA的加入改变了钙磷涂层的形貌,涂层由无蛋白时的片状晶体结构转变为蜷曲的纳米级结构。羟基磷灰石晶体结构会影响成骨细胞黏附、增值、分化行为[18]。另外,从能谱元素钙磷比分析,XRD及FTIR结果可知,BSA在改变涂层形貌的同时也对涂层的晶相结构产生了影响,蛋白的整合减少了晶体中磷酸八钙相的含量,同时降低了晶体的结晶度。这一方面是由于在钙磷涂层的沉积过程中蛋白质吸附于矿化层的沉积界面改变了该处的界面能,从而不利于磷酸八钙相的沉积[19]。此外由于蛋白整合到了部分磷灰石晶体的晶格内部,改变了磷灰石晶体的结构,导致涂层的结晶度下降。羟基磷灰石结晶度降低,降解速度加快,钙磷离子析出,钙磷离子活性基团可以在种植体表面形成活性层面,利于蛋白吸附,促进成骨细胞在种植体表面的粘附[20]。
综上所述,本研究在利用快速成型技术制备的多孔钛支架的表面成功沉积了具有BSA整合的钙磷复合涂层,BSA的整合改变了钙磷涂层的形貌、化学成分。上述理化性能的改变对多孔支架表面膜层生物学能的影响尚待进一步研究。
[1]Van Bael S,Chai Y C,Truscello S,et al.The effect of pore geometry on the in vitro biological behavior of human periosteum-derived cells seeded on selective laser-melted Ti6Al4V bone scaffolds[J].Acta Biomaterialia,2012,8(7):2824-2834
[2]Sun J F,Yang Y Q,Wang D.Mechanical properties of a Ti6Al4V porous structure produced by selective laser melting[J].Materials&Design,2013,49:545-552
[3]Li J P,Habibovic P,Yuan H P,et al.Biological performance in goats of a porous titanium alloy-biphasic calcium phosphate composite[J].Biomaterials,2007,28(29):4209-4218
[4]Su X B,Yang Y Q,Yu P,et al.Development of porous medical implant scaffolds via laser additive manufacturing[J].Transactions Of Nonferrous Metals Society Of China,2012,221:S181-S187
[5]徐 娟,胡 敏.钛合金表面改性与骨结合能力的研究进展[J].中华老年口腔医学杂志,2013,11(2):119-122
[6]Peng F,Shaw M T,Olson J R,et al.Influence of surface treatment and biomimetic hydroxyapatite coating on the mechanical properties of hydroxyapatite/poly(L-lactic acid)fibers[J].Journal of Biomaterials Applications,2012,
[7]Ballo A M,Xia W,Palmquist A,et al.Bone tissue reactions to biomimetic ion-substituted apatite surfaces on titanium implants[J].Journal of The Royal Society Interface,2012,9(72):1615-1624
[8]Chai Y C,Kerckhofs G,Roberts S J,et al.Ectopic bone formation by 3D porous calcium phosphate-Ti6Al4V hybrids produced by perfusion electrodeposition[J].Biomaterials,2012,33(16):4044-4058
[9]Bleek K,Taubert A.New developments in polymer-controlled,bioinspired calcium phosphate mineralization from aqueoussolution[J].Acta Biomaterialia,2013,9(5):6283-6321
[10]Kokubo T.Apatite formation on surfaces of ceramics,metals and polymers in body environment[J].Acta Materialia,1998,46(7):2519-2527
[11]Liu Y,Layrolle P,de Bruijn J,et al.Biomimetic coprecipitation of calcium phosphate and bovine serum albumin on titanium alloy[J].Journal of biomedical materials research,2001,57(3):327-335
[12]Lopez-Heredia M A,Sohier J,Gaillard C,et al.Rapid prototyped porous titanium coated with calcium phosphate as a scaffold for bone tissue engineering[J].Biomaterials,2008,29(17):2608-2615
[13]Bae S E,Choi J,Joung Y K,et al.Controlled release of bone morphogenetic protein(BMP)-2 from nanocomplex incorporated on hydroxyapatite-formed titanium surface[J].Journal of Controlled Release,2012,
[14]Lee J A,Lee W.Calcium phosphate-mediated surface modification of titanium oxide and its effects on surface potential and fibrinogen adsorption[J].Journal of Industrial and Engineering Chemistry,2013,19(5):1448-1456
[15]Uchida M,Kim H M,Kokubo T,et al.Effect of water treatment on the apatite-forming ability of NaOH-treated titanium metal[J].Journal of Biomedical Materials Research,2002,63(5):522-530
[16]何福明,刘 丽,赵士芳,等.多孔纯钛种植体表面快速沉积钙磷涂层的研究[J].生物医学工程学杂志,2007,24(4):806-811
[17]Pattanayak D K,Yamaguchi S,Matsushita T,et al.Effect of heat treatments on apatite-forming ability of NaOH-and HCl-treated titanium metal[J].Journal Of Materials Science-Materials In Medicine,2011,22(2):273-278
[18]Chou Y F,Huang W,Dunn J C,et al.The effect of biomimetic apatite structure on osteoblast viability,proliferation,and gene expression[J].Biomaterials,2005,26(3):285-295
[19]Wang K F,Leng Y,Lu X,et al.Theoretical analysis of protein effects on calcium phosphate precipitation in simulated body fluid[J].Crystengcomm,2012,14(18):5870-5878
[20]Narayanan R,Seshadri S K,Kwon T Y,et al.Calcium phosphate-based coatings on titanium and its alloys[J].Journal of Biomedical Materials Research Part B,2008,85(1):279-299
