大鼠骨髓基质细胞的培养*
2014-11-21周谊芬董玉林
周谊芬,董玉林
(南通大学医学院人体解剖学系,江苏226001)
骨髓基质细胞(marrow stromal cells,MSCs)是一种广泛存在于骨髓组织中而非造血的实质干细胞[1-2]。目前研究结果显示,在一定条件下,啮齿类MSCs能够向神经元、心肌细胞和其它类型的细胞分化[3],被认为是最有临床应用前景的干细胞来源之一[4]。本实验对SD大鼠的MSCs进行了体外分离培养,为进一步研究MSCs的分化潜能奠定了基础。
1 材料与方法
1.1 材料 (1)试验动物:SD普通大鼠4只,清洁级,体重为225~275g,雌雄不拘,由南通大学实验动物中心提供。(2)试剂:IMDM培养基及胎牛血清FBS(GIBCO 公司)。
1.2 方法 (1)MSCs分离、纯化、扩增:取SD普通大鼠,腹腔注射1%戊巴比妥钠(40 mg/kg),麻醉后,75%乙醇浸泡30 min,移至超净工作台上,剔除大鼠两侧的双下肢毛发,2%碘酊消毒,75%乙醇脱碘2次。严格无菌操作下解剖并取大鼠两侧的双下肢,剪除软组织,分离股骨。除去股骨的骨骺段,暴露两端的骨髓腔,用含10%FBS的IMDM完全培养液反复冲洗骨髓腔。收集冲洗液于无菌离心管中,得到细胞悬液,室温下1 000 r/min离心5 min。离心后离心管内的细胞悬液分层,倒掉上清液,加入含10%FBS的IMDM完全培养液重悬细胞,充分吹打形成单细胞悬液。接种于25 mL培养瓶中,置于37℃、5%的CO2恒温培养箱,用全骨髓培养法培养MSCs。48 h后全部更换新鲜培养液,去除未贴壁细胞,继续培养。每隔3~4 d更换新鲜培养液。待贴壁细胞达到80%以上时,以0.25%胰蛋白酶消化,1∶1传代培养。(2)MSC的传代培养:待原代培养的细胞达到80%以上时,进行传代培养。弃去培养瓶中的培养液,DHank液漂洗细胞3次,用0.25%胰蛋白酶均匀覆盖细胞表面,37℃、5%的CO2恒温培养箱放置1~3min。倒置显微镜下密切观察细胞的形态变化,当培养瓶内的细胞开始皱缩成球形。当开始悬浮时,立即加含10%FBS的IMDM完全培养液终止消化。并用吸管轻轻地反复吹打,使瓶壁上的细胞脱落,形成细胞悬液,计数。调整细胞浓度为1.6×105/mL,接种于24孔板,每孔500 μL。待贴壁细胞生长融合达50%~60%时,用PBS轻轻漂洗3次后,用4%多聚甲醛固定1 h,然后再用PBS轻轻漂洗3次。(3)体外培养MSCs的显微镜观察:倒置荧光显微镜下观察MSCs的生长情况和形态特征,并拍照。
2 结 果
原代MSCs接种后24 h内,细胞开始贴壁生长增殖。48 h后全部更换新鲜培养液,去除未贴壁细胞,继续培养。每隔3~4 d更换新鲜培养液,待贴壁细胞达到80%以上时,以0.25%胰蛋白酶消化,1∶1传代培养。倒置相差显微镜观察发现,接种后24 h内细胞开始贴壁,贴壁细胞呈梭形或扁平形(图1A)。48 h后贴壁细胞沿培养瓶壁伸展开,圆形,折光性强,细胞壁完整,胞核隐约可见,胞质丰富(图1B)。传至第5代的MSCs纯度高,增殖能力旺盛,呈梭形或纺锤形的细胞,呈漩涡状、菊花状排列生长(图1C、D)。
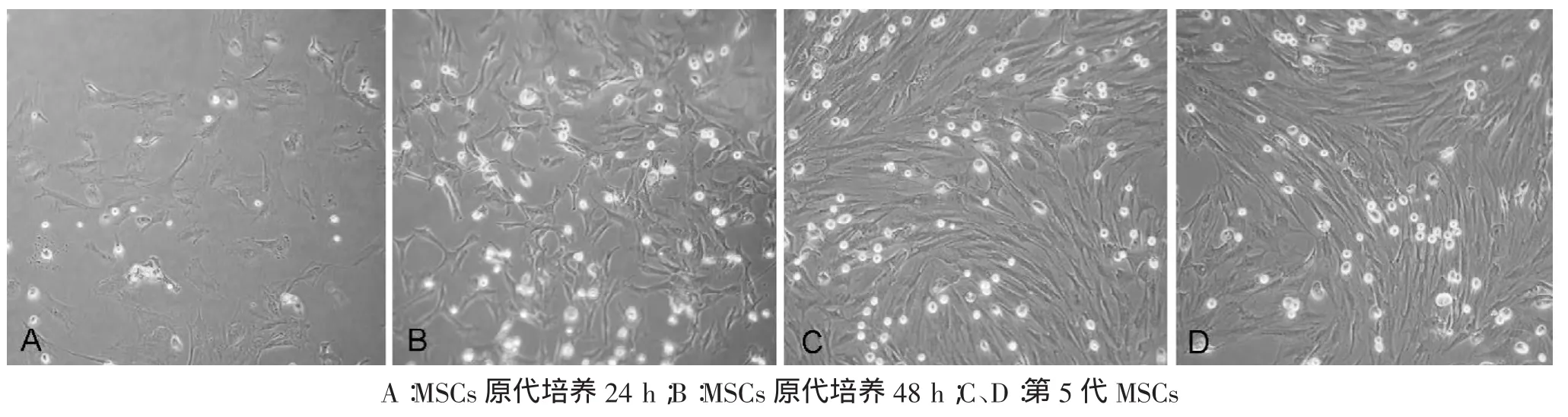
图1 MSCs体外培养的形态特点
3 讨 论
目前对人、兔、猴、大鼠等不同种属的MSCs进行培养显示[5],在研究过程中其取材部位及方式等各有不同。在本实验中我们选用了来源丰富、取材方便[6]的SD清洁大鼠作为实验对象,腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后,取大鼠双下肢股骨。用含10%FBS的IMDM完全培养液对骨髓腔进行冲洗,以获得骨髓组织,此操作方法对骨髓中的细胞成分损伤小。
常用于分离MSCs的方法有4种[7]:密度梯度离心法、贴壁筛选法、流式细胞仪分离法和免疫磁珠法。密度梯度离心法是根据骨髓中各种细胞成分比重的不同,用Percoll分离液将MSCs分离出来。贴壁筛选法主要是根据MSCs的高度粘附特性,在培养过程中其可以紧密地粘附培养瓶壁生长。培养48 h内更换培养液去除不能贴壁的细胞,纯化培养的MSCs。过程操作简单,MSCs增殖快,在短期内可获得较多的MSCs,但所得MSCs纯度不高。流式细胞仪分离法是根据MSCs的胞体小和细胞无颗粒来进行细胞分离的,对细胞活性影响较大,所获得的细胞培养24 h后易死亡。免疫磁珠法可以能得到纯度较高的MSCs,但在实验中,所需要的试剂和仪器都比较昂贵,不宜于广泛使用。因此,本实验采用密度梯度离心法结合贴壁筛选法,对分离的MSCs进行体外培养,所得细胞增殖旺盛,活力强,随着培养传代的不同,细胞的形态不同。在倒置显微镜下观察90%以上的MSCs形态呈梭形或纺锤形的细胞,呈漩涡状、菊花状排列生长。
[1]刘巧云,易黎.骨髓基质细胞分离培养、体外向神经细胞诱导分化及其在中枢神经系统疾病中的研究进展[J].神经损伤与功能重建,2010,5(2):139-142,146.
[2]Li Y,Chopp M.Marrow stromal cell transplantation in stroke and traumatic brain injury[J].Neurosci Lett,2009,456(3):120-123.
[3]Sauerzweig S,Munsch T,Lessmann V,et al.A population of serum deprivation-induced bone marrow stem cells (SDBMSC)expresses marker typical for embryonic and neural stem cells[J].Exp Cell Res,2009,315(1):50-66.
[4]边颖,何志义.骨髓基质细胞对大鼠缺血性脑梗死神经功能的影响[J].中国老年学杂志,2010,30(23):3529-3530.
[5]Cornet F,Broux O,Anselme K,et al.Effect of dexamethasone on moesin gene expression in rabbit bone marrow stromal cells[J].Mol Cell Biochem,2004,265(1/2):79-83.
[6]Parr AM,Tator CH,Keating A.Bone marrow-derived mesenchymal stromal cells for the repair of central nervous system injury[J].Bone Marrow Transplant,2007,40(7):609-619.
[7]Gurevich O,Vexler A,Marx G,et al.Fibrin microbeads for isolating and growing bone marrow-derived progenitor cells capable of forming bone tissue[J].Tissue Eng,2002,8(4):661-672.
