稀土离子Tb3+与阿霉素相互作用的光谱研究
2014-11-21王东新郗晓云李英奇
王东新,郗晓云,李英奇
(1山西医科大学公共卫生学院卫生化学教研室,太原 030001;2山西大学化学化工学院;*通讯作者,E-mail:wdx2002hx@aliyun.com)
阿霉素(doxorubicin hydrochloride,DOX)是一种广谱抗癌药物,通过微生物方法合成的一种含糖苷的蒽环类抗生素,其结构见图1。它的抗癌作用机制是能嵌入细胞的双链DNA,抑制RNA和DNA的合成,对RNA的抑制作用最强,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用[1]。同时DOX也是很好的金属螯合剂,研究表明DOX与Fe3+配位可加强DOX与DNA的作用,同时产生的自由基可引起DNA的氧化损伤,提高DOX的抗癌效率[2]。但是由于DOX具有较强的骨髓抑制作用和心脏毒性[3],易使肿瘤细胞产生耐药性,从而限制其临床的应用。
动物体内的抑癌实验和体外实验证明稀土离子对肉瘤和化学致癌均有抑制作用[4,5],稀土离子由于其离子半径适中、电荷多,在体内易与各种蛋白配位,并有较差的细胞穿透性[6],从而失去其抗癌功能。但是与一些易于穿透细胞膜,特别是核膜的配体配位后可加强其抗癌功能。稀土离子铽(Tb3+)的配合物具有优异的荧光特性而便于对其进行光谱分析,近年来对Tb3+在生物体内的荧光成像研究较多[7],但是 Tb3+与 DOX配合物的研究未见报道。本文主要使用光谱方法对Tb3+与DOX形成的配合物及其稳定性进行了研究,并对DOX-Tb3+配合物是否可提高DOX的抗癌作用进行了测定。

图1 阿霉素结构示意Figure 1 The structure of DOX
1 材料与方法
1.1 材料
阿霉素(DOX,doxorubicin hydrochloride,深圳万乐药业有限公司,批号H44024359),TbCl3(上海丹曦化工科技有限公司),实验用Hepes(pH 7.4)缓冲体系,噻唑蓝(MTT,Sigma),细胞培养基DMEM(赛默飞世尔生物化学制品有限公司),胎牛血清(FBS,杭州四季青生物工程材料有限公司),胰蛋白酶(Trypsin,Amresco),EDTA(北京化工厂),二甲基亚砜(DMSO,Amresco),实验中所用化学试剂均为分析纯,细胞培养用水为三次蒸馏水,其他用水为一次蒸馏水,人肝癌细胞(HepG2细胞)由山西大学生物科学技术所提供。
1.2 仪器
水套式二氧化碳细胞培养箱(HF160W,上海力申科学仪器有限公司),酶标仪(Model 550,美国Bio-rad公司),紫外-可见分光光度计(Cary E-clipse,美国VARIAN公司),荧光分光光度计(Cary Eclipse,美国VARIAN公司)。
1.3 试验方法
1.3.1 DOX紫外可见吸收光谱的测定 室温下,将DOX的Hepes溶液加入到1 cm比色皿中,以Hepes缓冲液为空白,绘制吸收光谱。测定480 nm处DOX的吸光度并依据其摩尔吸光系数确定其浓度(ε=11 500 L/(mol·cm))[8]。用 50 μl微量注射器向 DOX(5.0×10-5mol/L)的 Hepes(pH 7.4)溶液中逐量加入Tb3+溶液,摇匀,扫描光谱图不变时为反应平衡,并记录该光谱图。
1.3.2 荧光光谱测定 室温下,将 DOX的 Hepes溶平液加入到1 cm比色皿中,设定激发波长为480 nm,激发狭缝和发射狭缝均为10 nm,绘制500-750 nm的荧光光谱。同时逐量加入Tb3+溶液,摇匀,扫描光谱图不变时为反应平衡,并记录光谱图。
1.3.3 DOX-Tb3+配合物稳定性的测定 将 DOX与Tb3+按1∶1的比例加入1 cm比色皿中,反应后扫描紫外可见吸收光谱,并分别加入氨基酸(苯丙氨酸、色氨酸等)和EDTA观察光谱的变化。
1.4 MTT比色法检测细胞活性
HepG2细胞接种到含有10%胎牛血清的DMEM培养液中,置于37℃、饱和湿度、5%CO2的培养箱中培养,待细胞贴壁长满至80%-90%满时传代。
取对数生长期的HepG2细胞悬液(7.5×103个细胞/mL)接种于96孔细胞培养板,每孔200μl,置于培养箱中培养16 h,待细胞完全贴壁后,分别加入5.1 μmol/L DOX、TbCl3和 DOX-Tb3+继续培养24 h和48 h,以未处理的空白细胞为对照,每组实验重复6次。反应结束后每孔加入20μl MTT(5 mg/mL),37℃继续培养4 h,弃上清,每孔加150μl DMSO,震荡10 min,待结晶完全溶解,于490 nm下用酶标仪测定吸光度值(A)。按照如下公式计算细胞存活率:细胞存活率(%)=实验组 A值/空白对照 A值×100%。
2 结果
2.1 DOX 与 Tb3+的作用
2.1.1 紫外吸收光谱 在pH为7.4的缓冲液中,DOX在480 nm附近处有一较宽的吸收带,溶液为红色,DOX的吸收光谱见图2。DOX分子中的蒽环上的羟基和酮基上的氧与Tb3+配位,形成金属配合物,使吸收光谱发生变化。实验发现,Tb3+与DOX有较强的相互作用,随着Tb3+的加入,DOX在480 nm处的宽吸收带红移,峰高降低;同时在538 nm和580 nm附近的吸光度升高,得到与DOX有明显区别的吸收曲线(图2),溶液呈现紫色,当Tb3+达到一定浓度后,吸收光谱不再改变。采用光度滴定法进行测定,以480 nm处的吸光度对[Tb3+]/[DOX]摩尔比作图,曲线具有明显的拐点,可以确定Tb3+与DOX形成1∶1的稳定配合物(图3)。
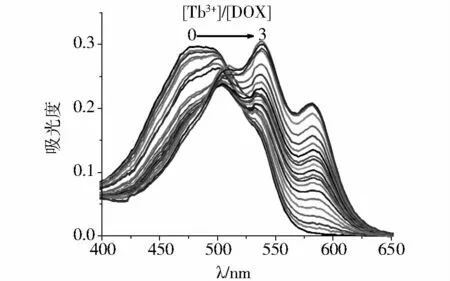
图2 Tb3+滴定DOX的紫外-可见吸收光谱Figure 2 Ultraviolet-visible absorption spectra of DOX titrated by Tb3+
2.1.2 分子荧光光谱 以480 nm作为激发光激发下,DOX在595 nm处有最大荧光发射峰,560 nm有一个肩峰,用Tb3+滴定DOX溶液,记录不同[Tb3+]/[DOX]摩尔比时的荧光光谱。实验表明,随着稀土离子Tb3+的加入,DOX的荧光强度均随之减弱。当Tb3+达到一定浓度后,荧光光谱不再改变。不同浓度Tb3+滴定DOX的荧光光谱变化见图4,结果显示稀土离子Tb3+与DOX发生了作用,生成配合物,使分子的共轭体系发生改变,荧光效率降低。以595 nm的荧光强度对[Tb3+]/[DOX]摩尔比作图(见图5),得到配合物的配比亦为[Tb3+]/[DOX]=1∶1。

图3 DOX的吸光度随[Tb3+]/[DOX]摩尔比的变化Figure 3 The absorbance of DOX at different molar ratio of[Tb3+]/[DOX]

图4 Tb3+滴定DOX的荧光光谱Figure 4 The fluorescent spectra of DOX titrated by Tb3+
2.2 DOX和稀土离子配合物与氨基酸、EDTA的作用
为进一步了解稀土离子Tb3+与DOX的结合能力强弱,我们研究了在氨基酸和EDTA的滴加下DOX与稀土离子Tb3+配合物的光谱变化。氨基酸、EDTA与DOX本身不发生作用,但可与DOX分子竞争中心离子Tb3+,对DOX的稀土离子配合物有影响。实验表明,氨基酸(苯丙氨酸、色氨酸等)的加入对Tb3+-DOX的特征吸收曲线没有明显影响,其在580nm处附近的吸收带无变化,说明这些氨基酸不能将Tb3+从DOX-Tb3+配合物中竞争下来;而强络合剂EDTA的加入使DOX-Tb3+的特征吸收曲线发生变化,使其在580 nm处附近的吸收带消失,而480 nm的吸光度升高(图6,见第341页),显示出游离DOX的特征吸收曲线,溶液的颜色也由紫色变成红色,表明EDTA使DOX-Tb3+配合物解离。

图5 Tb3+的加入对DOX在595 nm处荧光强度的变化Figure 5 The changes of the fluorescence intensity of DOX at 595 nm after titrating Tb3+
2.3 DOX-Tb3+配合物对细胞毒性的影响
MTT试验是基于细胞水平测定毒性的方法,以HepG2细胞为模型,使用 MTT试验分别测定了DOX、TbCl3和DOX-Tb3+配合物对细胞的存活率,由此可得出对细胞毒性的大小顺序为TbCl3<DOX<DOX-Tb3+(见图7)。实验证明TbCl3对细胞的毒性较小,这可能是因为Tb3+具有较强的配位能力以及较差的细胞穿透性而难以发挥其功效。但是当DOX与Tb3+配位后对细胞的毒性比自由的DOX增大,差异具有统计学意义(P<0.05,见图7),可能是DOX-Tb3+与DNA的作用比DOX本身增强,Tb3+的存在使DOX对细胞毒性起协同作用。

图6 氨基酸和EDTA的滴加对DOX-Tb3+配合物吸光光谱的变化Figure 6 The changes of the absorbance spectra of DOX-Tb3+complex after titrating amino acid and EDTA

图7 MTT法测定细胞的存活率Figure 7 The cell viability was determined by MTT assay
3 讨论
DOX可与稀土离子Tb3+相互作用形成1∶1的稳定配合物,生物小分子如氨基酸等难以使配合物解离,只有强的络合剂如 EDTA才能将其解离。DOX-Tb3+配合物可增加 DOX对癌细胞的毒性,Tb3+对DOX的细胞毒性起协同作用。
[1]王肇炎,陈正玉,赖清宏.阿霉素的临床应用[M].北京:人民卫生出版社,1993:2-10.
[2]章俊军,邹国林,吕利红,等.阿霉素铁(Ⅲ)配合物与DNA结合作用的研究[J].生物物理学报,1999,15(1):19-24.
[3]Quiles Jl,Huertas JR,Battino M,etal.Antioxdant nutrients and adriamycin toxicity[J].Toxicology,2002,180(1):79-95.
[4]王宗惠,苏英,庞新民,等.混合硝酸稀土对人正常细胞及癌细胞生长作用的体外观察[J].卫生毒理学杂志,1994,8(3):197-199.
[5]王宗惠,庞新民,苏英,等.稀土对小鼠腹腔巨噬细胞特异功能的作用影响[J].卫生毒理学杂志,1994,8(3):220-221.
[6]Mohandessi S,Rajendran M,Magda D,etal.Cell-penetrating peptides as delivery vehicles for a protein-targeted terbium complex[J].Chem Eur J,2012,18(35):10825-10829.
[7]Law GL,Wong KL,Man CWY,etal.Emissive terbium probe for multiphoton in vitro cell imaging[J].J Am Chem Soc,2008,130(12):3714-3715.
[8]Chaires JB,Dattagupta N,Crothers DM.Self-association of daunomycin[J].Biochemistry,1982,21(17):3927-3932.
