高同型半胱氨酸血症患者氧化应激指标的研究
2014-11-20蒋兴亮刘素兰易婷婷
蒋兴亮, 刘素兰, 易婷婷
(川北医学院附属医院检验科,四川南充637000)
高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)作为动脉粥样硬化发病的独立危险因素,与血管疾病存在着密切的联系,其机制可能与对血管内皮细胞结构和功能的直接或间接损伤及基因毒性作用、增强脂质过氧化、促进血管平滑肌细胞(vascular smooth musole cell,VSMC)的增殖和迁移、改变血小板功能及影响凝血系统、促进血管钙化等几个方面有关[1]。同型半胱氨酸(homocysteine,Hcy)在体内极易被氧化,在氧化的同时,释放出活性氧离子(reactive oxygen species,ROS),过量的 ROS引起分子、细胞和组织的损伤。ROS在心血管病变,尤其是动脉粥样硬化过程中扮演重要角色[2]。目前国内、外对HHcy患者氧化与抗氧化状态研究较少,我们拟通过对HHcy患者血浆代表抗氧化状态的循环谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、对氧磷酯酶1(paraoxonase 1,PON1)活性,反映氧化程度的丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)水平及一氧化氮合酶(nitric oxide synthose,NOS)活性的测定,观察 HHcy患者氧化与抗氧化状态,以探讨Hcy致动脉粥样硬化的机制。
材料和方法
一、研究对象
以空腹血浆Hcy≥15μmo l/L为诊断HHcy的标准,选择2011年10月至2012年2月川北医学院附属医院住院患者108例,其中男78例,女30例,年龄25~68岁。根据血浆Hcy升高的程度将HHcy分为轻度(16~30μmol/L)、中度(31~100 μmol/L)和重度(>100 μmol/L)[3],其中轻度组50例、中度组40例、重度组18例。排除冠心病、糖尿病、高血压、甲状腺功能异常、急性感染、严重营养不良、肝肾功能不全、血液系统疾病及恶性肿瘤、接受器官移植的患者和近6个月内服用叶酸、维生素B6、维生素B12以及影响Hcy水平的药物(如卡马西平、苯妥英钠等)。以同期川北医学院附属医院门诊健康体检者106名作为正常对照组,其中男66名,女40名,年龄29~65岁,其年龄和性别与HHcy组比较差异无统计学意义(P>0.05),全部经体格检查和血生化、心电图、腹部B超等检查无心、肝、肾疾病及糖尿病。
二、方法
1.标本收集 所有受检者禁食12 h,于清晨采集静脉血液,肝素抗凝,分离血浆,置-20℃保存备检。
2.血浆PON1活性测定[4]采用速率法测定PON1活性。取试剂1(0.05 mol/L甘氨酸缓冲液,pH 值 10.5,含 1 mmol/L CaCl2、1 mol/L NaCl)150μL,试剂2(试剂1中含1 mol/L对氧磷)50μL,标本8μL,测定350~500 s内对硝基苯酚产生的速度,波长410/340 nm。对硝基苯酚的摩尔吸光系数为1.805×104。仪器为日立7170S自动生化分析仪。
3.血浆MDA测定 硫代巴比妥酸法。试剂盒由南京建成生物工程公司提供。
4.血浆GSH-Px活性测定 5',5'-二硫代双2-硝基苯甲酸比色法。试剂盒由南京建成生物工程公司提供。
5.血浆NO及NOS测定 分别采用硝酸酶还原法及化学比色法测定血浆NO及NOS。试剂盒由南京建成生物工程公司提供。
6.血浆Hcy测定采用酶循环法。试剂盒由四川新成生物科技有限责任公司提供。
7.血脂测定 分别采用磷酸甘油氧化酶-过氧化酶法、胆固醇酯酶-胆固醇氧化酶法、清除法(一步法)及选择性遮蔽法(一步法)测定甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C);采用透射免疫浊度法测定载脂蛋白A(apo A)、载脂蛋白B(apo B)。试剂盒由浙江东瓯诊断产品有限公司提供。所有生化项目均在日立7170S生化分析仪上完成。
8.血浆SOD活性测定 黄嘌呤氧化酶法。试剂盒由南京建成生物工程公司提供。
9.血浆叶酸测定 离子捕获免疫分析法。仪器和试剂均由美国雅培公司提供。
三、统计学方法
结 果
一、HHcy组和对照组各项指标比较
2组的年龄和性别构成比差异均无统计学意义(P>0.05)。HHcy组与对照组血脂、体重指数、血压差异均无统计学意义(P>0.05)。见表1。
二、HHcy组与对照组血浆 PON1、GSH-Px、SOD、NOS活性及MDA、NO、叶酸水平比较
HHcy患者血浆 PON1、SOD、GSH-Px、NOS 活性及NO水平明显低于正常对照组(P<0.01),血浆MDA水平则明显高于正常对照组(P<0.01),见表2。
表1 HHcy组和正常对照组一般资料的比较(±s)

表1 HHcy组和正常对照组一般资料的比较(±s)
注:与正常对照组比较**P<0.01,*P<0.05
?
表2 HHcy组和正常对照组血浆PON1、SOD、GSH-Px、NOS活性及MDA、NO水平比较(±s)
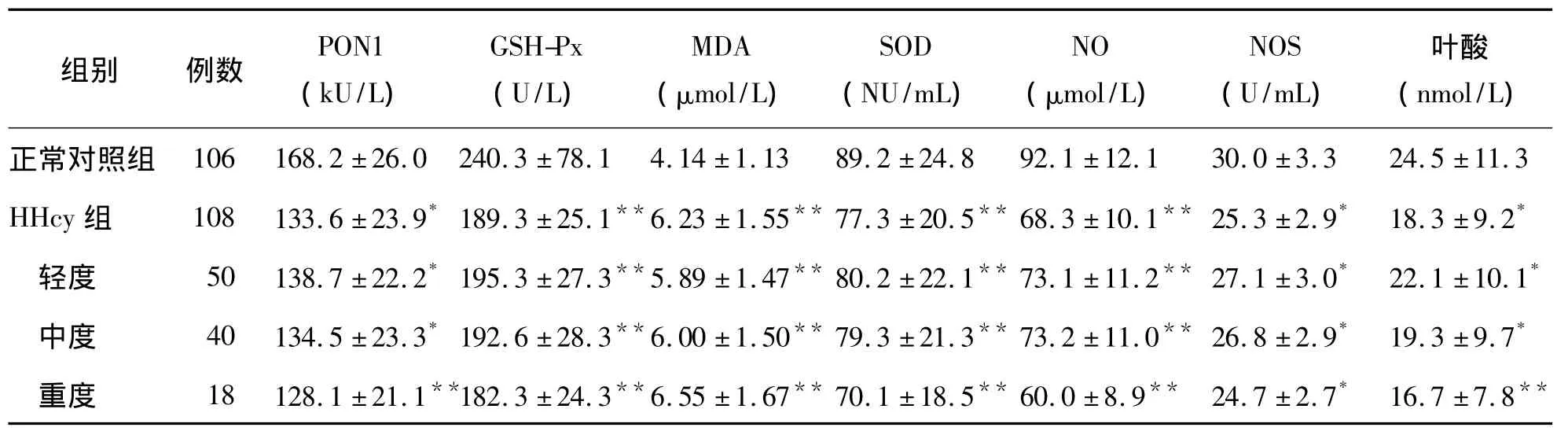
表2 HHcy组和正常对照组血浆PON1、SOD、GSH-Px、NOS活性及MDA、NO水平比较(±s)
注:与正常对照组比较,*P<0.05,**P<0.01
?
三、HHcy患者血浆 Hcy与PON1、GSH-Px、SOD、NOS、MDA、NOS 的相关性分析
HHcy患者血浆 Hcy与PON1、GSH-Px、SOD、NOS、NO呈明显负相关,与MDA呈明显正相关,见表3。
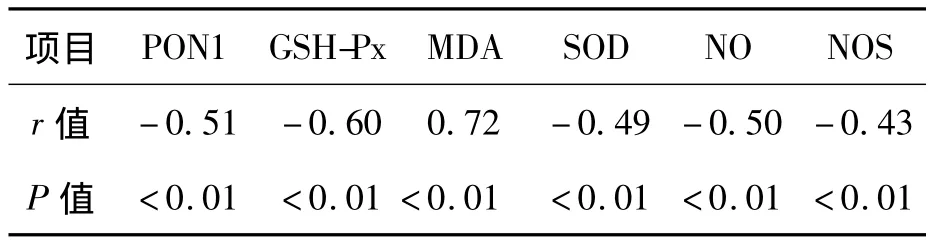
表3 HHcy患者血浆Hcy与PON1、GSH-Px、SOD、NOS、MDA、NO 的相关性分析
讨 论
心脑血管疾病患病率与病死率迄今仍居高不下,已成为威胁人类健康的主要疾病之一。而动脉粥样硬化(AS)是该类疾病重要的病理基础。Hcy是体内蛋氨酸代谢途径中形成的一种含硫氨基酸,属于蛋氨酸循环的中间产物。近年来大量研究证实,HHcy成为继高血脂、高血压、糖尿病、吸烟等因素之后AS和血栓性疾病的一个新的、重要的、独立的危险因素。据估计有5%~7%的普通人血中Hcy有轻至中度的增高,而40%以上确诊为冠状动脉疾病、脑血管疾病、外周动脉阻塞性疾病、周围血管性疾病或反复性静脉血栓症的患者都伴有HHcy[5]。因此,Hcy的致病机制研究成为当今医学领域研究的热点。
本研究结果显示,HHcy患者血浆MDA水平明显高于正常对照组(P<0.01),PON1、GSH-Px、SOD、NO、NOS水平明显降低(P<0.01),且血浆Hcy与MDA呈明显正相关(P<0.01),与PON1、GSH-Px、MDA、SOD、NO、NOS呈明显负相关(P<0.01)。GSH-Px和SOD均为人体内重要的抗氧化酶,在水解ROS的过程中逐步被消耗,使其直接参与血中脂质过氧化物的水解的能力减弱,不能有效清除过氧化物,特别是脂质过氧化物,使其在血中大量蓄积。本研究结果显示HHcy患者体内GSH-Px、SOD活性均明显降低,提示其抗氧化能力降低。而MDA为脂质过氧化的较稳定的代谢产物之一,其水平升高提示脂质过氧化作用增强。本研究结果显示HHcy患者MDA水平明显增高,说明其体内存在脂质过氧化的倾向。
PON1是近年来颇受关注的一种抗氧化酶,与还原型谷胱甘肽(GSH)有协同抗氧化作用[6]。PON1的主要作用一是通过过氧化物酶样作用,降解高密度脂蛋白(HDL)和低密度脂蛋白(LDL)中的氧化脂肪酸和氧化胆固醇,减少脂质的过氧化以抑制LDL和HDL的氧化,保护HDL的抗氧化功能和逆行转运胆固醇的功能[7],抵抗低密度脂蛋白的氧化而减少氧化低密度脂蛋白的生成;二是降解Hcy的代谢产物硫内酯,以减少其致动脉粥样硬化作用[8]。
因此,HHcy患者由于种种原因使ROS产生过多,抗氧化酶如GSH-Px、SOD和PON1及其他抗氧化剂在与ROS的作用中消耗或抗氧化酶产生减少,导致抗氧化酶及其他抗氧化剂不同程度下降,不能清除体内过多的ROS,氧化与抗氧化失衡,大量的ROS在体内蓄积,可能通过多种机制参与了动脉粥样硬化的发生、发展。
导致HHcy患者氧化应激增强的因素还不完全清楚,可能与下列因素有关:第一,Hcy含自由巯基,在金属离子(Fe3+和Cu2+)的存在下,可以自身氧化成同型胱氨酸、Hcy混合性二硫化物和Hcy硫内酯,同时产生H2O2、羟自由基(OH·)和超氧阴离以加剧LDL的氧化反应,形成ox-LDL,从而导致动脉粥样硬化的发生[9]。另外,Hcy抑制前列环素的合成,在黄嘌呤氧化酶催化的氧化反应及花生四烯酸代谢途径中产生的大量自由基、过氧化物及其他有高度活性的物质都参与了Hcy对内皮细胞的损伤作用。第二,Hcy抑制抗氧化酶活性。H2O2生成后可自由地穿透细胞膜,迅速被GSH-Px还原生成H2O。研究显示,Hcy可以降低内皮细胞内稳定状态的GSH-Px的mRNA水平,并抑制酶的活性,导致内皮细胞的抗氧化机制受损,并加强了超氧自由基介导的NO灭活作用[10]。SOD是超氧离子歧化的必需催化酶,具有保护细胞不受氧自由基损害的作用。Hcy可抑制其表达和分泌,导致其对细胞的保护作用减弱。第三,Hcy对NO的影响。Hcy氧化过程中产生的H2O2、,可使NO氧化生成过氧亚硝基(ONOO-),使NO失去生物活性。当HHcy时,Hcy长期作用于内皮细胞使得NOS受损,NOS基因表达减少,NO合成减少。由于NO相对缺乏,S-亚硝基-同型半胱氨酸(S-NO-Hcy)生成减少,导致未被NO结合的游离Hcy损伤内皮细胞,而受损的内皮细胞产生的NO更少,形成恶性循环,最终导致细胞变性坏死[11]。此外,Hcy通过增加NOS抑制剂非对称性二甲基精氨酸(ADMA)的生成,而降低内皮细胞释放 NO[12]。
本研究结果只针对单纯HHcy患者氧化与抗氧化指标的变化,而以前多集中于HHcy合并糖尿病、脑梗死等患者中氧化与抗氧化指标的变化的研究,其结果基本一致,说明HHcy患者无论有无临床表现,其氧化与抗氧化已失衡,尤其是单纯HHcy患者其氧化与抗氧化指标已发生明显变化,应引起临床高度重视。
综上所述,HHcy患者ROS产生增加,机体的抗氧化酶在清除ROS时其活性降低,导致抗氧化能力下降,使体内氧化与抗氧化处于不平衡状态,产生氧化应激,通过氧化应激机制参与动脉粥样硬化的发生发展。因此,有必要关注HHcy患者体内氧化与抗氧化状态。
[1]Zhou J,Austin RC.Contributions of hyperhomocysteinemia to atherosclerosis:causal relationship and potential mechanisms[J].Biofactors,2009,35(2):120-129.
[2]Lakshmi SV,Padmaja G,Kuppusamy P,etal.Oxidative stress in cardiovascular disease[J].Indian J Biochem Biophys,2009,46(6):421-440.
[3]Tascilar N,Ekem S,Aciman E,etal.Hyperhomocysteinemia as an independent risk factor for cardioembolic stroke in the Turkish population[J].Tohoku J Exp Med,2009,218(4):293-300.
[4]Atamer A,Bilici A,Yenice N,etal.The importance of paraoxonase 1 activity,nitric oxide and lipid peroxidation in hepatosteatosis[J].J Int Med Res,2008,36(4):771-776.
[5]Antoniades C,Antonopoulos AS,Tousoulis D,etal.Homocysteine and coronary atherosclerosis:from folate fortification to the recent clinical trials[J].European Heart J,2009,30(1):6-15.
[6]陈晓蓓,徐根云,吕国才.冠心病血清对氧磷酯酶1活性与氧化功能指标的研究[J].检验医学,2007,22(4):488-489.
[7]Ferretti G,Bacchetti T,Masciangelo S,etal.Effect of homocysteinylation on high density lipoprotein physico-chemical properties[J].Chem Phys Lipids,2010,163(2):228-235.
[8]Atamer A,Kocyigit Y,Ecder SA,etal.Effect of oxidative stress on antioxidant enzyme activities,homocysteine and lipoproteins in chronic kidney disease[J].J Nephrol,2008,21(6):924-930.
[9]Antoniades C,Shirodaria C,Warrick N,etal.5-methyltetrahydrofolate rapidly improves endothelial function and decreases superoxide production in human vessels:effects on vascular tetrahydrobiopterin availability and endothelial nitric oxide synthase coupling[J].Circulation,2006,114(11):1193-1201.
[10]Hoffman M.Hypothesis:hyperhomocysteinemia is an indicator of oxidant stress[J].Med Hypotheses,2011,77(6):1088-1093.
[11]Sharma M,Rai SK,Tiwari RK,etal.Effects of nitric oxide modulators on cardiovascular risk factors in mild hyperhomocysteinaemic rat model[J].Basic Clin Pharmacol Toxicol,2008,103(1):25-30.
[12]Veresh Z,Racz A,Lotz G,etal.ADMA impairs nitric oxide-mediated arteriolar function due to increased superoxide production by angiotensinⅡ-NAD(P)H oxidase pathway[J].Hypertension,2008,52(5):960-966.
