采用可视化方法通透性处理大肠杆菌细胞生产海藻糖合成酶*
2014-11-20崔怀言江凌张文婧唐飞徐娴李霜黄和
崔怀言,江凌,,张文婧,唐飞,徐娴,李霜,黄和
1(南京工业大学生物与制药工程学院,江苏南京,210009)
2(南京工业大学 食品与轻工学院,江苏南京,210009)
海藻糖(Trehalose),是一种由葡萄糖分子以α,α-1,1-糖苷键相连而成的非还原性二糖[1]。由于海藻糖甜度低、性质稳定,对于生物大分子(生物膜、蛋白质、DNA)具有良好的非特异性保护作用,因此,该双糖被广泛应用于食品、医药、化妆品等精细化学品领域[2]。海藻糖生产方法主要有微生物发酵法和酶合成法,而实际生产中多采用基因工程技术获得高效率酶的表达系统。其中利用海藻糖合成酶以麦芽糖为原料的一步酶法生产海藻糖的路线由于工艺简单、易于调控等优势,成为未来工业化生产海藻糖的趋势[3-4]。
海藻糖合成酶属胞内酶,传统提取工艺通常先将细胞破碎,经逐级分离纯化后才可使用,酶活损失较大,且操作复杂,设备投资大,制约了其在工业生产中的应用[5]。而采用通透性处理细胞技术,在不破坏细胞整体内部有机结构的前提下改变细胞壁和细胞膜的通透性,使得小分子底物能够自由进出细胞膜的技术则有望克服上述缺点[6]。薛璐等采用甲苯和EDTA对恶臭假单胞杆菌H76菌株进行了渗透处理,所得通透性细胞海藻糖合酶酶活高出未处理细胞的100倍以上[7]。张峻等系统对比了甲苯、氯仿、乙醇、吐温、溶菌酶等试剂对亚栖热菌CBS-01菌体细胞的渗透效果,最终确定了以2%的甲苯为渗透剂制备通透性细胞海藻糖合成酶的工艺路线[8]。但由于甲苯、氯仿等化学试剂对人体有毒害作用,存在食品安全隐患;处理细胞过程中易造成环境污染,同时也增加了海藻糖后续分离的难度,大大限制了化学通透性试剂在食品领域中的应用。
硫酸粘杆菌素是一种具有抗菌活性的生物表面活性剂,最早在杆属多粘芽肥杆菌变种粘菌素(Bacillus polymyxa var.colistinus)的培养基中被发现,对革兰氏阴性菌有较强的抗菌作用,作为饲料添加剂在饲料工业中已被广泛采用。研究表明,其抗菌机制主要是与细菌胞浆膜中脂蛋白的游离的磷酸酯盐相互作用,使胞浆膜的表面张力降低和通透性增加,进而使胞内成分特别是嘌呤嘧啶从细胞原浆中逃逸,以导致细菌死亡[9]。本研究首次选用硫酸粘杆菌素作为通透性试剂处理大肠杆菌细胞,对其处理大肠杆菌细胞的浓度、温度和时间进行单因素分析;进而,采用一种新的工艺条件优化方法——可视化优化方法[10-11],对通透性处理大肠杆菌的制备工艺条件进行分析、处理,预测出优化的工艺条件。
1 材料与方法
1.1 材料
菌种:重组大肠杆菌 BL21(Escherichia coli)菌株,本实验室构建[4]。
加氨苄的LB培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,氨苄抗生素0.1 g/L。
平板加氨苄抗生素的LB固体培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,氨苄抗生素0.1 g/L,琼脂20 g/L。
主要试剂:硫酸粘杆菌素购于Ruibio公司,液相分析用色谱纯麦芽糖、海藻糖、葡萄糖购于Sigma公司,分析纯麦芽糖购于中国惠兴生物化学试剂有限公司。
主要设备:高效液相色谱仪 UltiMate3000,美国Dionex公司;恒温摇床HYL-A,太仓市强乐实验设备厂;低温高速离心机3-30K,德国Sigma公司;超声破碎仪GA88-II,无锡上佳生物科技有限公司。
1.2 实验方法
1.2.1 重组大肠杆菌发酵生产海藻糖合成酶
在37℃,200 r/min条件下培养重组大肠杆菌BL21,培养细胞浓度至OD6000.6~0.8加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG),终浓度为 0.8 mmol/L,诱导时间 8 h[4]。
1.2.2 通透性大肠杆菌的制备
发酵结束后,在6 000 r/min离心10 min后弃上清液,用0.04 mol/L pH 7.5的磷酸盐缓冲液(PBS)重悬洗涤2次,离心后得大肠杆菌湿菌体,加入硫酸粘杆菌素进行通透性处理,在200 r/min条件下对硫酸粘杆菌素浓度、处理时间、处理温度单因素处理后在6 000 r/min离心10 min后弃上清液,用磷酸盐缓冲液洗涤2次,并1/2体积重悬,固定细胞菌悬液浓度为10%。此细胞悬浮液可用于海藻糖合成。
1.2.3 酶活测定
15 mL的通透性处理的细胞悬浮液与50 mL的30%(W/V)麦芽糖底物,在25℃,200 r/min条件下反应30 min。混合液于沸水浴加热10 min终止酶反应。待其冷却后,5 000 r/min离心10 min,取上清液,测定生成的海藻糖含量。
酶活力单位定义:在25℃,l min生成l nmoL海藻糖所需的海藻糖合酶的量为1个酶活力单位(U)。
1.2.4 海藻糖含量的测定
使用高效液相色谱法测定样品中海藻糖的含量。
流动相为 V(乙腈)∶V(水)=75∶25;流速:0.6 mL/min;层析柱选择氨基柱(柱温35℃);选用视差折光检测器。
1.2.5 智能可视化软件优化
采用可视化优化方法对海藻糖制备工艺条件进行分析处理,预测出最佳的工艺条件。可视化优化的基本原理如图1所示。

图1 可视化优化方法基本原理图Fig.1 Principles of visual optimization method
通过神经网络原理将样本数据多维空间面貌特征维映射到二维平面上,运用 MATLAB软件编写程序语言产生目标函数等值线,然后从映射平面图中找出满足工艺条件的优化点或优化方向,并通过逆映射算法把平面上定出的优化点逆映射到多维空间用原始变量表示,从而预测出优化工艺条件[12-13]。
2 结果与分析
2.1 通透性处理大肠杆菌实验参数的优化
2.1.1 通透性试剂的最适浓度
在细胞悬液中加入硫酸粘杆菌素,使得最终质量浓度分别达到1.0、1.2、1.5、1.7、2.0 g/L,在25 ℃条件下反应60 min,测定细胞悬浮液中海藻糖合成酶的活性,结果如图2所示。

图2 硫酸粘杆菌素质量浓度对细胞通透性的影响Fig.2 Effects of colistin sulfate concentrations on cell permeability
由图2可知,硫酸粘杆菌素浓度的增加,使得大肠杆菌细胞通透性同步增加,利于底物小分子进入胞内参与酶催化反应,当浓度达到1.5 g/L时,检测酶活达到最大值。但是,随着硫酸粘杆菌素浓度的进一步增加,检测酶活反而迅速下降。由于硫酸粘杆菌素能够通过自身所带正电荷与细菌胞浆膜磷脂分子上的负电荷形成静电吸附,结合并进入质膜中,通过其分子间的相互位移而聚合形成跨膜离子通道,扰乱质膜上蛋白质和脂质原有的排列秩序。硫酸粘杆菌素添加浓度越高,细胞膜的有序结构破坏越严重,最终致使菌体溶解,包括海藻糖合成酶在内的胞内物外溢,从而使得检测酶活急剧降低[9]。
2.1.2 通透性处理的最适时间
选取1.5 g/L硫酸粘杆菌素在25℃条件下处理大肠杆菌细胞,处理时间分别为30、60、90、120 min,测定细胞悬浮液中海藻糖合成酶的活性,结果见图3。

图3 硫酸粘杆菌素处理细胞时间对细胞通透性的影响Fig.3 Effects of colistin sulfate processing time on cell permeability
由图3可见,在处理时间少于60 min时,随着处理时间的增加,细胞通透性程度加剧,使得检测到的酶活提高,在60 min时达到最高值,随后,随着处理时间的增加,可检测到的酶活急剧下降。可能原因是,当处理时间延长时,硫酸粘杆菌素与细胞膜表面形成的离子通道激增,由于渗透压的作用使得水分子进入胞内,细胞溶胀,部分海藻糖合成酶从细胞中释放出来,从而使得检测到的酶活下降[14]。
2.1.3 通透性处理的最适温度
选取1.5 g/L硫酸粘杆菌素处理大肠杆菌细胞60 min,处理温度分别是 25、28、30、33、35 ℃,测定细胞悬浮液中海藻糖合成酶的活性,结果见图4。
由图4可见,随着处理温度的增加,硫酸粘杆菌素的处理效果迅速增强,透性化程度明显,在温度达到30℃时透性化程度最佳,随后随着温度的增加,酶活逐渐降低,因为此酶在15~55℃之间保持较高的催化活性[4],所以可能原因是温度增加使得细胞膜脂质和蛋白质加速位移,硫酸粘杆菌素能够较容易进入质膜形成离子通道,导致离子通道有所增加,少量酶从细胞中释放出来[14]。
2.2 通透性细胞海藻糖合成酶的反应工艺条件优化

图4 硫酸粘杆菌素处理细胞的温度对细胞通透性的影响Fig.4 Effects of colistin sulfate processing temperature on cell permeability
2.2.1 设计正交实验
根据单因素实验结果,选定浓度、时间、温度3个因素,采用正交表L9(33)对这3个因数进行综合考察。通过正交实验得出的最优工艺;硫酸粘杆菌素浓度1.5g/L,处理时间60 min,处理温度是35℃。正交实验结果见表1。

表1 正交实验结果表Table 1 Results of orthogonal experiment
实验数据的方差分析表明,本实验所选用的因素对海藻糖的转化产率有显著影响,各因素间差异显著。由极差分析可知,各因素对海藻糖产率影响的主次顺序为硫酸粘杆菌素浓度>处理时间>处理温度。处理温度影响最小,与单因素实验结果相符。
2.2.2 函数拟合结果
利用可视化优化软件优化正交实验设计得到的实验结果,图5是目标函数经过100次迭代拟合计算后产生的拟合曲线图。从图5中可知,其逼近能力很强,除少数几个点稍微有些偏差以外,其余的点几乎与原始点重合。

图5 函数拟合图Fig.5 Function fitting figure
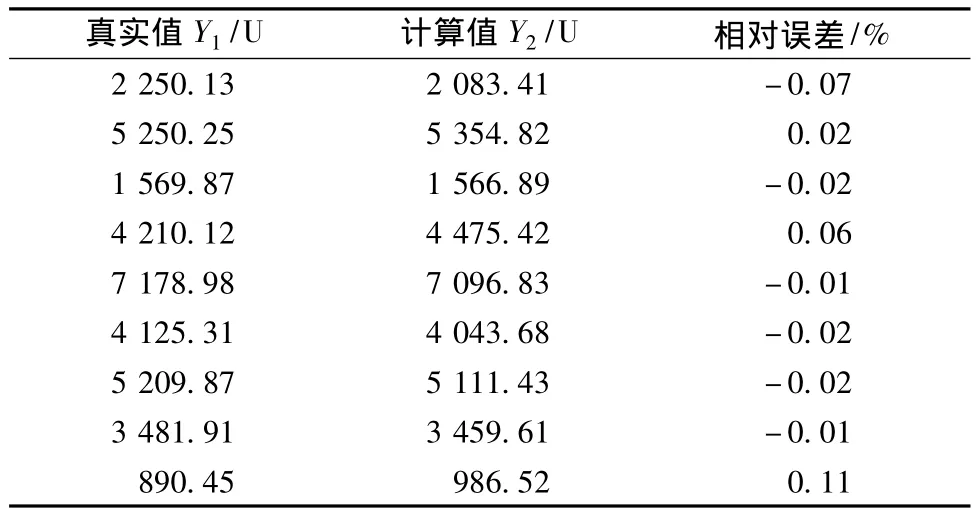
表2 可视化优化方法的优化结果Table 2 The optimization results of visual optimization method
2.2.3 产生目标函数等值线
可视化优化结果如图6所示,标号为1~9的9个点为每次实验在映射图上所对应的点,黑色实线为各组实验酶活的等值线。根据逆映射算法预测出优化的实验操作点,其最优实验条件为:以1.42 g/L的硫酸粘杆菌素为渗透剂,35℃渗透处理72 min。预测酶活可达达7 734.32 U/mL。实际操作验证以1.40 g/L的硫酸粘杆菌素为渗透剂,35℃渗透处理72 min,酶活可达到7 425.13 U/mL。可视化优化软件预测结果与实际结果基本相符。此时获得的海藻糖合成酶酶活是传统超声破碎法制备的酶活的2.09倍(7 425.32 U/mL、3 552.13 U/mL)。
2.3 通透性细胞重复使用批次考察
为了考察通透性细胞胞内海藻糖合成酶酶活的
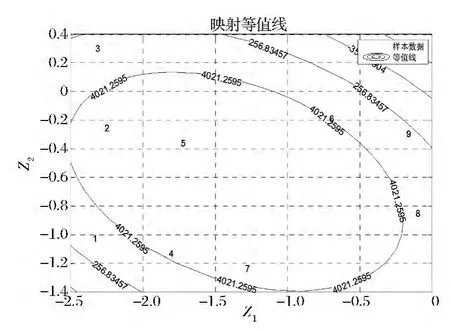
图6 通透性细胞制备工艺降维映射平面图Fig.6 Dimension reduction map of the permeable cell preparation technology

图7 通透性细胞使用批次考察Fig.7 The using batch of the permeable cells
按优化后方法得到的通透性细胞进行了16批次的酶催化反应(共192 h),海藻糖合成酶的转化率基本保持稳中略降的走势,16批次后仍保留65.12%的较高转化率。
3 结论
细胞经透性化处理后,虽改变胞浆膜的通透性,但细胞整体结构完整,底物既能进入细胞,又保证了胞内酶催化作用的充分发挥,同时细胞结构对酶还具有一定的保护作用。本文选取生物表面活性剂硫酸粘杆菌素为透性化试剂,并采用可视化优化方法对硫酸粘杆菌素透性化处理大肠杆菌制备工艺条件进行优化。由于硫酸粘杆菌素可生物降解,不会造成环境污染,获得的透性化细胞拥有较高酶活,反复使用16批后海藻糖的转化率维持在65%以上,显示了良好的应用前景,给海藻糖低成本、高效率的工业化生产开辟出一条新工艺路径。
[1]Eroglu,Ali Russo,Michael J,et al.Intracellular trehalose improves the survival of cryopreserved mammalian cells[J].Nature Biotechnology,2000,18(2):163 -167.
[2]ZHANG Ran,PAN Yuan T,HE Shouming,et al.Mechanistic analysis of trehalose synthase from mycobacterium smegmatis[J].The Journal of Biological Chemistry,2011,286(41):35 601-35 609.
[3]LIANG Jiayuan,HUANG Ribo,HUANG Ying,et al.Cloning,expression,properties,and functional amino acid residues of new trehalose synthase from Thermomonospora curvata DSM 43183[J].Journal of Molecular Catalysis B:Enzymatic,2013,90:26-32.
[4]JIANG Ling,LIN Ming,ZHANG Yang,et al.Identification and Characterization of a Novel Trehalose Synthase Gene Derived from Saline-Alkali Soil Metagenomes[J].Plos One,2013,8(10):1-10.
[5]ZHOU Yan,YUAN Qipeng,GAO Huiling,et al.Production of trehalose by permeabilized Micrococcus QS412 cells[J].Journal of Molecular Catalysis,2006,43(1 - 4):137-141.
[6]Hye-Jin Oh,Kyung-Cheol Shin,Deok-Kun Oh.Production of 10-hydroxy-12,15(Z,Z)-octadecadienoic acid from αlinolenic acid by permeabilized cells of recombinant Escherichia coli expressing the oleate hydratase gene of Stenotrophomonas maltophilia[J].Biotechnology Letters,2013,35:1487-1493.
[7]薛璐,马莺.透性化细胞海藻糖合酶特性的研究[J].食品科学,2003,24(3):26-29.
[8]张峻,陈晓云,齐欣,等.透性化细胞海藻糖合酶的制备及其性质研究[J].南开大学学报自然科学版,2005,38(5):93-96.
[9]Jon-Paul S Powers,Robert E.W Hancock.The relations between peptide structure and antibacterial activity[J].Peptides,2003,24(11):1 681-1 691.
[10]鄢烈祥,华丽.工业过程操作优化可视化方法:降维分析法[J].武汉理工大学学报,2002,24(7):79-82.
[11]Yan Liexiang,Ma Dexian.Global optimization of nonconvex nonlinear programs using Line-up Competition Algorithm[J].Computers& Chemical Engineering,2001,25(11-12):1 601-1 610.
[12]佘艳,张光旭,鄢烈祥,等.交联-羧甲基淀粉合成工艺可视化优化的研究[J].中国粮油学报,2009,24(4):62-65.
[13]ZHANG Guangxu,SHE Yan,YAN Liexiang,et al.The application of an advanced visualized method in synthesis process optimization of carboxymethyl hydroxyethyl starch[J].Carbohydrate Polymers,2010,79(3):673 -676.
[14]Heller W T,Waring A J,Lehrer R I,et al.Membrane thinning effect of the betasheet antimicrobial protegrin[J].Biochemistry,2000,39:139-145.
