和缓艾美耳球虫激发宿主免疫应答的初步研究*
2014-11-10汤新明索静霞田秀玲刘贤勇
汤新明 秦 梅 索静霞 田秀玲 刘贤勇 索 勋
(中国农业大学动物医学院,北京 100193)
和缓艾美耳球虫Eimeriamitis是7种鸡球虫中常见的一种,致病力较弱,容易被忽视,但其繁殖力较强,大剂量感染后可引起肠道严重炎性反应,损伤肠上皮细胞,诱发和加剧其他病原如沙门氏菌等的继发感染 (索勋等, 1998; Williams, 2001)。因此,了解和缓艾美耳球虫激发宿主免疫应答的特点和规律对于防控和缓艾美耳球虫病及降低由该病引发的其他损失如病原的继发感染,提高饲料转化率等至关重要。
鸡球虫免疫研究以柔嫩艾美耳球虫E.tenella与巨型艾美耳球虫E.maxima居多。柔嫩艾美耳球虫和巨型艾美耳球虫免疫原性强,能激发宿主较强的体液免疫应答和细胞免疫应答 (Huangetal., 2011; Renetal., 2014)。目前认为,细胞免疫应答是机体抵抗球虫再次感染的保护性免疫应答的作用机制,抗体在抗球虫感染中的作用存在争议 (Pierceetal., 1965; Roseetal., 1971; Lillehojetal., 2000)。鸡球虫不同种间的免疫原性差别很大,巨型艾美耳球虫免疫原性最强,口服接种1个或几个卵囊就可以产生对同种球虫再次感染的保护力,但是,巨型艾美耳球虫对不同株间的交叉免疫保护又非常弱,这也是巨型艾美耳球虫免疫的特点之一 (Swinkelsetal., 2009);柔嫩艾美耳球虫不同虫株间的免疫保护效果良好 (Chapmanetal., 2013)。上述研究结果表明,不同种球虫间的免疫有其共性,每个种又有着其自身的特点和规律。因此,研究和缓艾美耳球虫激发宿主免疫应答的特点和规律,为防控该病提供理论依据,需以和缓艾美耳球虫为研究对象。
关于和缓艾美耳球虫免疫原性及免疫应答规律的认识差异很大,有人认为和缓艾美耳球虫免疫原性极弱,只有经过多次免疫才能建立对和缓艾美耳球虫再次感染的免疫力 (Tyzzer, 1929; Fitz-Coy, 1980);有人认为和缓艾美耳球虫免疫原性良好,鸡群免疫1次或2次就能建立坚强的免疫力 (赵爱云等, 2006)。同样是和缓艾美耳球虫,免疫原性出现如此差异,可能与研究时选用不同虫株有关,本研究以实验室分离的和缓艾美耳球虫涿州株为研究对象,研究其免疫原性及激发宿主免疫应答的特征,初步揭示宿主抵抗和缓艾美耳球虫感染的机制,为后续球虫免疫学研究奠定基础。
1 材料与方法
1.1 实验动物与虫株
1.1.1 虫株:和缓艾美耳球虫涿州株,由本实验室分离和保存。
1.1.2 实验动物:1日龄AA肉鸡购自北京华都肉鸡有限公司,饲养于无球虫污染的禽用隔离器(IPQ-3型,苏州市苏杭实验动物设备厂)中,自由采食、饮水。
1.1.3 主要试剂:Chicken IgG(IgY)-Fc Fragment antibody (Bethyl Laboratories, Inc),TMB (A+B)(迈晨科技),人淋巴细胞分离管、Lympho-SpotTM无血清培养基、链霉亲和素-辣根过氧化物酶标记的抗体、AEC显色液(深圳达科为生物技术有限公司),96孔ELISPOT板(Millipore),生物素标记的检测抗体(1 μg/mL,CHICKEN IFN GAMMA CYTOSET,Invitrogen)等。
1.2 免疫实验设计
免疫程序见实验设计(图1)。简言之,12只7日龄AA肉鸡随机分为2组,免疫组以1 000卵囊/羽剂量(200 μL)进行口服免疫,对照组口服免疫200 μL PBS;第2次免疫于初免后14 d进行,免疫剂量为10 000卵囊/羽。
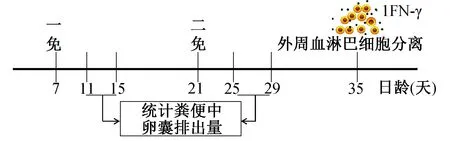
图1 试验设计Fig.1 The experimental schedule
1.3 卵囊排出量统计
粪便中卵囊含量检测依据参考文献(Yanetal., 2009)。初免和二免后5~8 d粪便,充分混匀后称重,利用麦克马斯特法计算克粪便卵囊数(OPG)后计算卵囊排出量。每份样品重复3次。
1.4 酶联免疫吸附试验(ELISA)
ELISA相关操作依据参考文献 (Huangetal., 2011)。球虫全虫抗原5 μg/mL 4℃过夜包被;5%脱脂乳37℃封闭1 h;鸡群一免和二免14 d后血清1∶100稀释作为一抗,37℃孵育1 h;Chicken IgG(IgY)-Fc Fragment antibody 1∶10 000稀释作为二抗,37℃孵育1 h(上述各操作均需PBST洗涤5次);TMB (A+B) 显色10 min,2 mol/L H2SO4终止显色后置于酶标仪(BIO-RAD)中,450 nm波长读取OD值。
1.5 外周血单核淋巴细胞(PBMC)的分离
鸡外周血单核淋巴细胞的分离依据人淋巴细胞分离管的操作说明。无菌静脉采集二免后2周鸡外周抗凝血5 mL,加入分离管,20℃,800 g,离心15 min,吸取淋巴细胞层(血浆层下,白色薄层),加入10 mL 1640培养基洗涤一次,Lympho-SpotTM无血清培养基重悬细胞。取50 μL细胞悬液,台盼蓝染色,活细胞计数后用于ELISPOT检测。
1.6 酶联免疫斑点试验(ELISPOT)
ELISPOT相关操作依据参考文献 (Yinetal., 2013)。96孔ELISPOT板(Millipore)甲醇预湿后, 5 μg/mL鸡IFN-γ包被抗体4℃过夜包被;1% BSA室温封闭2 h;每孔加106PBMC后,分别加入10 μL PBS置于37℃、10 μL球虫全虫抗原(5 μg/mL)、10 μl PMA+离子霉素(2.5 ng/mL + 1.25 μg/mL),5% CO2细胞培养箱刺激24 h(期间切勿移动培养板);迅速倒掉孔内细胞,加200 μL冷水裂解细胞10 min;加入100 μL生物素标记的检测抗体,37℃孵育2 h;加入100 μL链霉亲和素-辣根过氧化物酶标记的抗体(2 μg/mL,ALL-IN-ONE mouse ELISPOT Accessory kit),37℃孵育1 h(上述各操作均需PBST洗涤8次);加入100 μL AEC显色液(ALL-IN-ONE mouse ELISPOT Accessory kit)进行显色,室温避光孵育30 min;去离子水洗涤2次,室温风干,用ELISPOT读数仪(Bioreader 4000; Bio-sys, Germany)进行读数。
1.7 数据处理与统计学分析
本研究所有数据均采用GraphPad Prism 5软件进行处理,差异显著性分析采用IBM SPSS Statistics 20软件中单因素ANOVA分析,P<0.05认为差异显著,P<0.01认为差异极显著。
2 结果
2.1 和缓艾美耳球虫免疫原性的研究
本研究检测了初免及二免后鸡群的卵囊产量以评估和缓艾美耳球虫的免疫原性。结果显示,1 000卵囊/羽免疫后每只鸡的卵囊产量约1×107,14 d后免疫剂量提高10倍(即10 000卵囊/羽),但每只鸡的卵囊排出仅为5×105(图2)。与初次免疫相比,再次免疫后的卵囊排出量显著降低。
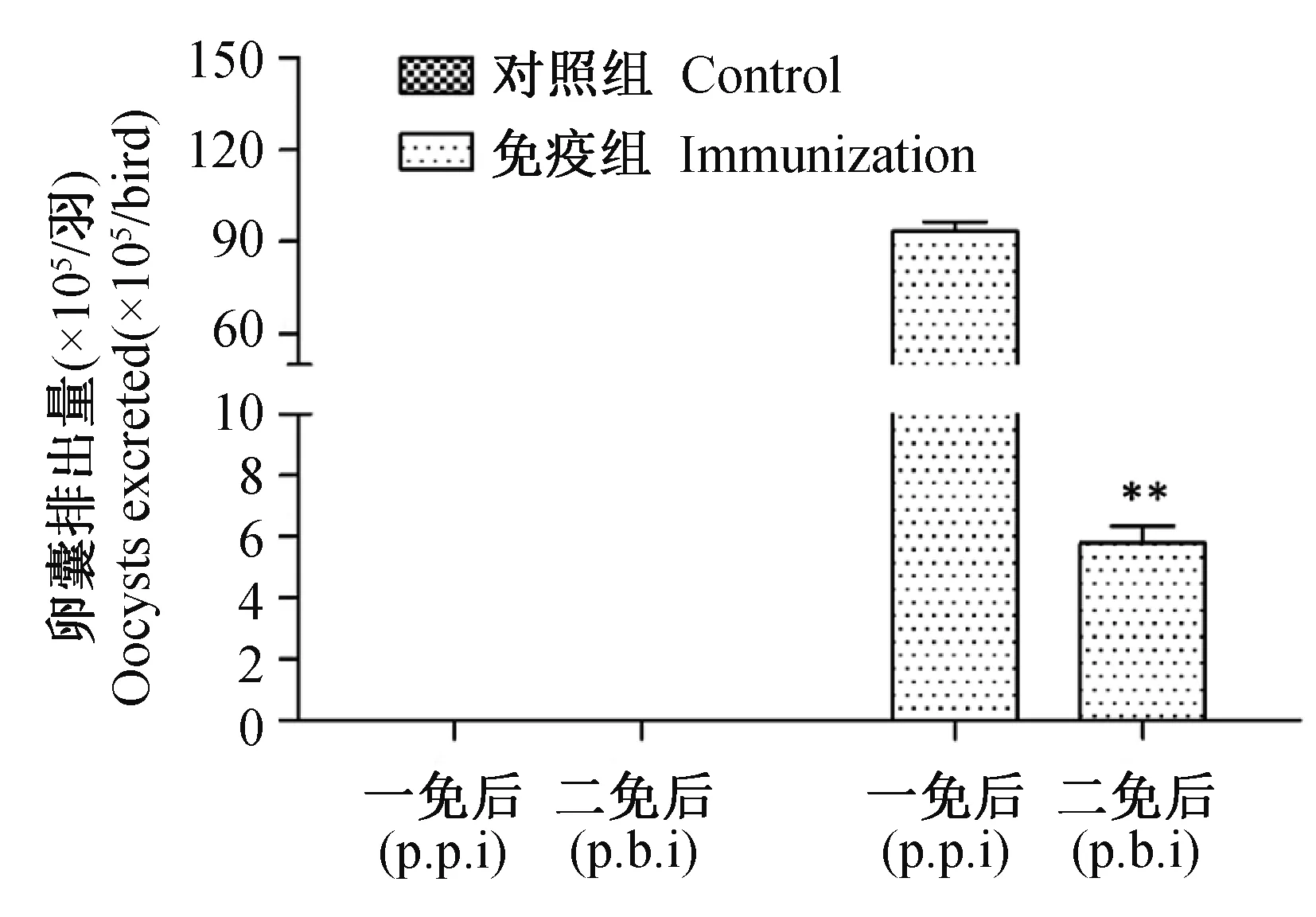
图2 一次免疫和二次免疫后的卵囊排出量Fig.2 The oocysts output of each bird post primary and boost immunization 5-8 days.p.p.i : 一次免疫;p.b.i: 二次免疫;** P<0.01。p.p.i : Post primary immunization; p.b.i: Post boost immunization. ** P<0.01. The same below.
2.2 和缓艾美耳球虫激发宿主体液免疫应答的特征
球虫感染一般能激发宿主较高水平的抗体反应,即使抗体在抗球虫感染中的作用存在争议,检测球虫激发宿主特异性抗体的水平仍能部分反应体液免疫应答在抗球虫感染中的作用强度。本研究检测了初免和二免后14 d血清中球虫特异性IgY抗体的水平,发现一次免疫几乎不能激发宿主特异性抗体的产生(OD值<0.5);二次免疫后,虽然免疫组OD值显著高于对照组,但血清抗体水平的绝对值(OD值约为1.1)仍保持较低水平(图3)。
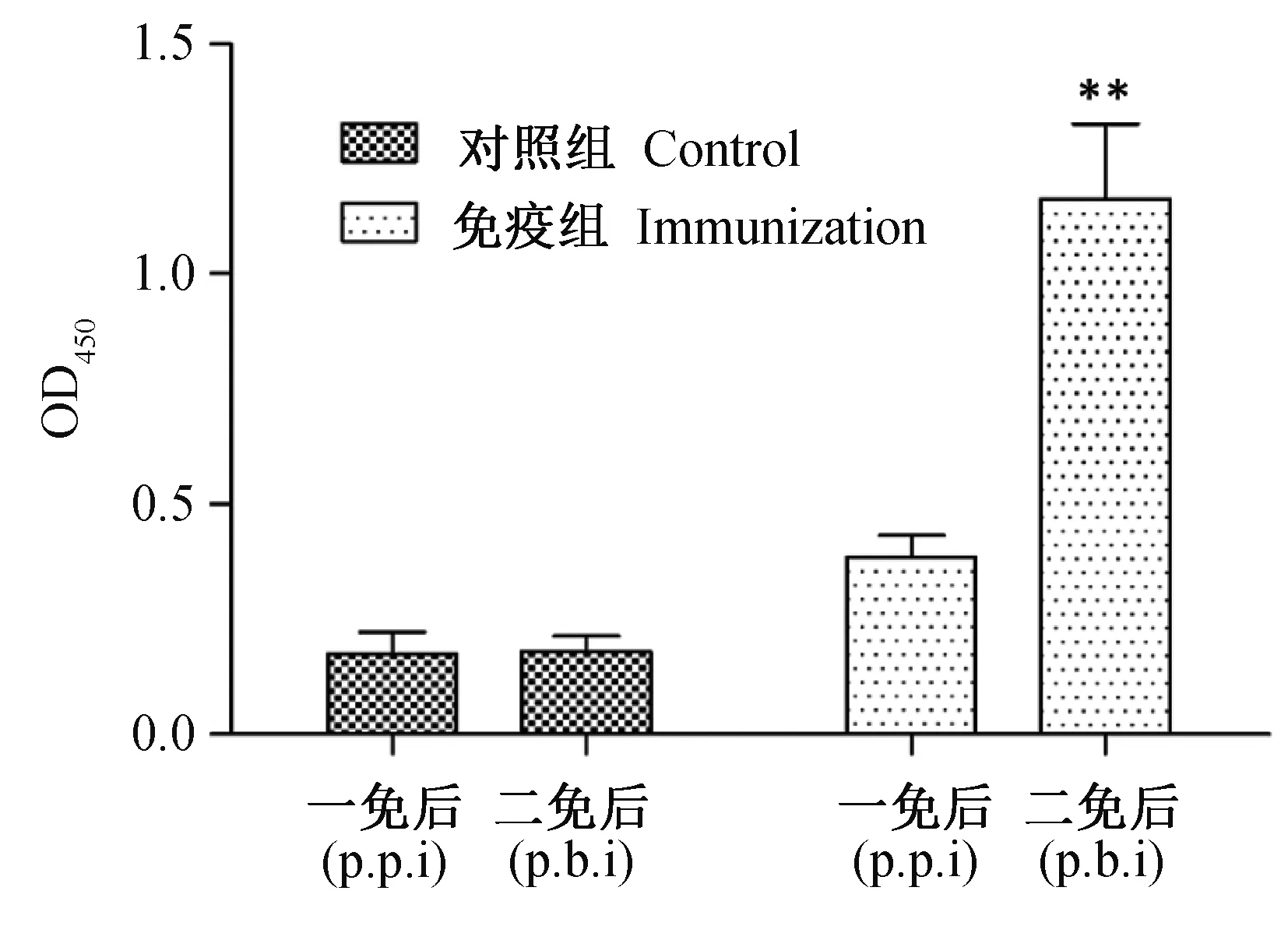
图3 一次免疫(p.p.i)和二次免疫(p.b.i)后鸡群血清中特异性IgY抗体的水平Fig. 3 Serum IgY titer post both primary and boost immunization with E. mitis
2.3 和缓艾美耳球虫激发宿主细胞免疫应答的特征
IFN-γ的分泌是T细胞活化的标志之一,特异性抗原刺激下T细胞活化的数目是反映针对该抗原细胞免疫应答强度的重要指征 (Yinetal., 2013)。本研究利用ELISPOT技术检测鸡群免疫后外周血淋巴细胞在球虫特异性抗原刺激下,分泌IFN-γ淋巴细胞的数量,反映球虫激发宿主细胞免疫应答的强度。结果显示,免疫后鸡群外周血分泌IFN-γ特异性淋巴细胞的数量约为80,而未免疫组的6只鸡中,只有2只检测到数量极少的斑点(分别检测到3个斑点、9个斑点)(图4),说明和缓艾美耳球虫免疫后,外周血中特异性淋巴细胞大量增殖,反映出和缓艾美耳球虫能够激发宿主较强的细胞免疫应答。
3 讨论
本研究中,免疫鸡群后卵囊排出量显示了和缓艾美耳球虫涿州株具备良好的免疫原性,且和缓艾美耳能激发宿主产生较低水平的血清抗体及较强的细胞免疫应答,初步揭示和缓艾美耳球虫具备良好免疫原性的基础是由于其激发较强的细胞免疫应答。

图4 二次免疫后外周血淋巴细胞中特异性分泌IFN-γ淋巴细胞的数量Fig. 4 IFN-γ secretion cell population in PBMCs post the 2nd immunization with E. mitis 14 days第2次免疫后14 d,分离鸡外周血淋巴细胞培养,PBS、和缓艾美耳球虫全虫抗原、PMA+离子霉素刺激24小时后(A、B、C)检测IFN-γ的分泌水平(左侧为免疫组,右侧为对照组)。各试验组随机选取6只鸡进行IFN-γ分泌水平的检测,D图示各组IFN-γ分泌水平的平均值。IFN-γsecretion cell population in PBMCs post the second immunization with E. mitis 14 days was detected by ELISPOT. The IFN-γsecretion was detected followed by stimulated with PBS, E. mitis antigen and PMA (A, B and C, respectively) about 24 h. D. The average spots of each group was obtained from 6 birds.
和缓艾美耳球虫激发宿主细胞免疫应答的水平个体间存在差异的可能原因有两方面,一是本研究中使用的实验动物模型是AA肉鸡,属远交系群体,个体差异较大,对病原感染的反应性差异也较大(Zhouetal., 2010);二是IFN-γ的分泌水平只能部分反应细胞免疫应答的强度,即从免疫应答的量来反应细胞免疫应答水平,而免疫应答的质(如多功能T细胞的数量)往往是保护性免疫应答的决定因素,这可能出现IFN-γ分泌较少但IFN-γ+TNF-α+IL2+T细胞的比例、T细胞的增殖能力和对免疫应答的调控能力(通过分泌趋化因子)、CTL细胞的杀伤能力以及中和抗体的亲和力等较高的群体免疫保护力反而较高(Sederetal., 2008)。因此,深入研究球虫激发宿主保护性免疫应答的全貌应综合分析其激发宿主免疫应答的量和质(Sederetal., 2008)。
和缓艾美耳球虫具备良好的免疫原性,能激发宿主较强的细胞免疫应答,但其激发宿主细胞免疫应答的强度低于柔嫩艾美耳球虫。同等剂量、相同的免疫程序,柔嫩艾美耳球虫二免后每106外周血单核细胞中分泌IFN-γ特异性淋巴细胞的数量为120左右(Yinetal., 2013),而和缓艾美耳球虫为80左右(图4-D)。可能的解释是,柔嫩艾美耳球虫寄生于盲肠,感染时能大量招募盲肠扁桃体内的淋巴细胞,球虫抗原能迅速被识别和递呈至机体免疫系统,继而激发宿主较强的细胞免疫应答(Chapmanetal., 2013),而和缓艾美耳球虫裂殖生殖主要在小肠后段进行,第3代裂殖生殖和配子生殖亦在盲肠部位进行,小肠后段淋巴组织分布相对较少(McDonaldetal., 1984; Novillaetal., 1987)盲肠扁桃体识别对和缓艾美耳球虫进行抗原识别与递呈局限于裂殖生殖后期与配子生殖,故激发的免疫应答相对较弱。
本研究初步揭示了和缓艾美耳球虫激发宿主适应性免疫应答的特征,为解释其具备良好免疫原性及研究宿主抗和缓艾美耳球虫感染的机制奠定了基础。同样,和缓艾美耳球虫作为球虫病疫苗的组分之一,尚需深入研究其激发宿主免疫应答的全貌,进一步揭示球虫病疫苗提供坚强保护免疫应答的机理。
