小肠间质瘤45例诊治分析
2014-11-05曾艳梁浩
曾艳,梁浩
小肠间质瘤(small intestinal stromal tumors,SIST)是原发于小肠的胃肠道间质瘤(gastrointestinal stromal tumors,GIST),占GIST的20%~30%。SIST作为GIST的第二好发部位,恶性程度最高,预后最差,但往往因缺乏特异性临床症状和体征而漏诊或误诊[1]。本文分析了45例SIST的临床资料,以期提高对该病的认识及诊治水平。
1 资料与方法
1.1 研究对象 回顾性分析解放军总医院消化科2007年7月-2013年12月收治的经病理组织学证实的45例SIST患者的临床资料。对患者的临床症状、影像学检查、内镜检查、手术病理结果及治疗和预后进行总结和对比分析。入选患者影像学检查包括腹部B超、螺旋CT等;内镜检查包括胃镜(十二指肠镜)、胶囊内镜、双气囊小肠镜等。
1.2 病理诊断标准 依据Fletcher危险度分级对SIST生物学行为进行评价,分为极低度、低度、中度及高度危险4级,生物学危险分级与生存率等预后指标有良好的相关性[2]。根据病灶最大径及核分裂象,SIST生物学危险分级如下:①极低度危险:肿块最大径<2cm、核分裂象<5/50个高倍视野;②低度危险:肿块最大径2~5cm、核分裂象<5/50个高倍视野;③中度危险:肿块最大径5~10cm、核分裂象<5/50个高倍视野或最大直径<5cm、核分裂象(6~10)/50个高倍视野;④高度危险:肿块最大径>5cm、核分裂象>5/50个高倍视野或肿块最大径>10cm、任何核分裂计数或肿块任何大小、核分裂象>10/50个高倍视野。
1.3 统计学处理 采用SPSS 20.0软件进行统计分析,不同辅助检查对SIST的诊断符合率行R×C χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 上述经病理诊断的45例SIST患者中,男25例,女20例,平均发病年龄51(25~85)岁。
2.2 临床症状 45例患者中以消化道出血为首发症状就诊者29例(64.4%),其中黑便18例,血便2例,仅大便潜血阳性9例。其他表现包括腹痛15例(33.3%),恶心呕吐2例(4.4%),腹腔肿块4例(8.9%),另有1例(2.2%)因体检发现小肠占位而就诊。
2.3 影像学检查 35例行腹部B超检查,6例提示SIST,13例提示腹腔或盆腔低回声占位或实质肿块,1例未发现原发病灶仅提示肝转移,表现为肝内类圆形的略低密度灶,增强后可见环形强化。38例行螺旋CT检查,28例提示SIST,9例提示小肠占位,1例提示小肠系膜扭转。
2.4 内镜检查 40例行胃镜(十二指肠镜)检查,13例直接提示间质瘤,且间质瘤均位于十二指肠,多数靠近十二指肠降部,表现为表面有糜烂或溃疡灶的隆起病变;另有5例诊断为上消化道溃疡。10例行胶囊内镜检查,提示占位性病变5例(其中考虑间质瘤4例),局部黏膜隆起3例,局部黏膜糜烂1例,另见血管畸形伴出血1例。行经口或经肛双气囊小肠镜检查者共5例,4例提示有占位性病变(其中考虑间质瘤3例),其表面有黏膜溃疡者2例、黏膜糜烂者2例。多种影像学、内镜检查方法对SIST的诊断符合率见表1。螺旋CT与腹部B超、胃镜检查之间差异有统计学意义(P<0.05),提示各项检查方法中,螺旋CT对SIST的诊断最有价值,而胶囊内镜和双气囊小肠镜可能因例数太少而导致无统计学差异。
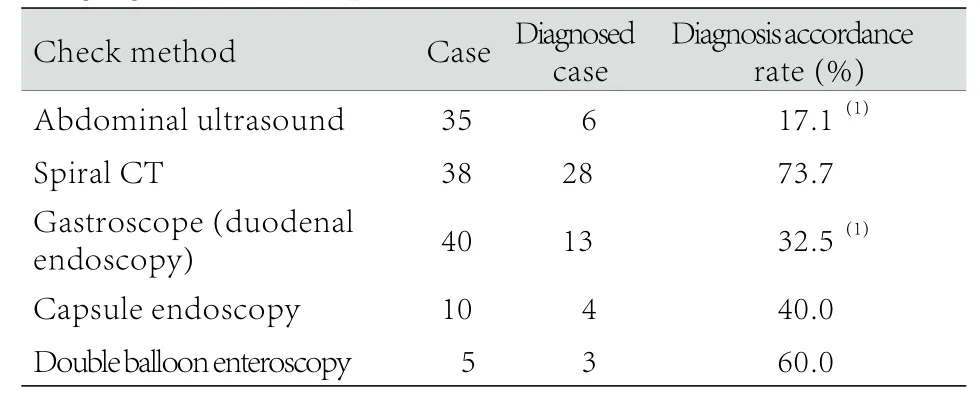
表1 各种影像学及内镜检查对SIST的诊断符合率Tab.1 Diagnosis accordance rate of SIST with different imaging and endoscopic examinations
2.5 病理及免疫组化结果 45例患者均接受手术治疗。肿瘤发生部位:空肠21例(46.7%),十二指肠13例(28.9%),回肠9例(20.0%),空回肠交界2例(4.4%)。36例(80.0%)病灶完整切除,术后经病理证实切缘为阴性,其他9例(20.0%)行姑息性手术。无围术期死亡。术后免疫组织化学染色结果显示酪氨酸激酶受体(CD117)阳性率100%(45/45),造血干细胞抗原(CD34)阳性率67%(30/45)。依据Fletcher危险度分级对SIST生物学行为进行评价,极低度危险6例(13.3%),低度危险16例(35.6%),中度危险8例(17.8%),高度危险15例(33.3%,表2)。其中行姑息性手术的患者中,中度危险2例(此2例术后均发生复发或远处转移),高度危险7例(有5例术后发生复发或远处转移)。
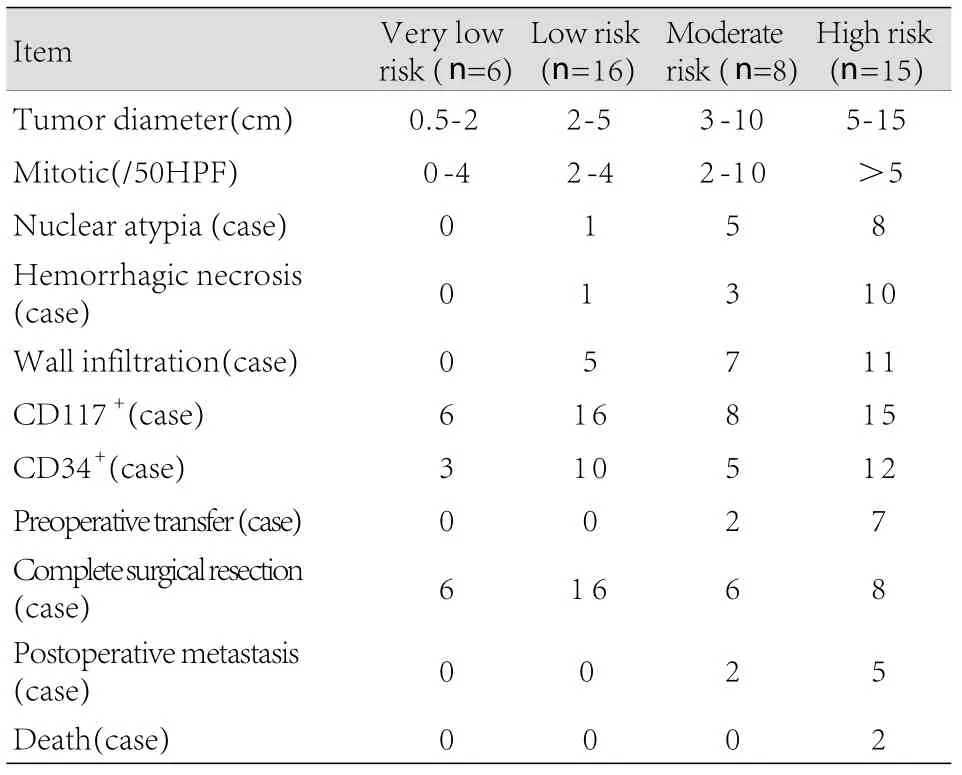
表2 45例小肠间质瘤病理及随访结果Tab.2 Pathology and follow-up results of 45 cases of SIST
2.6 治疗随访及预后 随访时间为3个月~3年。术后6例病灶完整切除且极低度危险患者未口服甲磺酸伊马替尼治疗,随访3年未见复发,其余39例患者均口服甲磺酸伊马替尼治疗。术后口服伊马替尼治疗的患者中,32例未见复发转移,均获得3年存活,其中2例发生耐药,改用舒尼替尼后肿瘤得到控制。7例发生复发转移,其中4例行再次手术,均获3年存活;3例发生伊马替尼耐药,2例未继续治疗,病情恶化死亡,1例改用舒尼替尼治疗,肿瘤得到控制,带瘤生存。复发转移发生在1年内3例、2年内3例、3年内1例。服药后有4例出现发热、呕吐、头痛、下肢水肿等不良反应,但均可耐受。本组患者病理及随访结果见表2。
3 讨 论
GIST原发于消化道, 表 达c-kit蛋白(CD117),肿瘤细胞呈梭形、上皮样或多形性[3-4],是胃肠道最常见的间叶源性肿瘤[5-6],胃(60%~70%)和小肠(20%~30%)是其好发部位。SIST发病部位分布比例由高到低依次是空肠、十二指肠、回肠,本组病例中分别占46.7%、28.9%和20.0%。SIST发病无明显性别差异,中位发病年龄为50~60岁,低于胃间质瘤(中位发病年龄为63岁)。本组病例的一般资料特征符合文献报道[7]。由于GIST既非神经源性也非平滑肌源性,以往常被诊断为平滑肌瘤。
SIST的临床症状缺乏特异性,主要与肿瘤的大小、部位、肿瘤与胃肠壁的关系及肿瘤的良恶性有关。肿瘤较小者常无症状,往往在癌症普查和其他手术时无意中发现,肿瘤较大者则可引起腹痛、黑便、腹部包块、恶心呕吐、贫血、小肠梗阻等临床症状[8]。本组病例中以消化道出血为首发症状的共29例(64.4%),多表现为黑便或大便潜血阳性,出血量大时可伴有乏力、头晕、晕厥。其次为腹痛15例(33.3%),多因肿瘤破裂、肠梗阻等原因引起,严重时须急诊手术。此外,恶心呕吐、腹腔肿块等也是患者常见的就诊原因。
SIST的诊断主要借助于器械检查和病理诊断。器械检查主要包括B超、CT、胃肠镜、双气囊小肠镜、胶囊内镜等。各诊断方法对SIST的阳性检出率与瘤体的生长部位、大小及生长方式有关。胃镜是检查生长于十二指肠降段及部分水平段间质瘤的首选方法[9],但对于其他部位的SIST无效,因而其检出率较低(32.5%)。对于生长于空回肠的肿瘤可通过双气囊小肠镜、胶囊内镜等方法进行检查。胶囊内镜是一项小肠无创检查方法,较为安全但费用较高。由于胶囊在肠道内不可控,易受肠道内情况干扰,而且不能在有异常处反复检查及取活检,故对单独存在的较小病灶诊断能力有限。本文中胶囊内镜检出率为40.0%,目前只是作为一种无创性筛查手段。双气囊小肠镜具有可控制性好、可反复观察、视野广、图像清晰、可行镜下活检及治疗、安全性高等突出特点,是目前临床上诊断小肠黏膜和(或)黏膜下肿瘤的常用方法[10-11],本文中检出率为60.0%。在影像学检查中,腹部彩超受到分辨率、胃肠道内气液体干扰等影响,检出率及诊断符合率不高(17.2%)。增强螺旋CT对诊断SIST尤其是内镜不易发现的SIST具有特定优势,无创且操作方便,诊断符合率高,本组资料螺旋CT的检出率高达73.7%。CT能清晰地显示间质瘤的形态、大小、包膜有无出血坏死等,同时还可了解肿瘤与周围脏器的联系,判断有无腹腔、肝脏转移,且检查时间短,无痛苦,重病人亦可耐受,能较快获取结果。CT对于黏膜下或肠腔内小病灶有可能漏诊,有时肿瘤与腺癌及淋巴瘤难以鉴别,应结合消化内镜检查,提高诊断水平。
SIST的最终确诊主要依靠病理,诊断间质瘤的免疫组织化学标记物主要是CD117和CD34,80%~100%的间质瘤CD117呈弥漫性表达,少数间质瘤不表达,以胃来源的间质瘤多见,组织学上以上皮样细胞型多见。60%~80%的间质瘤CD34呈弥漫阳性表达,食管和直肠间质瘤阳性率最高,达100%,胃次之,为80%以上,小肠最低,仅为40%左右[12-13]。本组病例中CD117阳性率达100%(45/45),CD43阳性率67%(30/45)。间质瘤的生物学行为不能以简单的良恶性来评定,目前的趋势认为所有间质瘤均有潜在恶性倾向,故应分为恶性潜能低或高的肿瘤或危险程度低或高的肿瘤[14]。影响其生物学行为或危险指数的因素很多,较公认的是肿瘤大小和核分裂象计数,此外应适当参考肿瘤的生长方式、有无坏死、细胞的异型性、组织结构、有无黏膜浸润、有无溃疡及其他分子生物学指标等[15]。本组45例SIST患者中,中高度危险性的SIST为23例,低度和极低危险性的为22例。中高度危险性的SIST与较低度危险性的SIST比较病理结果具有明显异型性(13/23 vs 1/22),术前转移率较高(9/23 vs 0),手术完全切除率较低(14/23 vs 22/22),术后转移率高(7/23 vs 0)。
目前SIST的治疗方法主要是手术切除和分子靶向治疗。对于未发生转移的可切除的SIST,外科手术是最主要的治疗方法[16]。中国SIST诊断治疗共识(2011年)[17]对手术适应证等作了明确阐述。本组45例患者均接受了手术治疗,其中36例(80.0%)病灶完整切除,9例(20%)行姑息性手术,姑息性手术患者中有7例发生复发或远处转移,其中4例再次手术患者均获得3年存活。术后6例病灶完整切除的极低度危险性患者未口服甲磺酸伊马替尼治疗,其余39例患者均口服甲磺酸伊马替尼治疗。伊马替尼作为选择性kit/PDGFRA受体酪氨酸激酶抑制剂,用于治疗不能切除和(或)发生转移的恶性胃肠道间质肿瘤的成人患者,以及部分高度危险性病例的术后预防性化疗获得了广泛认可,并且被认为是肿瘤分子靶向治疗的典范[18],可减少术后复发和转移。对于瘤体较大无法手术的患者,先应用伊马替尼治疗可缩小肿瘤体积,增加手术切除的成功率[19]。
SIST的术后复发及转移率较高,研究表明影响复发转移的因素主要是恶性程度、肿瘤大小、部位、核分裂、手术切除是否完全等[20],本组中高度危险性患者的术后复发及转移率达30.4%(7/23),而低度危险性患者的术后复发及转移率为0。文献报道胃肠道间质瘤常在术后1年内复发,部分于术后10余年复发[21]。因此所有SIST患者均应加强术后长期随访。手术联合分子靶向治疗的新模式可提高SIST患者的生存率。
[1]Zhang LF, Han QL, Wang N, et al. Comparative analysis between the ultrasonic picture and pathology of small intestinal stroma l tumors[J]. Med J Chin PLA, 2009, 34(3): 342-344. [张龙方, 韩全利, 汪娜, 等. 小肠间质瘤的超声表现及病理特征[J]. 解放军医学杂志, 2009, 34(3): 342-344.]
[2]Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach[J]. Ham Pathol, 2002, 33(5): 459-465.
[3]Schubert ML, Moghimi R. Gastrointestinal stromal tumor(GIST)[J]. Curr Treat Options Gastroenterol, 2006, 9(2): 181-188.
[4]Wu S, Zhang XF, Zhao CL, et al. Relationship between the expressions of Ki-67, Cyclin D1, Livin, ICAM-1, MMP-9 and Fletcher's classification in gastrointestinal stromal tumors[J]. J Zhengzhou Univ (Med Sci), 2011, 46(6): 895-897. [务森, 张谢夫, 赵春临, 等. 胃肠道间质瘤组织中Ki-67、Cyclin D1、ICAM-1、Livin 及MMP-9 蛋白表达与危险度分级[J]. 郑州大学学报(医学版), 2011, 46(6): 895-897.]
[5]Chen J, Gundara JS, Haddad R, et al. Clinicopathological and molecular aspects of foregut gastrointestinal stromal turnouts[J]. ANZ J Surg, 2014, 84(1-2): 52-58.
[6]Jiang ZM, Cheng YH, Wang SY. Expression and clinical significance of adhesion molecule L1 in gastrointestinal stroma l tumors[J]. Tianjin Med J, 2012, 40(8): 784-787. [姜忠敏, 成元华, 王淑妍. 黏附分子L1在胃肠道间质瘤中的表达及其临床意义[J]. 天津医药, 2012, 40(8): 784-787.]
[7]Miettinen M, Sobin LH, Lasota J. Gastminteatinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term followup[J]. Am J Surg Pathol, 2005, 29(1): 52-68.
[8]Miettinen M, Makhlouf H, Sobin LH, et al. Gastrointestinal stromal tumors of the jejunum and ileum: a clinieopathologic,immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up[J]. Am J Surg Pathol,2006, 30(4): 477-489.
[9]Tan WY, Zhu LR. Diagnosis and treatment of gastrointestinal stromal tumors: experience in 110 patients[J]. Chin J Dig, 2009 ,29(12): 811-815. [谭婉燕, 朱良如. 胃肠道间质瘤110例临床诊治分析[J]. 中华消化杂志, 2009, 29(12): 811-815.]
[10]Zhong J, Ma T, Zhang C, et al. A retrospective study of the application on double balloon enteroscopy in 378 patients with suspected small bowel diseases[J]. Endoscopy, 2007, 39(3):208-215.
[11]Li ZS. Status quo and future of gastrointestinal endoscopy in China[J]. Med J Chin PLA, 2010, 35(1): 5-8. [李兆申. 中国消化内镜现状及展望[J]. 解放军医学杂志, 2010, 35(1): 5-8.]
[12]Qian Z, Su QJ, Sun XT. Clinical and pathological analysis of immune expression of GIST[J]. Clin J Med Officer, 2010, 38(4):632-634. [钱震, 苏勤军, 孙晓彤. 胃肠道间质瘤免疫表达的临床病理分析[J]. 临床军医杂志, 2010, 38 (4): 632-634.]
[13]He G, Xiao JY. Analysis of CT and spiral endoscopic findings in patients with gastrointestinal stromal tumor[J]. Tianjin Med J,2011, 39(12): 1127-1129. [何刚, 肖健宇. 胃肠间质瘤的CT和内镜表现分析[J]. 天津医药, 2011, 39(12): 1127-1129.]
[14]Von Mehren M. New therapeutic strategies for soft tissue sarcomas[J]. Curr Treat Options Oncol, 2003, 4(6): 441-451.
[15]Hui YZ. Gastrointestinal pathology[M]. 3rd ed. Beijing: Peking University Medical Press, 2011. 1268-1283. [回允中译. 胃肠病理学[M]. 3版. 北京: 北京大学医学出版社, 2011. 1268-1283.]
[16]Theodoropoulos GE, Linardoutsos D, Tsamis D, et al.Gastrointestinal stromal tumor causing small bowel intussusception in a patient with Crohns disease[J]. World J Gastroenterol, 2009, 15(41): 5224-5227.
[17]China CSCO Inter-Committee of Experts on GIST. Diagnosis and treatment of Chinese expert of GIST (2011 Edition)[J].Chin J Gastrointestinal Surg, 2012, 15(3): 301-307. [中国CSCO胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗专家共识(2011年版)[J].中华胃肠外科杂志, 2012, 15(3): 301-307.]
[18]Wang M, Cao H. GIST progress neoadjuvant therapy of imatini[J]. Chin J Dig Surg, 2011, 10(1): 79-80.[汪明, 曹晖. 伊马替尼新辅助治疗胃肠道间质瘤进展[J]. 中华消化外科杂志, 2011, 10(1): 79-80.]
[19]Machairas A, Karamitopoulou E, Tsapralis D, et al.Gastrointestinal stromal tumors (GIST): an updated experience[J]. Dig Dis Sci, 2010, 55(12): 3315-3327.
[20]Zhang Q, Bi JJ, Zhou JG, et al. Analysis of prognostic factors of SIST[J]. Chin J Med, 2012,47(2): 66-69. [张骞, 毕建军, 周健国,等. 原发小肠间质瘤的预后影响因素分析[J]. 中国医刊,2012, 47(2): 66-69.]
[21]Shi YQ, Du CY. Prevention of recurrence of GIST[J]. Cancer Res Clin, 2006, 18(8): 527-529. [师英强, 杜春燕. 预防胃肠道间质瘤的复发转移[J]. 肿瘤研究与临床, 2006, 18(8): 527-529.]
