多器官功能障碍综合征小鼠血清多种细胞因子含量变化及其与病程进展的关系
2014-11-05吕艺刘茜赵敏陆江阳
吕艺,刘茜,赵敏,陆江阳
多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)是脓毒症晚期的重要死亡原因,尽管近20年来已有数十种拮抗致炎因子的药物进入临床试验性治疗阶段,但疗效远不如动物实验中显示的效果理想[1-3],表明上述抗炎措施的靶向性或使用时机还存在偏差[4-5]。本研究采用酵母多糖腹腔注射的方法制作小鼠MODS模型,探讨MODS病程发展中血清细胞因子含量的变化规律及其与病情进展的关系。
1 材料与方法
1.1 MODS动物模型制作及分组 6~8周龄健康雄性C57BL/6小鼠165只,体重20~25g,购自军事医学科学院实验动物中心。动物适应性饲养7d,昼夜12h交替,标准饲料喂养,自由饮水,实验前12h禁食。小鼠随机分为对照组(n=10)和实验组(n=155),实验组又分为酵母多糖致伤6h(n=15)、12h(n=15)、1d(n=15)、2d(n=30)、5~7d(n=30)、10~12d(n=50)共6个亚组(有效检测数为10只)。酵母多糖诱导MODS模型的制作参照Jansen等[6]的方法。将酵母多糖粉剂(Sigma,美国)1g与医用石蜡油40ml混合制成25g/L酵母多糖混悬液,100℃水浴消毒80min,冷却至室温,小鼠腹部消毒,腹腔注射酵母多糖悬液(800mg/kg)。常规喂养,观察死亡率。
1.2 脏器功能检测 在相应时间点从小鼠眼底动脉取血,肝素抗凝,静置30min,3000r/min离心15min取血浆,在生化自动分析仪上采用酶动力学法检测血浆丙氨酸转氨酶(ALT)、尿素氮(BUN)、肌酐(Cr)和肌酸激酶(CK)的活性或浓度。
1.3 血清细胞因子水平检测 采用ELISA方法测定血清TNF-α、IL-1β、HMGB1、IL-10、IL-12和IL-2浓度,具体操作按照试剂盒说明书进行。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以表示,采用单因素方差分析和LSD-t检验进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 MODS病程不同阶段小鼠的症状、体征和生存率 实验鼠注射酵母多糖后3h出现精神不振、活动和进食减少。12h后症状逐渐加重,表现为精神萎靡、全身发抖、拒绝饮食、腹泻、被毛脏湿、不睁眼且分泌物增加,1~2d出现第一个死亡高峰,死亡率为30.1%。2d后,实验组动物状态逐渐好转,动物逐渐恢复基本生活习性,此期间无死亡发生。5~7d时动物再次出现全身症状,10~12d时症状恶化,出现嗜睡、拒绝饮食及呼吸困难等症状,此期出现第二个死亡高峰,死亡率为21.9%。
2.2 酵母多糖致伤对小鼠脏器功能的影响 酵母多糖致伤12h~2d,小鼠血浆ALT、BUN、Cr和CK水平与正常对照组比较均明显升高(P<0.05),至5~7d基本恢复正常,伤后10~12d时,ALT、BUN和Cr值再次升高(P<0.01,表1)。
表1 酵母多糖致伤小鼠脏器功能变化(±s,n=10)Tab.1 Changes of organ function in zymosan-challenged mice ( , n=10)

表1 酵母多糖致伤小鼠脏器功能变化(±s,n=10)Tab.1 Changes of organ function in zymosan-challenged mice ( , n=10)
(1)P<0.05, (2)P<0.01 compared with NC group
Group ALT(U/L) BUN(mmol/L) Cr(μmol/L) CK(U/L)NC group 39.00±16.14 7.72±2.56 42.67±5.79 317.33±206.19 Experiment group 12h-2d 64.92±7.93 (1) 13.03±2.90 (1) 59.30±6.38 (1) 1040.60±362.5 (1)5-7d 46.67±13.45 5.78±1.45 47.33±7.70 602.55±119.64 10-12d 66.40±21.50 (1) 22.55±3.47 (2) 71.67±7.36 (2) 249.60±106.64
2.3 血清细胞因子含量的变化 正常小鼠血清中TNF浓度很低,酵母多糖注射后6~12h血清TNF浓度大幅升高(P<0.05),1~5d回降至接近正常水平;10d时再次升高(P<0.01),且升高的幅度大于第一次高峰。血清IL-1β含量的变化趋势与TNF一致,但变化幅度小于TNF。IL-10血清浓度在酵母多糖致伤后6h~2d小幅增加(P<0.05),在伤后5d大幅增加(P<0.01),伤后10d仍维持在高水平。HMGB1血清浓度在致伤后逐渐增加,伤后1~2d达峰值,随后一直维持在较高水平。酵母多糖致伤早期血清IL-2浓度未发生明显改变,伤后1~2d明显降低,5d、10d时进一步降低,仅为对照组及伤后早期的1/3。血清中IL-12浓度在伤后1~2d后逐渐降低,伤后10d时仅为对照组的1/2(P<0.01,图1)。
3 讨 论
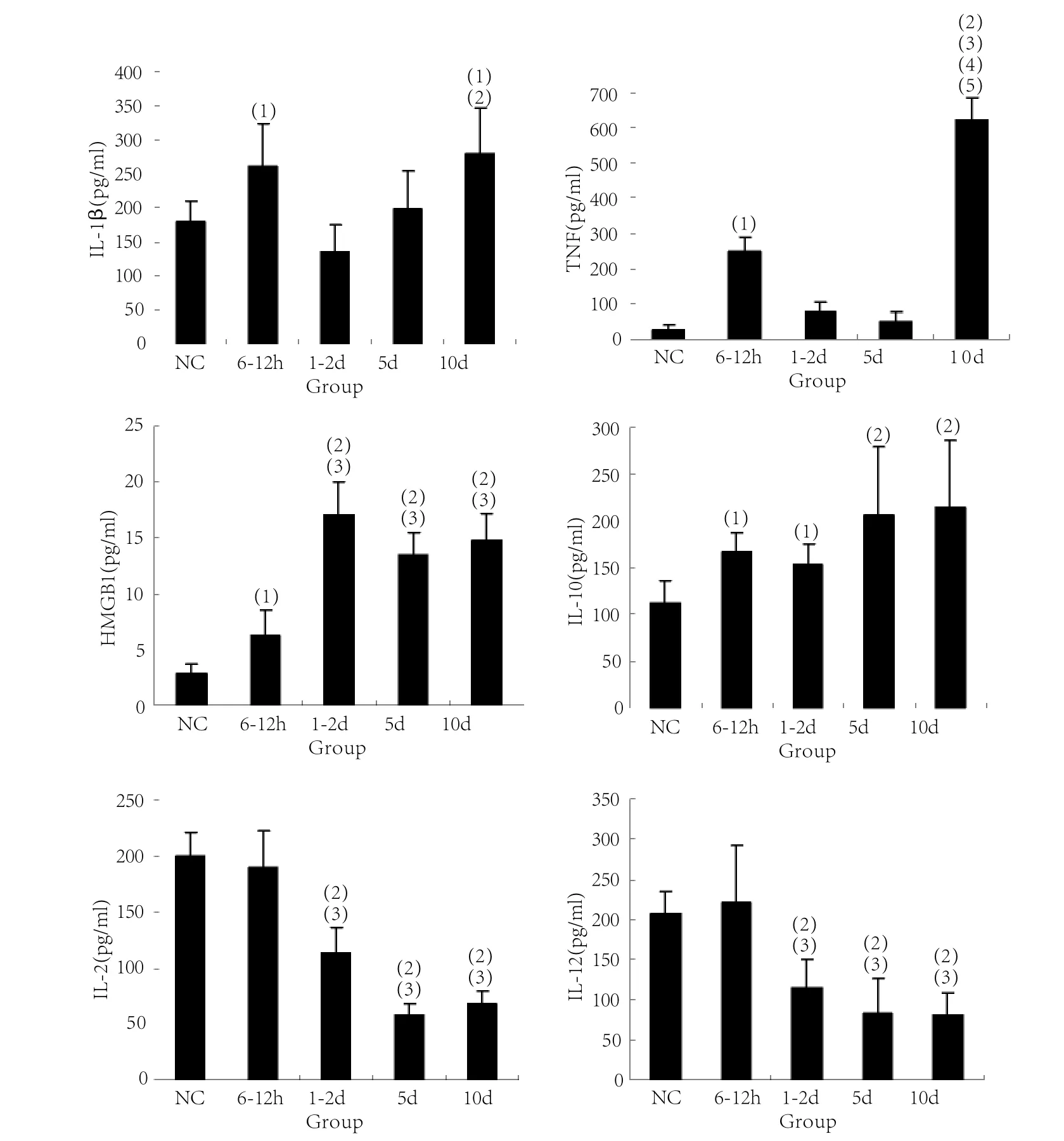
图1 小鼠血清细胞因子含量的变化Fig.1 Changes of serum level of cytokines in rats
脓毒症早期,患者表现出以“细胞因子瀑布”为特征的过度炎症反应[1,7-8],临床治疗手段的进步使多数患者能够度过这一阶段而存活[9-10]。然而,生存者后续发生的非致病菌院内感染及潜在病毒激活往往会加重病情导致死亡[9,11]。动物实验及临床观察均发现,脓毒症/MODS病程发展经历了由早期过度炎症反应状态逐步发展为后期显著的免疫抑制的过程[7,12-15]。由此设想,在脓毒症病程发展过程中,机体损伤及抗损伤力量的不断变化,使针对早期过度炎症反应的防治措施与MODS病程进展阶段不匹配,从而导致抗炎治疗失败甚至加重损伤[16]。因此,对于脓毒症的防治,除了针对病程早期的过度炎症反应和晚期的免疫麻痹状态采取相应的措施外,还应进一步认识脓毒症病情由免疫活化向免疫抑制转变的机制及其过程中的免疫学特点,在病情尚未进入免疫麻痹阶段发现时异常并进行干预,这将有助于降低MODS的病死率。
本研究采用酵母多糖腹腔注射诱发小鼠MODS模型[17],免疫活化/紊乱为关键的致病因素,发病特征与MODS的临床病程进展较为相似[18-19]。在病程发展过程中,血清中多种致炎、抗炎细胞因子含量的变化呈现出早期免疫活化为主、晚期免疫耐受占优势的特征,并与动物的脏器功能损伤及早、晚两个死亡高峰期吻合[20]。结果表明,酵母多糖诱发的MODS,其病程发展的不同阶段病理机制不同。
以往多种针对脓毒症及MODS发病早期炎症介质释放“瀑布效应”的临床治疗手段失败的教训提示我们,根据病程不同阶段免疫紊乱的特征来选择干预靶标是有效防治MODS的前提[1-5]。为此,我们从不同角度选择了多种细胞因子,包括早期致炎因子TNF和IL-1,晚期炎症因子HMGB1、抑炎因子IL-10,以及T细胞活化相关因子IL-2和抗原呈递细胞活性相关因子IL-12[17,21-22]。通过观察血清中这些因子的浓度变化,分析机体在MODS病程不同阶段的免疫学特征。结果发现,在MODS病程进展中这些因子的血清浓度变化呈现序贯性:早期炎症因子TNF和IL-1在酵母多糖致伤后的急性损伤期(6~12h)大幅升高后回落,随即在伤后1~2d HMGB1含量增加,5d后IL-10含量大幅增加,而IL-2和IL-12自伤后1~2d起逐渐降低。结合症状、体征、脏器功能变化及死亡发生高峰可以看出,在病程早期,血清中炎症介质浓度的改变以致炎因子升高为特征;在病程晚期,血清致炎因子TNF和IL-1、晚期炎症因子HMGB1和抑制性因子IL-10同时大幅升高,而T细胞和抗原提呈细胞源性的细胞因子IL-2和IL-12大幅减少。血清中炎症介质的变化特点清晰地反映出机体的免疫功能由过度炎症反应(免疫活化)转化为免疫抑制和活化共存的状态,并与脾脏DC在病程中的免疫活性变化特征一致[23]。
值得注意的是,血清致炎因子TNF和IL-1的高峰出现在病程早期第一个死亡高峰期之前(酵母多糖致伤后6~12h),在死亡高峰的1~2d时两种致炎因子均已接近正常对照值,对应的是血清脓毒症晚期介质HMGB1含量的大幅增加。据此认为,拮抗TNF和IL-1的措施应在伤后6~12h实施,而在伤后1~2d则应采取抗HMGB1的策略,以此降低动物在病程早期的死亡发生率。
本研究中另一个值得重视的现象是,在病程的缓解期(动物无死亡发生),血清HMGB1和IL-10浓度大幅升高,而IL-2和IL-12浓度降低。其中,HMGB1具有免疫抑制效应[24],IL-10可抑制抗原提呈细胞(APC)上共刺激分子的表达[25],从而抑制细胞免疫应答;两者的升高与血清中反映T细胞和抗原提呈细胞活性的IL-2和IL-12的减少相吻合,呈现出典型的免疫抑制的血清学特征,提示缓解期机体致炎反应的减轻并不意味着病情的好转,很可能是转向免疫抑制的潜在信号。而在病程晚期的免疫抑制状况下,致炎因子TNF和IL-1的再次大幅增加提示机体很可能受到内源性菌群移位或条件致病菌感染的打击,这可能是临床上部分度过早期过度炎症反应的生存者最终没有逃脱死亡命运的原因[26]。因此,密切关注血清致炎和抗炎因子含量的变化可以及早地发现病情发展中机体出现的免疫抑制征象,从而及时地进行干预,阻止病情恶化。晚期血清学指标显示出免疫活化与免疫耐受共存的特点,提示在治疗上应采取免疫调节的策略。
综上所述,在酵母多糖腹腔注射诱发的小鼠MODS的发生和发展过程中,血清中多种致炎/抗炎细胞因子含量变化呈现出早期免疫活化为主、晚期免疫耐受占优势的特征,并与病情进展密切相关;动态观察血清细胞因子含量的变化有助于判断机体免疫状态从过度活化向耐受的转化,对及时、有效地干预病情具有重要的理论意义和临床应用价值。
[1]Rittirsch D, Flierl MA, Ward PA. Harmful molecular mechanisms in sepsis[J]. Nat Rev Immunol, 2008, 8(10): 776-787.
[2]Wheeler DS, Zingarelli B, Wheeler WJ, et al. Novel pharmacologic approaches to the management of sepsis: targeting the host inflammatory response[J]. Recent Pat Inflamm Allergy Drug Discov, 2009, 3(2): 96-112.
[3]Sweeney DA, Danner RL, Eichacker PQ, et al. Once is not enough: Clinical trials in sepsis[J]. Intensive Care Med, 2008,34(11): 1955-1960.
[4]Marshall JC. Sepsis: Rethinking the approach to clinical research[J]. J Leukoc Biol, 2008, 83(3):471-482.
[5]Carlet J, Cohen J, Calandra T, et al. Sepsis: Time to reconsider the concept[J]. Crit Care Med, 2008, 36(3): 964-966.
[6]Jansen MJ, Hendriks T, Verhofstad AA, et al. Gradual development of organ damage in the murine zymosan-induced multiple organ dysfunction syndrome[J]. Shock, 1997, 8(4):261-267.
[7]Hotchkiss RS, Karl IE. The pathophysiology and treatment of sepsis[J]. N Engl J Med, 2003, 348(2): 138-150.
[8]Wang HW, Lu JY, Tian G, et al. Protective effect of N-acetylcysteine on lung dendritic cells against damage in multiple organ dysfunction syndrome model[J]. Med J Chin PLA, 2012, 37(10): 958-961. [王宏伟, 陆江阳, 田光, 等. N-乙酰-L-半胱氨酸对多器官功能障碍综合征模型小鼠肺树突细胞损伤的保护作用[J]. 解放军医学杂志, 2012, 37(10):958-961.]
[9]Kollef KE, Schramm GE, Wills AR, et al. Predictors of 30-day mortality and hospital costs in patients with ventilator-associ ated pneumonia attributed to potentially antibiotic-resistant gramnegative bacteria[J]. Chest, 2008, 134(2): 281-287.
[10]Levy MM, Dellinger RP, Townsend SR, et al. The surviving sepsis campaign: results of an international guideline-based performance improvement program targeting severe sepsis[J].Intensive Care Med, 2010, 6(2): 222-231.
[11]Limaye AP, Kirby KA, Rubenfeld GD, et al. Cytomegalovirus reactivation in critically ill immunocompetent patients[J].JAMA, 2008, 300(4): 413-422.
[12]Schefold JC, Hasper D, Reinke P, et al. Consider delayed immunosuppression into the concept of sepsis[J]. Crit Care Med, 2008, 36(11): 3118.
[13]Adib-Conquy M, Cavaillon JM. Compensatory antiinflammatory response syndrome[J]. Thromb Haemost, 2009,101(1): 36-47.
[14]Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who die of sepsis and multiple organ failure[J]. JAMA,2011, 306(23): 2594-2605.
[15]Li F, Lu JY, Liu Q, et al. Effect of MARCH1 on MHC-Ⅱubiquitination of splenic dendritic cells during multiple orga n dysfunction syndrome in mice[J]. Med J Chin PLA, 2012,37(5): 455-458. [李菲, 陆江阳, 刘茜, 等. MARCH1在多器官功能障碍综合征病程中对脾脏树突细胞MHC-Ⅱ类分子泛素化作用的研究[J]. 解放军医学杂志, 2012, 37(5): 455-458.]
[16]Wang ZG. Viewpoint on the current status of researches on sepsis[J]. Med J Chin PLA, 2012, 37(11): 1011-1014. [王正国.当前脓毒症研究的思考[J]. 解放军医学杂志, 2012, 37(11):1011-1014.]
[17]Wang H, Bloom O, Zhang M, et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science, 1999, 285(5425): 248-251.
[18]Steinberg S, Flynn W, Kelley K, et al. Development of a bacteriaindependent model of the multiple organ failure syndrome[J].Arch Surg, 1989, 124(12): 1390-1395.
[19]Volman TJ, Hendriks T, Goris RJ. Zymosan-induced generalized inflammation: experimental studies into mechanisms leading to multiple organ dysfunction syndrome[J]. Shock, 2005, 23(4):291-297.
[20]Wang AQ, Cao SH. Effect of Xuebijing on the cytokines and prognosis of infective MODS[J]. Tianjin Med J, 2007, 35(7):529-530. [王蔼卿, 曹书华. 血必净对感染性MODS 治疗中细胞因子及预后影响[J]. 天津医药, 2007, 35(7): 529-530.]
[21]Liao W, Lin JX, Leonard WJ. Interleukin-2 at the crossroads of effector responses, tolerance, and immunotherapy[J]. Immunity,2013, 38(1): 13-25.
[22]Trinchieri G. Immunobiology of interleukin-12[J]. Immunol Res, 1998, 17(1-2): 269-278.
[23]Liu Q, Lu JY, Wang XH, et al. Changes of murine splenic tolerogenetic dendritic cells with PD-1, PD-L1 expression in MODS mouse and its significance[J]. Med J Chin PLA, 2010,35(1): 15-17. [刘茜, 陆江阳, 王晓红, 等. MODS小鼠脾脏树突状细胞PD-1、PD-L1的表达变化及其意义[J]. 解放军医学杂志, 2010, 35(1): 15-17.]
[24]Wild CA, Bergmann C, Fritz G, et al. HMGB1 conveys immunosuppressive characteristics on regulatory and conventional T cells[J]. Int Immunol, 2012, 24(8): 485-494.
[25]Janssen WJ, Henson PM. Cellular regulation of the inflammatory response[J]. Toxicol Pathol, 2012, 40(2): 166-173.
[26]Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach[J]. Lancet Infect Dis, 2013, 3(3): 260-268 .
