调查我国与美欧药物不良反应监测水平对比
2014-11-05袁昊绪
■ 本刊记者 袁昊绪
药品在获得批准上市之前,均要经过包括实验室研究、动物实验、临床试验等一系列的上市前研究和广泛的审查与批准程序。在这个过程中会发现一些不 良 反 应(Adverse Drug Reaction),但由于在研发过程中的各种原因,特别是临床试验病例局限性的限制,一个药品上市后往往会被发现新的不良反应,如特定人群服用后出现其他身体损害,甚至药物对适应症没有预期疗效等情况,这些问题会对患者的生命健康造成严重威胁。因此,药品上市后不良反应监测和再评价就显得十分重要。我国在药物不良反应监测与药品上市后再评价机制较美国、加拿大、欧盟及英国的情况如何?本刊记者调查统计了2012年以来美国、加拿大、欧盟及英国与我国对出现严重不良反应药物的处理情况。调查统计显示,在药物不良反应监测与上市后再评价方面我国与美国、加拿大、欧盟及英国差距很大。以治疗高胆固醇血症的他汀类药物为例,欧盟、美国早在2011年12月14日和2012年2月28日就已经通知他汀类药品生产厂家,要求其更改说明书内容。而我国于2012年12月14日才发布警戒讯息,与欧美发达国家相比整整晚了一年。而这一年的时间里,不知道多少患者因他汀类药物的不良反应受到了健康威胁,甚至是伤害。
美欧发达国家的药品审查注册与不良反应监测
药物被定义为可以通过影响身体结构或功能而被用来诊断、治疗或预防疾病的产品。在美国,如果一种新药由实验室最初测试到被FDA批准一般需要8~10年的时间,经历早期测试、动物实验、试验用新药申请(Investigational New Drug Application)、 临 床 试 验、新药申请(New Drug Application)和新药上市后的监测六个阶段。这其中比较重要的是试验用新药申请、临床试验和新药申请。在实验室与动物研究结果令人满意的情况下,药物制造商可以作为申请者向FDA提交“试验用新药申请”,该申请需要总结实验室及动物试验信息,并为获得人类患者临床数据提供一项方案。
如果FDA批准“试验用新药申请”,那么临床试验(由人类受试者参与的研究)就可以开始了。临床试验分为Ⅰ期、Ⅱ期和Ⅲ期。参与Ⅰ期临床试验的受试者通常不超过100人,重点是考察药物的安全性,受试者一般为健康志愿者;参与Ⅱ期临床试验的受试者有数百人,重点是考察药物最佳用药剂量及治疗特定疾病或病症的能力,受试者一般为患有该种疾病或病症的患者;Ⅲ期临床试验最为关键,要求受试者人数达到数千人,重点是考察药物的安全性和有效性,通常将试验药物与安慰剂(如一种惰性糖片)或一种已经被批准对这种疾病有疗效的药物进行对比,以检查更深入的问题,如试验药物对某些患者人群的不良反应和副作用。临床试验结束之后,药物申请者可提交一份“新药申请”,申请批准这款药物在美国销售。FDA对非常重要的“新药申请”在6个月内进行审评,标准的审评时间是10个月。最后如果FDA决定批准这款药物,制造商需要编写该药物的正式说明书,包括描述该药物用来治疗何种疾病或病症,以及已知的副作用和服用警告。
新药就算通过注册,上市后也随时会受到药品安全监督委员会(DSOB)的不良反应监测。美国在其《联邦食品、药品与化妆品法案》中早已提出“上市后研究(postmarketing study,即临床IV期研究)”,并在1997年实施的《FDA1997年现代化法案》(简称《现代化法案》)第I编第130(a)条新增了上市后研究的规定,要求已批准的药物和生物制剂申办者每年向FDA报告其上市后的研究进展。2001年2月27日开始实施现行的上市后研究法规(Postmarketing Studies for Approved Human Drug and Licensed Biological Products)。《FDA 修改法案2007》第901条“人用药上市后研究与临床试验(postmarket study and clinical trial);风险评估和降低策略”对上市后研究与临床试验、风险评估与降低策略方面作出了详细规定。在药品上市前后,新药试验申办者都可与FDA就是否进行上市后研究进行协商。
在美国,药品不良反应报告收集主要依赖两大体系,即企业的强制报告系统和MedWatch的自愿报告系统。FDA将报告信息形成一个公开的数据库,设在其官方网站上,可供公众搜索和查询。FDA将有意义的不良反应定义为任何非预期、非故意、不希望有的或过度的药物反应导致的以下情况:①须停药(包括治疗用和诊断用);②须改变药物治疗方案;③须调整剂量;④须入院治疗;⑤延长住院时间;⑥须支持性治疗;⑦诊断明显复杂化;⑧对预后产生消极影响;⑨暂时性或永久性的伤害、致残或致死。根据此定义,过敏反应(免疫系统对药物产生异常敏感带来的结果)和特异质反应(某些个体所特有的对药物的异常敏感性)也包含其中。
FDA为了获得药品上市前试验未能发现的罕见、潜在或长期的药品不良反应,要求研发、生产企业在新药上市后前3年的每个季度都要提交定期报告。药品安全监督委员会在对这些报告和数据的分析整合基础上发布药品安全信息,提醒药品生产企业、医务工作者以及公众注意。FDA对收集到的不良反应信息,通过再评价等方式后通常采取这些措施:①医疗警告,向医生、药师、经营单位发警告信,提醒注意该药品不良反应并采取措施避免不良发应的发生;②说明书修改,FDA要求制药商在药品说明书上加入新的不良反应信息;③方框警示,在药品包装显著位置用方框形式注明警告,提醒医生不要忽视;④撤销上市,对多次发生严重不良反应的药品,FDA经过反复评估认为如果风险已经大于收益,就会要求药品退出市场。
企业强制报告系统和MedWatch系统是两个平行的系统。FDA如果发现医生或患者通过MedWatch系统上报的不良反应在企业强制系统中未上报,就会去调查企业为什么没有上报,要求企业给出具体而详细的说明,美国制药公司在如此压力下自然对不良反应报告很积极,有意识地减少漏报、瞒报。因此,不良反应监测在美国成了企业和医疗机构自觉自愿的工作。美国对于不上报不良反应者的处罚力度相当大,将其归为犯罪行为,对公司和个人都进行处罚,可以警告、罚款,严重的甚至可判处若干年监禁。2012年6月,强生公司就因隐瞒药物风险被罚款11亿美元。
美国FDA对于药品监测是十分系统和严格的。例如2014年1月14日,FDA发布信息,建议停止处方和销售含对乙酰氨基酚超过325mg的处方药。因为过量使用对乙酰氨基酚,可引起肝毒性反应,甚至可导致肝衰竭和死亡。对乙酰氨基酚是一种缓解疼痛和退热的药物,除单方外,还多与其他药物制成复方制剂。在美国,有数百种非处方药(OTC)和处方药中都含有这一成分。其中与镇咳、减鼻充血、抗过敏药物组成的复方制剂多为非处方药,用于治疗感冒引起的症状,如泰诺;与阿片类镇痛药或镇静催眠药组成的复方制剂多为处方药,用于缓解中度至重度疼痛,包括癌性疼痛、术后疼痛、偏头痛等,如氨酚待因、氨酚羟考酮等。FDA上述措施只针对处方药,不包括市场上用于治疗感冒等疾病的非处方药。采取此措施主要是基于对超量使用、误用或重复用药导致对乙酰氨基酚药物过量,以及在服用含对乙酰氨基酚药物时饮酒而产生的担忧。限制最高药物剂量可以帮助减少因对乙酰氨基酚过量导致的肝损害风险。美国FDA还同时强调,如必要,使用上述药品时可一次服用2片(粒或其他剂量单位),总量650mg,每日不超过4g。
加拿大的药品监测机制与美国FDA有许多的共通之处。例如2014年3月26日加拿大卫生部发布警示信息,使用嘌呤拮抗剂硫唑嘌呤或巯嘌呤可导致肝脾T-细胞淋巴瘤(HSTCL)的发生。硫唑嘌呤被批准用于治疗成人类风湿性关节炎和辅助预防肾移植排斥,巯嘌呤被批准用于治疗白血病。肝脾T-细胞淋巴瘤(HSTCL)是一种罕见的、侵袭性并常致命性癌症。至2013年11月30日,加拿大卫生部共收到2例使用巯嘌呤时发生的HSTCL病例(其中1例死亡)和4例使用硫唑嘌呤时发生的HSTCL严重病例(其中3例死亡)。
作为欧洲药品监督管理的最高机构,欧洲药品管理局(EMA)的药品监测也是最为严格的。例如2014年4月,EMA警戒风险评估委员会(PRAC)完成了对含多潘立酮药物的一项评估工作,建议在全欧盟(EU)范围内变更其使用适应症,主要包括限制这些药物仅用于缓解恶心和呕吐症状、在儿童使用中限制剂量并根据体重谨慎调整剂量。自20世纪70年代以来,含多潘立酮的药物已在欧盟的各成员国范围内得到上市许可,并作为非处方药或处方药广泛销售。用于治疗各种原因引起的恶心和呕吐(在部分成员国中包括儿童),同时还可用于治疗胀气、不适和烧心等症状。PRAC建议含多潘立酮的药物可继续上市,并可在欧盟继续用于治疗恶心和呕吐症状,但建议在成人和体重超过35kg的青少年中将剂量减小至10mg,每日最多3次口服给药。还可以给这些患者30mg栓剂每日2次的药物治疗。在用于体重小于35kg的儿童和青少年时,应以每千克体重0.25mg的剂量口服给药,每日最多3次。在采用液体剂型时应使用测量设备以便能根据体重精确给药。正常情况下,含多潘立酮的药物的使用不应超过1周,PRAC认为减少推荐剂量和降低使用疗程是多潘立酮风险最小化的关键措施。
英国药品和健康产品管理局(MHRA)在2014年4月发布的《药物安全更新》(Drug Safety Update)中警示,在肿瘤坏死因子-α抑制剂(TNF-α)治疗期间,结核病或潜伏性结核病重新激活的风险增加,并可能导致死亡。
我国药物不良反应监测及上市后再评价差距明显
与此对应,我国的药物不良反应监测又做得如何?据记者不完全统计,我国自2012年以来,国家食品药品监督管理局(2013年升格为总局)一共公布了11种西药的限制、更新说明书,具体药品见附表5。
从表中可以看出,我国的药品不良反应监测和欧美相比还有明显的差距,就此记者采访了某业内资深人士。该资深人士表示,我国的用药人群与用药量巨大,是欧美等国相加的数倍,本应能及时发现更多的药物不良反应,但为什么不能及时发现呢?这是因为,我国的药品不良反应监测一直处于起步的状态,这么多年没有明显变化,仍停留在消灭零报告和统计报告数的基础层面上,而对每例药物不良反应报告进行调查、研究还远远没有成为药物不良反应监测的主要工作,这也是我国为什么每年公布的对上市药品的诸如警告、修改说明书、撤销文号等措施那么少,并且即使采取了措施也不能排除是参考了欧美的处理决定而不是由自己的数据来决定的。
究其深层次原因,该资深人士认为,一是我国医生用药水平低。由于我国医生在学习和工作中较少关注自身药学知识的提高,固难以发现药物不良反应。本刊2006年1月刊登的《暗访京城50家医院医师用药水平状况》一文显示,当记者拿着可以引起不良反应的三组“问题处方”:辛伐他汀与(罗)红霉素、二甲双胍与氢氯噻嗪、左氧氟沙星与硫酸亚铁前往北京50家二、三级医院暗访开药时,“问题处方”的开出率高达94%,并有83.3%的医师在开出“问题处方”时无任何医嘱。
二是零售药店的药物不良反应监测几乎为零。我国的零售药店目前仍游离于医疗保障体系之外,即便有大量的患者在那里买药,也不会留下任何可以跟踪服药后情况的联系方式。再加上药店的执业药师的药学水平整体不高,甚至很多药店根本没有执业药师,何谈药物不良反应监测。
三是国人不良的“滥用药”习惯。按说“滥用药”会导致药品的不良反应例数很多,但是由于公众整体的医学、药学知识匮乏,吃药就像吃零食一样,不认为药品会给身体带来危害。
四是外国不良厂商装聋作哑。因为我国的药品不良监测水平较低,所以很多国际药品生产厂家采取“合理”避法手段,只要我国食药监部门没有提出,他们就会故意隐瞒那些在国外已经被勒令更新说明书甚至退市的药品,前几年发生的“息斯敏事件”就是很好的例子。
五是我国厂商利益为大。在我国市场上销售的化学药,其原研者基本为欧美生产厂家,我国制药企业绝大多数生产的是在该药品的专利权过期后加工的仿制药。这些制药企业只会追求商品利益的最大化,不会投入经费去进行药品的基础研究,比如药理、药效和药动学、工艺、辅料等等,更不会去研究药物的不良反应发生机理。
六是对药害事件惩罚措施与赔偿机制不健全。药品出现了严重不良反应,很多厂家私了了事。没有惩罚措施及药害赔偿机制,生产厂家就不会重视对不良反应的收集与研究。
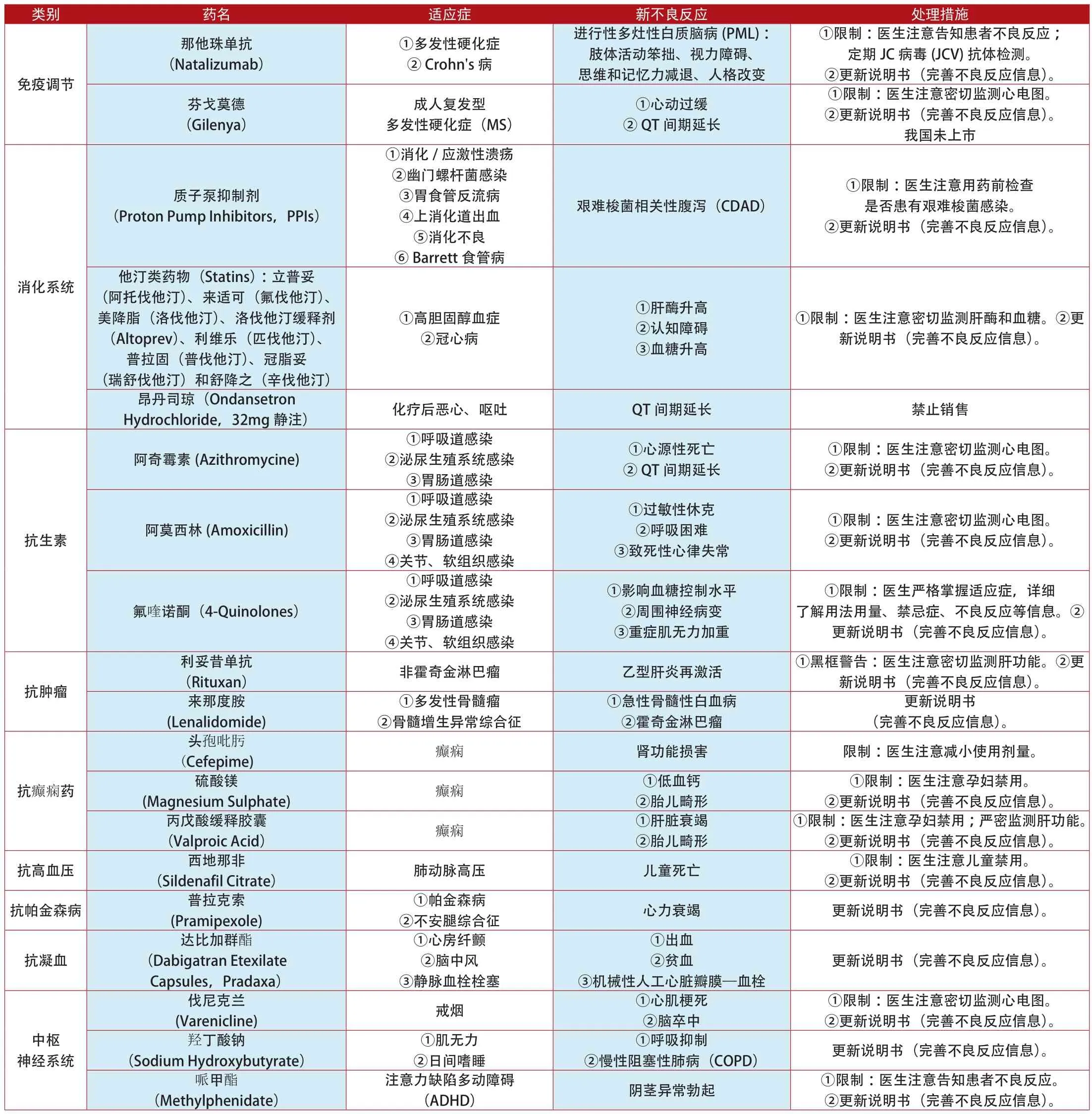
附表1:2012年1月~2014年7月美国更新说明书和禁止销售的上市药品
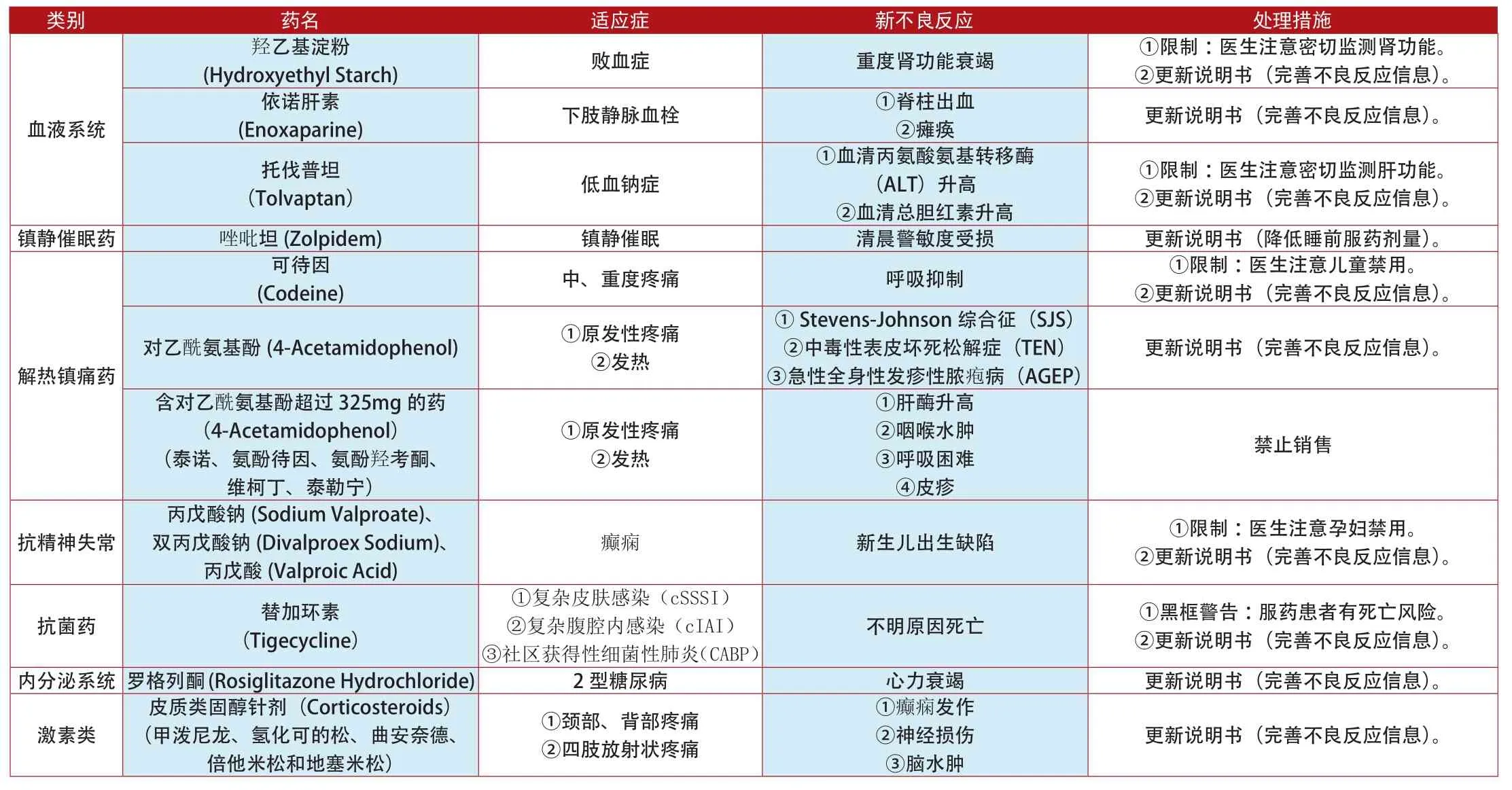
类别 药名 适应症 新不良反应 处理措施(Hydroxyethyl Starch) 败血症 重度肾功能衰竭 ①限制:医生注意密切监测肾功能。②更新说明书(完善不良反应信息)。依诺肝素羟乙基淀粉血液系统(Enoxaparine) 下肢静脉血栓 ①脊柱出血②瘫痪 更新说明书(完善不良反应信息)。①限制:医生注意密切监测肝功能。②更新说明书(完善不良反应信息)。镇静催眠药 唑吡坦(Zolpidem) 镇静催眠 清晨警敏度受损 更新说明书(降低睡前服药剂量)。托伐普坦(Tolvaptan) 低血钠症①血清丙氨酸氨基转移酶(ALT)升高②血清总胆红素升高(Codeine) 中、重度疼痛 呼吸抑制 ①限制:医生注意儿童禁用。②更新说明书(完善不良反应信息)。对乙酰氨基酚(4-Acetamidophenol) ①原发性疼痛②发热可待因更新说明书(完善不良反应信息)。解热镇痛药①Stevens-Johnson综合征(SJS)②中毒性表皮坏死松解症(TEN)③急性全身性发疹性脓疱病(AGEP)含对乙酰氨基酚超过325mg的药(4-Acetamidophenol)(泰诺、氨酚待因、氨酚羟考酮、维柯丁、泰勒宁)①原发性疼痛②发热①肝酶升高②咽喉水肿③呼吸困难④皮疹禁止销售抗精神失常丙戊酸钠(Sodium Valproate)、双丙戊酸钠(Divalproex Sodium)、丙戊酸(Valproic Acid)癫痫 新生儿出生缺陷 ①限制:医生注意孕妇禁用。②更新说明书(完善不良反应信息)。不明原因死亡 ①黑框警告:服药患者有死亡风险。②更新说明书(完善不良反应信息)。内分泌系统 罗格列酮(Rosiglitazone Hydrochloride) 2型糖尿病 心力衰竭 更新说明书(完善不良反应信息)。抗菌药 替加环素(Tigecycline)①复杂皮肤感染(cSSSI)②复杂腹腔内感染(cIAI)③社区获得性细菌性肺炎(CABP)激素类皮质类固醇针剂(Corticosteroids)(甲泼尼龙、氢化可的松、曲安奈德、倍他米松和地塞米松)①颈部、背部疼痛②四肢放射状疼痛①癫痫发作②神经损伤③脑水肿更新说明书(完善不良反应信息)。
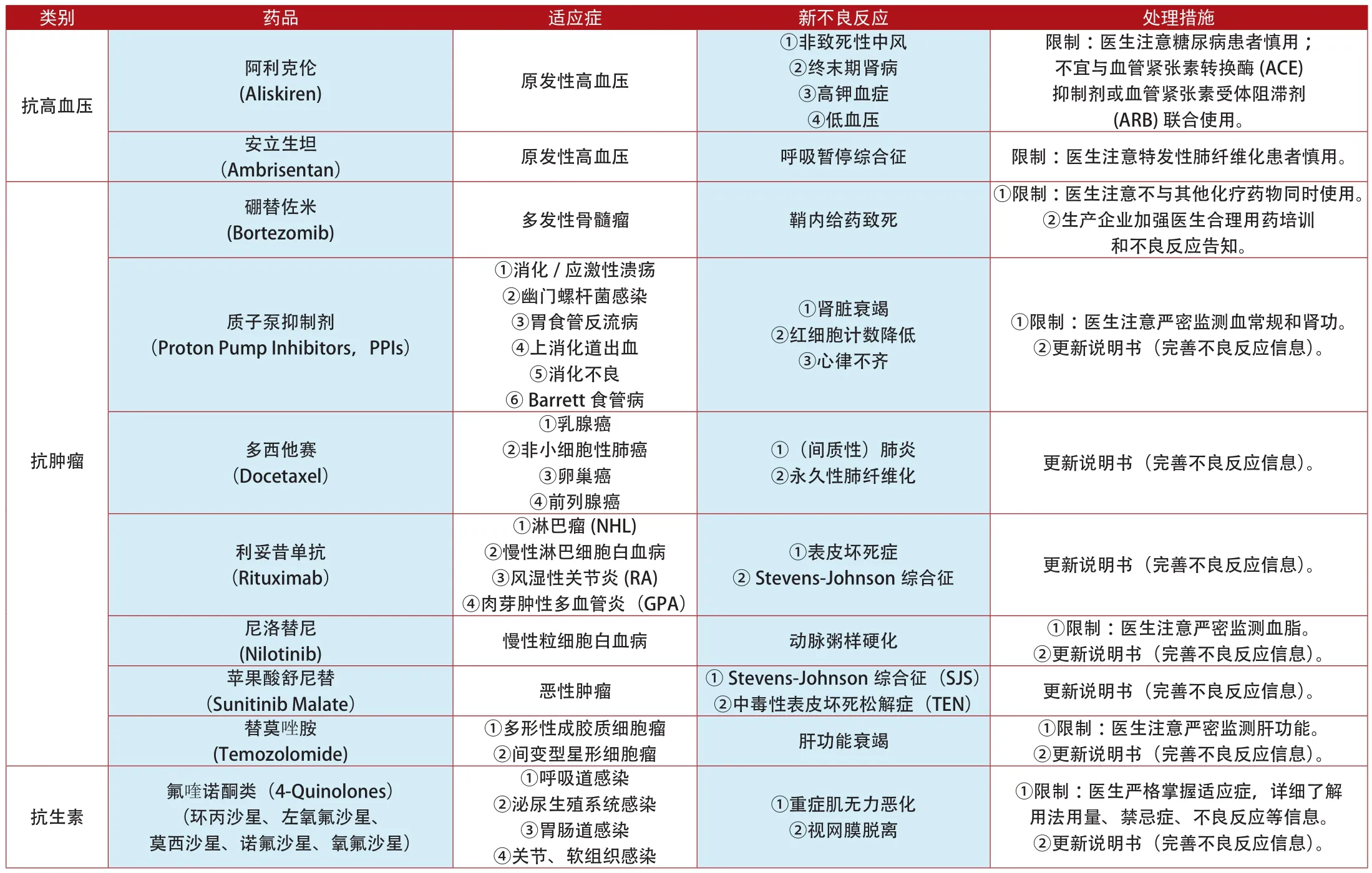
附表2:2012年1月~2014年7月加拿大更新说明书和禁止销售的上市药品
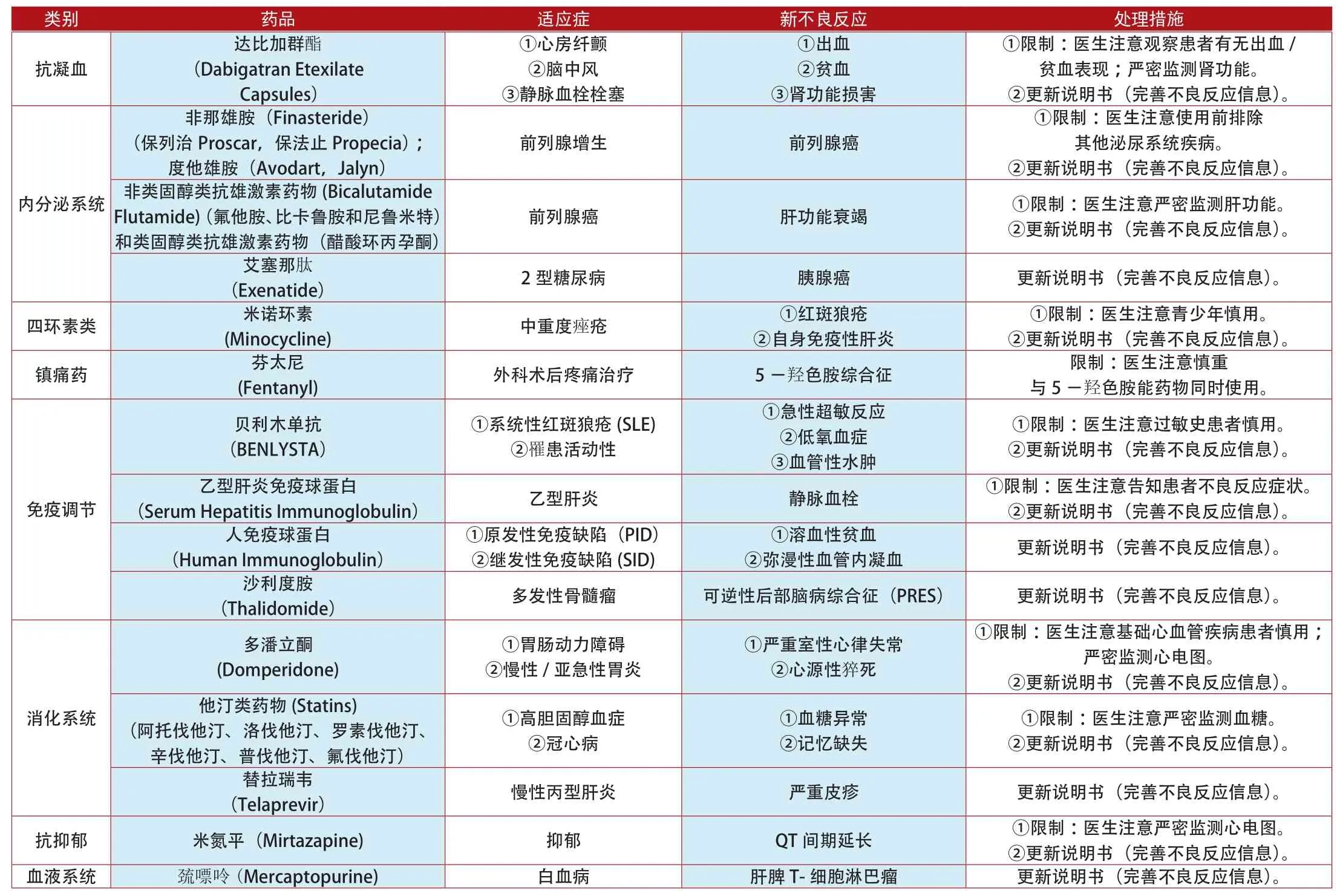
类别 药品 适应症 新不良反应 处理措施抗凝血达比加群酯(Dabigatran Etexilate Capsules)①心房纤颤②脑中风③静脉血栓栓塞①出血②贫血③肾功能损害①限制:医生注意观察患者有无出血/贫血表现;严密监测肾功能。②更新说明书(完善不良反应信息)。非那雄胺(Finasteride)(保列治Proscar,保法止Propecia);度他雄胺(Avodart,Jalyn)前列腺增生 前列腺癌①限制:医生注意使用前排除其他泌尿系统疾病。②更新说明书(完善不良反应信息)。内分泌系统前列腺癌 肝功能衰竭 ①限制:医生注意严密监测肝功能。②更新说明书(完善不良反应信息)。艾塞那肽(Exenatide) 2型糖尿病 胰腺癌 更新说明书(完善不良反应信息)。四环素类 米诺环素非类固醇类抗雄激素药物(Bicalutamide Flutamide)(氟他胺、比卡鲁胺和尼鲁米特)和类固醇类抗雄激素药物(醋酸环丙孕酮)①限制:医生注意青少年慎用。②更新说明书(完善不良反应信息)。镇痛药 芬太尼(Minocycline) 中重度痤疮 ①红斑狼疮②自身免疫性肝炎(Fentanyl) 外科术后疼痛治疗 5-羟色胺综合征 限制:医生注意慎重与5-羟色胺能药物同时使用。贝利木单抗(BENLYSTA)①系统性红斑狼疮(SLE)②罹患活动性①急性超敏反应②低氧血症③血管性水肿(Serum Hepatitis Immunoglobulin) 乙型肝炎 静脉血栓 ①限制:医生注意告知患者不良反应症状。②更新说明书(完善不良反应信息)。人免疫球蛋白(Human Immunoglobulin)①限制:医生注意过敏史患者慎用。②更新说明书(完善不良反应信息)。乙型肝炎免疫球蛋白免疫调节①原发性免疫缺陷(PID)②继发性免疫缺陷(SID)①溶血性贫血②弥漫性血管内凝血 更新说明书(完善不良反应信息)。沙利度胺(Thalidomide) 多发性骨髓瘤 可逆性后部脑病综合征(PRES) 更新说明书(完善不良反应信息)。多潘立酮(Domperidone)①胃肠动力障碍②慢性/亚急性胃炎①严重室性心律失常②心源性猝死①限制:医生注意基础心血管疾病患者慎用;严密监测心电图。②更新说明书(完善不良反应信息)。消化系统①限制:医生注意严密监测血糖。②更新说明书(完善不良反应信息)。替拉瑞韦(Telaprevir) 慢性丙型肝炎 严重皮疹 更新说明书(完善不良反应信息)。抗抑郁 米氮平(Mirtazapine) 抑郁 QT间期延长 ①限制:医生注意严密监测心电图。②更新说明书(完善不良反应信息)。血液系统 巯嘌呤(Mercaptopurine) 白血病 肝脾T-细胞淋巴瘤 更新说明书(完善不良反应信息)。他汀类药物(Statins)(阿托伐他汀、洛伐他汀、罗素伐他汀、辛伐他汀、普伐他汀、氟伐他汀)①高胆固醇血症②冠心病①血糖异常②记忆缺失
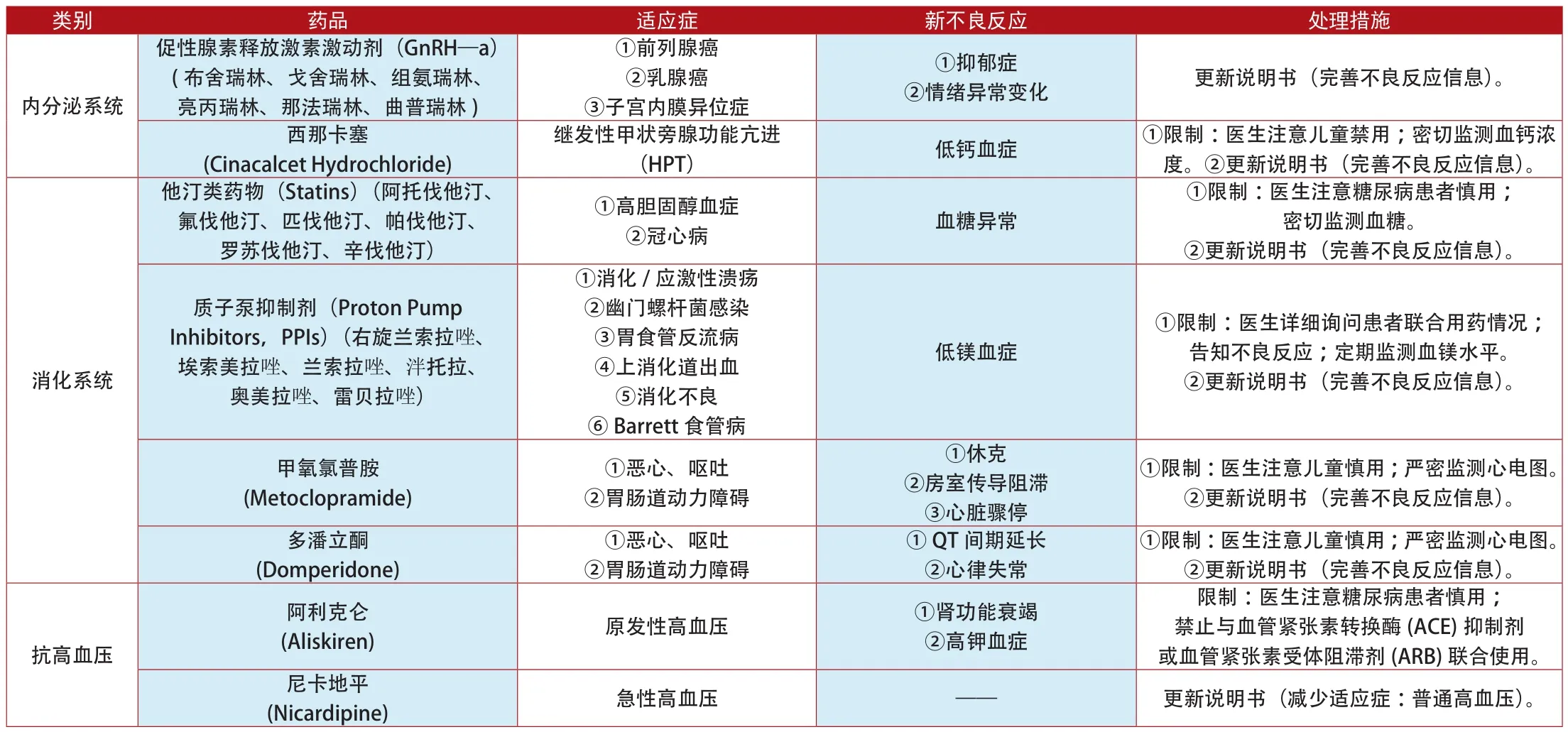
附表3:2012年1月~2014年7月欧盟更新说明书和禁止销售的上市药品
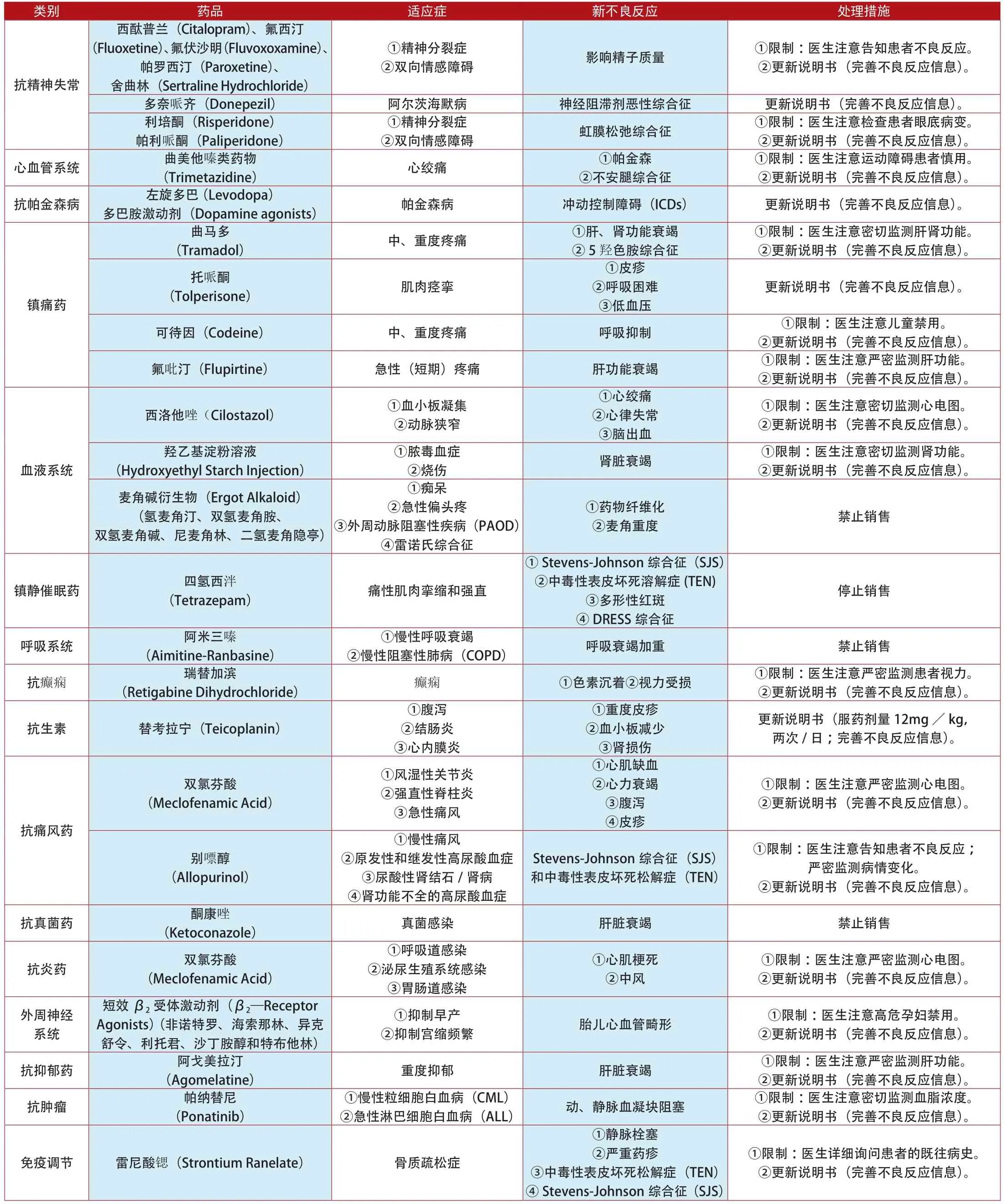
类别 药品 适应症 新不良反应 处理措施②双向情感障碍 影响精子质量 ①限制:医生注意告知患者不良反应。②更新说明书(完善不良反应信息)。西酞普兰(Citalopram)、氟西汀(Fluoxetine)、氟伏沙明(Fluvoxoxamine)、帕罗西汀(Paroxetine)、舍曲林(Sertraline Hydrochloride)抗精神失常①精神分裂症多奈哌齐(Donepezil) 阿尔茨海默病 神经阻滞剂恶性综合征 更新说明书(完善不良反应信息)。利培酮(Risperidone)帕利哌酮(Paliperidone)①精神分裂症②双向情感障碍 虹膜松弛综合征 ①限制:医生注意检查患者眼底病变。②更新说明书(完善不良反应信息)。心血管系统 曲美他嗪类药物①限制:医生注意运动障碍患者慎用。②更新说明书(完善不良反应信息)。抗帕金森病左旋多巴 (Levodopa)多巴胺激动剂(Dopamine agonists) 帕金森病 冲动控制障碍(ICDs) 更新说明书(完善不良反应信息)。(Trimetazidine) 心绞痛 ①帕金森②不安腿综合征①限制:医生注意密切监测肝肾功能。②更新说明书(完善不良反应信息)。托哌酮(Tolperisone) 肌肉痉挛(Tramadol) 中、重度疼痛 ①肝、肾功能衰竭②5羟色胺综合征曲马多更新说明书(完善不良反应信息)。镇痛药①皮疹②呼吸困难③低血压可待因(Codeine) 中、重度疼痛 呼吸抑制 ①限制:医生注意儿童禁用。②更新说明书(完善不良反应信息)。氟吡汀(Flupirtine) 急性(短期)疼痛 肝功能衰竭 ①限制:医生注意严密监测肝功能。②更新说明书(完善不良反应信息)。①限制:医生注意密切监测心电图。②更新说明书(完善不良反应信息)。羟乙基淀粉溶液(Hydroxyethyl Starch Injection)西洛他唑(Cilostazol) ①血小板凝集②动脉狭窄①心绞痛②心律失常③脑出血①脓毒血症血液系统 ②烧伤 肾脏衰竭 ①限制:医生注意密切监测肾功能。②更新说明书(完善不良反应信息)。麦角碱衍生物(Ergot Alkaloid)(氢麦角汀、双氢麦角胺、双氢麦角碱、尼麦角林、二氢麦角隐亭)①痴呆②急性偏头疼③外周动脉阻塞性疾病(PAOD)④雷诺氏综合征①药物纤维化②麦角重度 禁止销售镇静催眠药 四氢西泮(Tetrazepam) 痛性肌肉挛缩和强直①Stevens-Johnson综合征(SJS)②中毒性表皮坏死溶解症(TEN)③多形性红斑④DRESS综合征停止销售呼吸系统 阿米三嗪(Aimitine-Ranbasine)①慢性呼吸衰竭②慢性阻塞性肺病(COPD) 呼吸衰竭加重 禁止销售抗癫痫 瑞替加滨(Retigabine Dihydrochloride) 癫痫 ①色素沉着②视力受损 ①限制:医生注意严密监测患者视力。②更新说明书(完善不良反应信息)。抗生素 替考拉宁(Teicoplanin)①腹泻②结肠炎③心内膜炎①重度皮疹②血小板减少③肾损伤更新说明书(服药剂量12mg/kg,两次/日;完善不良反应信息)。双氯芬酸(Meclofenamic Acid)①风湿性关节炎②强直性脊柱炎③急性痛风①限制:医生注意严密监测心电图。②更新说明书(完善不良反应信息)。抗痛风药①心肌缺血②心力衰竭③腹泻④皮疹①限制:医生注意告知患者不良反应;严密监测病情变化。②更新说明书(完善不良反应信息)。抗真菌药 酮康唑(Ketoconazole) 真菌感染 肝脏衰竭 禁止销售别嘌醇(Allopurinol)①慢性痛风②原发性和继发性高尿酸血症③尿酸性肾结石/肾病④肾功能不全的高尿酸血症Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN)抗炎药 双氯芬酸(Meclofenamic Acid)①呼吸道感染②泌尿生殖系统感染③胃肠道感染①心肌梗死②中风①限制:医生注意严密监测心电图。②更新说明书(完善不良反应信息)。外周神经系统②抑制宫缩频繁 胎儿心血管畸形 ①限制:医生注意高危孕妇禁用。②更新说明书(完善不良反应信息)。抗抑郁药 阿戈美拉汀短效β2受体激动剂(β2—Receptor Agonists) (非诺特罗、海索那林、异克舒令、利托君、沙丁胺醇和特布他林)①抑制早产(Agomelatine) 重度抑郁 肝脏衰竭 ①限制:医生注意严密监测肝功能。②更新说明书(完善不良反应信息)。抗肿瘤 帕纳替尼(Ponatinib)②急性淋巴细胞白血病(ALL) 动、静脉血凝块阻塞 ①限制:医生注意密切监测血脂浓度。②更新说明书(完善不良反应信息)。①慢性粒细胞白血病(CML)免疫调节 雷尼酸锶(Strontium Ranelate) 骨质疏松症①静脉栓塞②严重药疹③中毒性表皮坏死松解症(TEN)④Stevens-Johnson综合征(SJS)①限制:医生详细询问患者的既往病史。②更新说明书(完善不良反应信息)。

类别 药品 适应症 新不良反应 处理措施降钙素(Calcitonin)①限制:医生注意骨质疏松症禁用;密切监测血钙溶度。②更新说明书(完善不良反应信息)。吡美莫司①骨质疏松症②Paget病③高钙血症前列腺癌免疫调节(Strontium Ranelate) 重度骨质疏松 ①动脉血流阻塞②心肌缺血①限制:医生注意密切监测心电图。②更新说明书(完善不良反应信息)。双醋瑞因(Diacerein) 退变性骨关节病 重度腹泻 禁止销售(Pimecrolimus) 特应性皮炎 恶性疾病 ①限制:医生注意2岁内儿童禁用。②更新说明书(完善不良反应信息)。雷奈酸锶
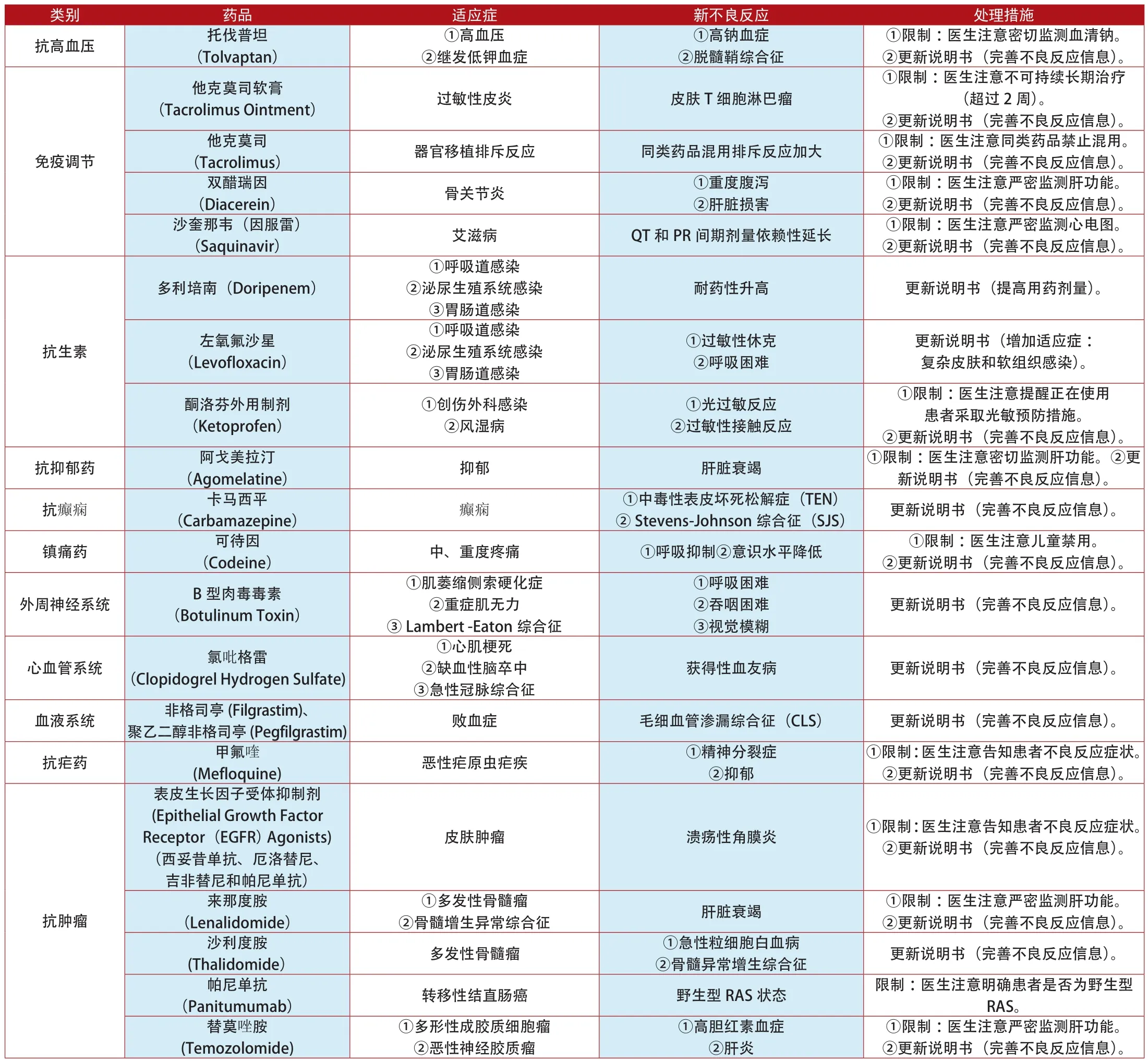
附表4:2012年1月~2014年7月英国更新说明书和禁止销售的上市药品
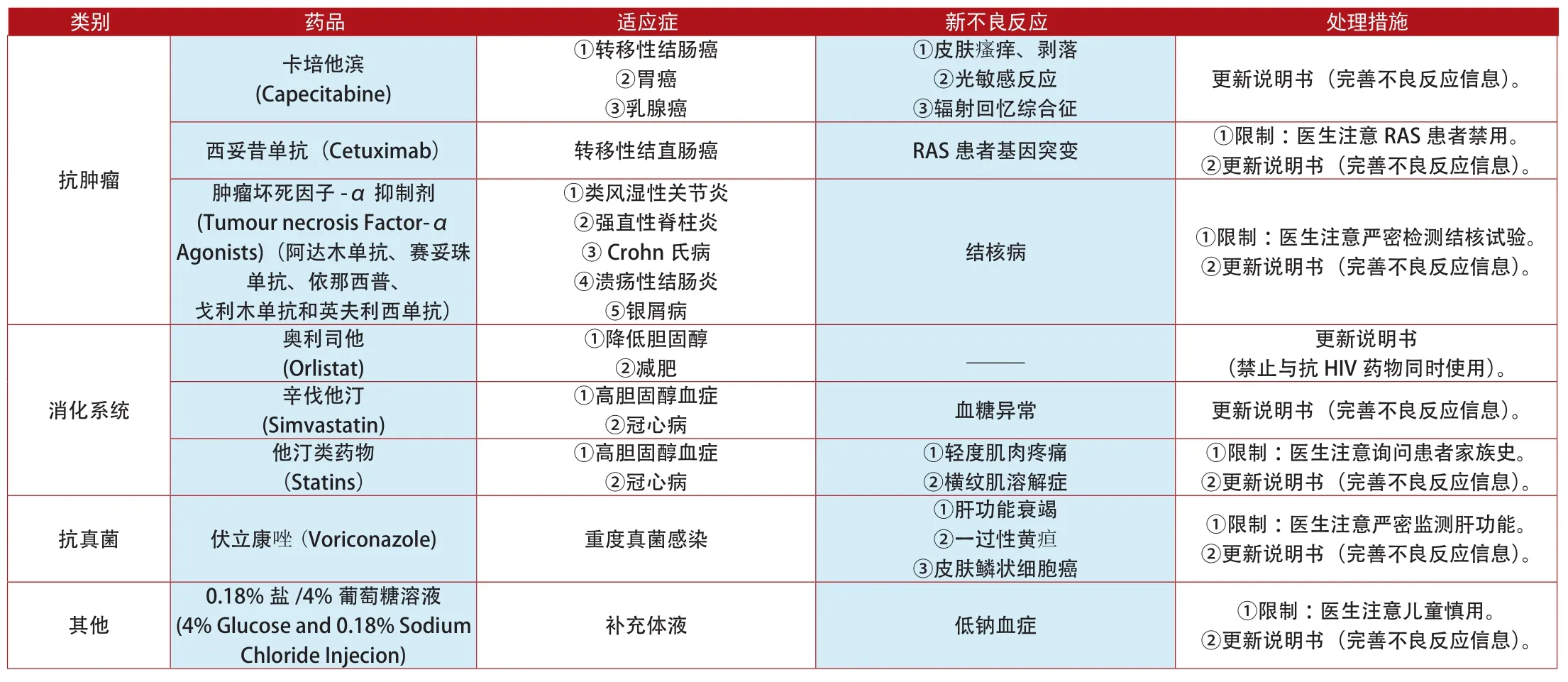
类别 药品 适应症 新不良反应 处理措施卡培他滨(Capecitabine)①转移性结肠癌②胃癌③乳腺癌①皮肤瘙痒、剥落②光敏感反应③辐射回忆综合征更新说明书(完善不良反应信息)。西妥昔单抗(Cetuximab) 转移性结直肠癌 RAS患者基因突变 ①限制:医生注意RAS患者禁用。②更新说明书(完善不良反应信息)。肿瘤坏死因子-α抑制剂(Tumour necrosis Factor-α Agonists)(阿达木单抗、赛妥珠单抗、依那西普、戈利木单抗和英夫利西单抗)抗肿瘤①类风湿性关节炎②强直性脊柱炎③Crohn氏病④溃疡性结肠炎⑤银屑病结核病 ①限制:医生注意严密检测结核试验。②更新说明书(完善不良反应信息)。②减肥 _____ 更新说明书(禁止与抗HIV药物同时使用)。辛伐他汀(Simvastatin)奥利司他(Orlistat)①降低胆固醇消化系统①高胆固醇血症②冠心病 血糖异常 更新说明书(完善不良反应信息)。①限制:医生注意询问患者家族史。②更新说明书(完善不良反应信息)。抗真菌 伏立康唑(Voriconazole) 重度真菌感染他汀类药物(Statins)①高胆固醇血症②冠心病①轻度肌肉疼痛②横纹肌溶解症①肝功能衰竭②一过性黄疸③皮肤鳞状细胞癌①限制:医生注意严密监测肝功能。②更新说明书(完善不良反应信息)。其他0.18%盐/4%葡萄糖溶液(4% Glucose and 0.18% Sodium Chloride Injecion)补充体液 低钠血症 ①限制:医生注意儿童慎用。②更新说明书(完善不良反应信息)。
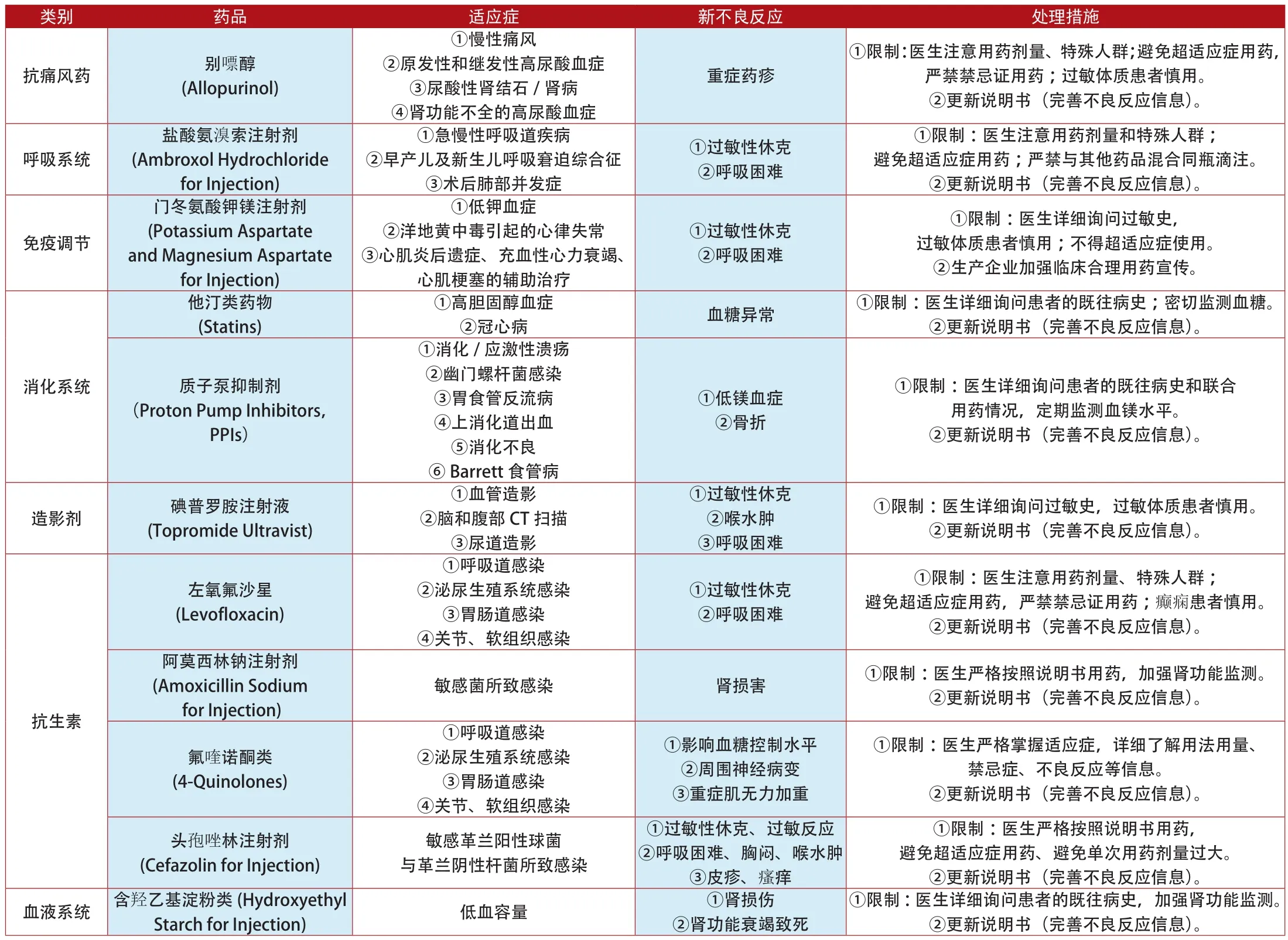
附表5:2012年1月~2014年7月我国更新说明书和禁止销售的上市药品
