胃癌小鼠模型中T淋巴细胞检测及初步分析
2014-11-02王锦国吴向未陈雪玲李维嘉牛建华
王锦国,吴向未,陈雪玲,李维嘉,牛建华
(1石河子大学医学院第一附属医院普外科,石河子832000;2石河子大学医学院病原生物学与免疫学教研室,石河子832000)
胃癌是一种最常见的恶性肿瘤,在全世界癌症中占8%的总病例和10%的总死亡人数[1]。在中国,日本,韩国等许多亚洲国家,它仍然是癌症相关死亡的常见原因之一。胃癌被诊断出来时,往往已经是进展期并且无法手术治疗,放射治疗或化疗效果并不令人满意,开发新的辅助治疗方式是必要的,免疫疗法有望成为一个新的选择。因此,在胃癌小鼠模型中观察免疫系统的作用机制是必不可少的。
机体的免疫系统在抗感染、抗肿瘤等免疫应答方面起着重要作用,机体抗肿瘤反应主要通过T淋巴细胞介导的细胞免疫[2]。CD4+T细胞是T淋巴细胞的重要亚群之一,根据其分泌的细胞因子和介导的功能不同分为Th1和Th2细胞。目前研究认为Th1和Th2等细胞因子以及Th1/Th2比值平衡变化在机体抗肿瘤免疫中起到重要作用[3]。调节性T细胞(Regulatory T cell,Treg)是不同于Th1和 Th2的新型T细胞亚群,在不同的研究报道中,还存在争议,例如一些研究认为Treg细胞具有保护性,而在肿瘤浸润或外周血中Treg细胞具有抑制效应T细胞的作用,从而促进肿瘤细胞的发展[4]。
本研究通过建立胃癌小鼠模型,流式细胞仪检测CD4+T/CD8+T细胞比例及Treg细胞标记CD4+CD25+T细胞含量的水平变化,探讨Treg细胞及T细胞亚群在胃癌模型中的作用,为肿瘤的免疫治疗提供理论基础和实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物
615近交系小鼠,购自中国医学科学院天津血液病研究所,6-8周龄,雌雄各半,体质量20~25g,无特定病原体(SPF)级。
1.1.2主要试剂和仪器
1)RPMI-1640 培养基,胎牛血清(FBS)均购自HYCLIONE 公司;2)流式抗体 CD3-FITC、CD4-PE、CD8-APC、CD25-APC 购 自 ebioscience 公 司 ;3)MFC小鼠胃癌细胞株购自中国科学院上海生命科学研究所。
1.2 方法
1.2.1动物模型的建立
用615近交系小鼠,饲养在清洁级动物房,自由光照。MFC胃癌细胞株在含10%胎牛血清RPMI-1640培养基的培养瓶中培养,放于37℃含有5%CO2的培养箱内进行体外传代。经4%胎盘蓝染色确定活细胞数占细胞总数的96%以上。MFC细胞计数后,按1×107个细胞/小鼠注入615小鼠颈背部皮下。接种后小鼠每日正常进食、进水。
1.2.2实验分组
分别取正常小鼠脾脏及建模成功后1周小鼠的脾脏,检测T淋巴细胞亚群及Treg细胞水平,每组20只。
1.2.3小鼠脾脏细胞分离[5]
脱颈处死小鼠,浸入75%乙醇内3 min,无菌摘取小鼠脾脏,去除与其相连的结缔组织,放入含PBS的小皿中冲洗3次,用无菌注射器的针芯研磨之后用滤网过滤,收集细胞悬液,将其轻轻加到底部含有淋巴细胞分离液的离心管中离心(2000 r/min,20 min)。收集白膜层,并用PBS洗2次,最后用PBS稀释成1×107/mL浓度的细胞悬液,备用。
1.2.4流式细胞仪检测T淋巴细胞亚群及Treg细胞数量
制备好的脾细胞悬液0.1 mL,分别加入CD3-FITC、CD4-PE、CD8-APC荧光素标记抗鼠单克隆抗体各20 μL;另取制备好的脾细胞悬液0.1 mL,加入 CD3-FITC、CD4-PE、CD25-APC 荧光素标记抗鼠单克隆抗体各20 μL,充分混匀,避光放置30 min,加入0.5 mLPBS上机检测。
1.3 统计学处理
所有数据均用SPSS17.0软件进行统计学分析,计量资料采用X+S表示。两组间比较采用两样本均数的t参数检验。
2 结果与分析
2.1 小鼠皮下移植瘤生长情况
将MFC胃癌细胞种植于小鼠颈背部皮下,所有小鼠在1周左右均可成瘤,肿瘤直径1 cm左右(图1)。

图1 荷瘤小鼠模型Fig.1 Model of tumor-bearing mouse
2.2 CD4+CD25+Treg细胞流式分析结果
胃癌实验组小鼠脾CD4+CD25+Treg细胞较正常对照组增多(P<0.01)(表 1、图 2)。

图2 正常对照组及胃癌小鼠脾脏中CD4+CD25+T细胞比例变化的流式细胞分析结果Fig.2 Variation of the CD4+CD25+T cells proportion from normal control group and gastric cancer group in mice spleen by flow cytometry analysis
2.3 T细胞亚群及CD4+T/CD8+T细胞比值流式分析结果
胃癌实验组小鼠脾CD3+T、CD8+T细胞较正常对照组升高;CD4+T细胞及CD4+T/CD8+T细胞比值较正常对照组降低,(P<0.01)(表 1,图 3)。

图3 正常对照组及胃癌小鼠脾脏中CD4+T与CD8+T细胞比例变化的流式细胞分析结果Fig.3 Variation of the CD4+T and CD8+T cells proportion from normal control group and gastric cancer group in mice spleen by flow cytometry analysis
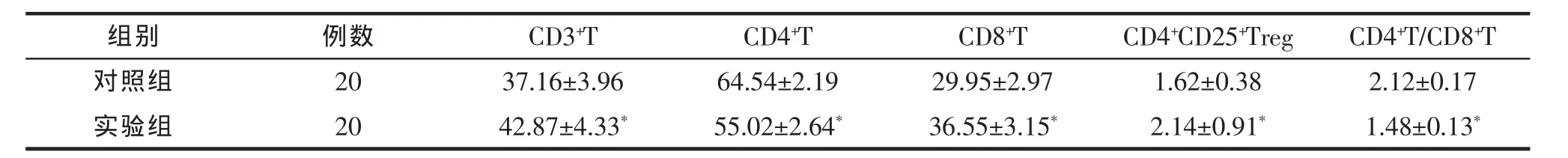
表1 胃癌组与对照组CD3+T、CD4+T、CD8+T、CD4+CD25+Treg和CD4+T/CD8+T比值水平检测结果 X+S,%Tab.1 Results of CD3+T,CD4+T,CD8+T,CD4+CD25+Treg levels and CD4+T/CD8+T ratio from gastric cancer group and normal control group X+S,%
3 讨论
肿瘤的发生与机体抗肿瘤免疫和免疫状态密切相关。肿瘤免疫主要是通过细胞免疫,细胞免疫是由T淋巴细胞所介导的免疫。T淋巴细胞亚群的相对分布决定了T淋巴细胞的功能状态,其调节作用通过功能各异的亚群来完成。T细胞的功能和数量异常可使肿瘤细胞逃避机体的免疫监视。根据T淋巴细胞表面分化抗原的差异,可以将成熟的T淋巴细胞分为CD4+T细胞和CD8+T细胞两大亚群,CD3+T代表全部的T淋巴细胞,CD4+T细胞通过分泌细胞因子,辅助其他免疫细胞发挥抗肿瘤作用;CD8+T细胞具有免疫杀伤效应,可以特异性识别抗原,直接、连续与特异性地杀伤靶细胞。但是在免疫应答中,效应性CD8+T细胞无限制的扩增,则引发CD8+T细胞通过自身及抑制因子在免疫反应中的负向作用,抑制抗体生成及细胞免疫应答。CD4+T/CD8+T比值在机体内的动态平衡,是保持机体细胞免疫水平高低的重要调节。测定CD4+T,CD8+T及CD4+T/CD8+T比值,能够直接反映机体的细胞免疫功能水平。有研究表明T淋巴细胞功能与胃癌的发生发展具有密切关系,尤其CD4+T/CD8+T比值更能反应机体的细胞免疫状态和抗肿瘤能力[6]。
童明宏等[7]研究发现,胃癌患者外周血中CD3+T、CD4+T细胞比值均明显低于正常人,CD8+T细胞升高,说明胃癌患者免疫功能低下。我们的研究结果与之相似,胃癌小鼠脾脏中CD4+T细胞较正常小鼠下降,表明在胃癌小鼠体内肿瘤细胞可能对CD4+T的功能产生抑制并同时减少其数量,从而使机体发生肿瘤免疫耐受,为肿瘤的发生发展提供良好的免疫环境。CD3+T细胞及CD8+T细胞数量有所上升,这可能是由于机体荷瘤以后肿瘤产生的免疫反应,从而导致免疫细胞增殖。
刘瑞等[8]研究发现,CD4+T/CD8+T比值在肿瘤患者中明显降低。我们的研究结果与之相符,提示机体在肿瘤的发展过程中,肿瘤细胞可能产生免疫抑制因子,使CD4+T细胞功能下降,CD8+T细胞数量及活性提高,而CD8+T细胞又阻止CD4+T细胞的形成和成熟,使CD4+T细胞数量降低,表现为CD4+T/CD8+T比值下降,从而使机体免疫功能抑制。
CD4+CD25+T(Treg)细胞在肿瘤发生和肿瘤细胞免疫逃逸中的作用越来越受到人们的关注[9]。Treg细胞由Sakaguchi等[10]于1995年首先报道,是一种不同于Th1和Th2的具有免疫抑制功能的T淋巴细胞亚群,约占CD4+T细胞的5%-15%。Treg细胞具有“低反应性与免疫抑制性”两大功能特征,活化以后能够抑制CD+4和CD+8T细胞的活化和增殖作用,并且这种免疫抑制不受主要组织抗原复合物(MHC)限制[11],其在肿瘤逃逸宿主免疫攻击中发挥重要作用[12]。国外研究发现在胃癌环境中Treg细胞数量升高,抑制了免疫应答[13]。我们研究结果表明Treg细胞在胃癌小鼠脾脏中较正常对照组增高,提示胃癌小鼠免疫功能抑制与Treg细胞的增加有关,这与Sasada等[14]在149例胃癌患者中检测结果一致。可以认为Treg细胞的增加导致机体的免疫调节和监视功能减弱,肿瘤细胞逃避免疫系统的清除并可能导致不良预后。
本研究结果提示肿瘤患者免疫功能下降,抗肿瘤能力减弱,可以通过提高CD3+T、CD4+T细胞的数量来提高肿瘤患者的免疫功能。同时通过检测T淋巴细胞,有助于监测机体的免疫状态及免疫功能,对评估和判断预后都有一定的指导意义。肿瘤环境中Treg细胞比例增加,导致肿瘤免疫功能失调,而高水平的Treg细胞可能对具有免疫活性的细胞产生抑制,去除这种细胞可有效诱导肿瘤免疫,这为肿瘤的免疫治疗提供一个新的思路。有研究表明Treg细胞可通过表面膜分子接触和分泌抑制性因子IL-10和TGF-β等方式,抑制体内T淋巴细胞及NK细胞等免疫细胞的活性和增殖[15]。具体通过何种方式进行免疫调节,还有待进一步研究。
[1]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA:a cancer journal for clinicians,2011,61(2):69-90.
[2]Decensi A,Costa A.Recent advances in cancer chemoprevention with emphasis on breast and cancer[J].Eur J cancer,2002,3(6):694-709.
[3]杜秀坤,聂会生,梁瑜,等.胃癌根治术后化疗对患者外周血Th1/Th2比率的影响[J].河北医药,2010,32(2):172-173.
[4]Amedei A,Della Bella C,Silvestri E,et al.T cellsin gastric cancer:friends or foes[J].Clinical and developmental immunology,2012,7(2):134-144.
[5]杨巧丽,顾政一,黄华,等.金蒿抗流感滴丸对小鼠TNF-α,IL-2和IFN-γ等细胞因子的影响[J].石河子大学学报:自然科学版,2012,30(1):56-59.
[6]Kume T,Oshima K,Yamashita Y,etal.Relationship between Fas-ligand expression on carcinoma cell and cytotoxic T-lymphocyte response in lymphoepithelioma-like cancer of the stomach[J].International journal of cancer,1999,84(4):339-343.
[7]童明宏,邵俊,陈燕红,等.CD3+,CD4+,CD8+T细胞水平在胃癌患者外周血中的变化[J].检验医学,2012,27(6):445-447
[8]刘瑞,郭峰.胰腺癌患者围术期机体免疫功能的动态观察[J].中华实验外科杂志,2000,17(2):186-186.
[9]Dunn G P,Old L J,Schreiber R D.The three Es of cancer immunoediting[J].Annu Rev Immunol,2004,22(2):329-360.
[10]SakaguchiS,SakaguchiN,Asano M,etal.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].The Journal of Immunology,1995,155(3):1151-1164.
[11]郎涛,吴广胜.慢性ITP患者外周血调节性T细胞及相关细胞因子的研究 [J].石河子大学学报:自然科学版,2009,27(4):474-477.
[12]Nummer D,SuriP E,SchmitzW H,et al.Role of tumor endothelium in CD4+CD25+regulatory T cell infiltration of human pancreatic carcinoma[J].Journal of the National Cancer Institute,2007,99(15):1188-1199.
[13]Shen L S,Wang J,Shen D F,et al.CD4+CD25+CD127low/-regulatory T cells express Foxp3 and suppress effector T cellproliferation and contribute to gastric cancers progression[J].Clinical Immunology,2009,131(1):109-118.
[14]Sasada T,Kimura M,Yoshida Y,et al.CD4+CD25+regulatory T cells in patients with gastrointestinal malignancies[J].Cancer,2003,98(5):1089-1099.
[15]Ghiringhelli F,Ménard C,Terme M,et al.CD4+CD25+regulatory T cells inhibit natural killer cell functions in a transforming growth factor-β-dependent manner[J].The Journal of experimental medicine,2005,202(8):1075-1085.
