与膜-细胞骨架连接蛋白家族结合的磷酸化蛋白50对血管内皮细胞增殖、迁移及成管能力的影响
2014-10-25冯智慧赵林刘晓华焦淑贤陈鹏
冯智慧 赵林 刘晓华 焦淑贤 陈鹏
通过抑制新生血管的形成来治疗肿瘤,已经成为肿瘤治疗的新策略[1-2]。角膜本身无血管,因此实验中只要发现血管就可以认为是新生血管,可避免其他模型中原有血管的干扰,能真实地反映血管生成过程[3]。我们前期在小鼠角膜新生血管模型中,通过基因表达谱芯片发现与膜-细胞骨架连接蛋白家族结合的磷酸化蛋白50(ezrin-radixin-moesinbinding phosphoprotein 50,EBP50)在血管新生过程中表达明显上调[4]。目前,关于EBP50在肿瘤新生血管中的作用及其机制尚未见报道,本研究将通过在人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)内过量表达EBP50蛋白,研究其对人血管内皮细胞增殖、迁移及成管功能的影响及可能的分子机制。
1 材料与方法
1.1 实验材料
DMEM培养基(美国Invitrogen公司),胰蛋白酶(美国Gibco公司),辣根过氧化物酶标记的山羊抗小鼠IgG抗体(北京中杉金桥生物技术有限公司),小鼠抗GAPDH抗体(上海康成生物工程有限公司),Westren Blot发光剂(美国 Thermo公司),FITC-Phalloidin(鬼笔环肽)(美国 Sigma公司),PAkt1抗体及HA抗体(美国Cell Signaling Technology公司),Akt1抗体(美国Abcam公司)。
1.2 真核表达载体的构建
提取HUVEC的RNA,反转录为cDNA,应用以下引物扩增EBP50的全长序列,并在扩增的序列两端引 入 EcoRI和 XhoI酶 切 位 点 forward:AGAGAATTCAGCGCGGACGCAGCGG; reverse:CCGCTCGAGTCAGAGGTTGCTGAAGAGT,将表达载体pBK-CMV-HA和扩增的EBP50的全长序列分别用EcoRI和XhoI双酶切成粘端,凝胶电泳后切胶回收,连接,转化大肠杆菌DH5α,抗性筛选。获取阳性克隆后,提取质粒进行测序,确证所得的 pBKCMV-HA-EBP50阳性克隆具有正确的序列及读码框。
1.3 稳定转染细胞系的建立及鉴定
HUVEC在含10%小牛血清的DMEM-F12培养基中,于37℃、5%CO2的培养箱中培养。以2 μg重组质粒DNA通过脂质体(HifectinII)介导转染HUVEC,用含有浓度为 400 μg/ml G418(Geneticin,庆大霉素的氨基糖苷)的筛选培养基筛选3~4周后得到抗性细胞克隆。消化分离后用G418的维持培养基(200 μg/ml)进行培养和传代。稳定转染pBK-CMV-HA-EBP50的HUVEC细胞株命名为EBP50-HUVEC,稳定转染pBK-CMV-HA的HUVEC细胞株命名为HA-HUVEC。分别将两种细胞接种于60 mm细胞培养皿,待细胞贴壁并生长至密度约80%后,分别提取细胞总蛋白,应用Western blot方法检测细胞内目的蛋白的含量:通过HA抗体检测外源性转入的EBP50蛋白的表达水平,用Image J图像分析系统对Western blot实验结果进行扫描分析。
1.4 MTT法检测细胞增殖
将两种稳定转染后的HUVEC分别消化成细胞悬液,将细胞按照1 ×103个/孔,每孔200 μl接种至96孔板中,培养板置37℃培养,每隔24 h分别取每组细胞的3个复孔,每孔中加入20 μg MTT,继续培养 4 h,然后吸出培养液,加入100 μl DMSO,37℃10 min,492 nm处测定吸光度。
1.5 划痕法检测细胞的迁移能力
将两种稳定转染后的HUVEC分别接种至96孔培养板,待细胞密度长至100%,用100 μl微量移液枪头对两组细胞进行划痕,PBS冲洗细胞2次,分别加入无血清培养基,置于培养箱中培养16 h,对两组细胞划痕进行照相,取10个培养孔计算迁移到划痕内的细胞数。
1.6 Matrigel法检测细胞的成管能力
将Matrigel胶置于4℃冰箱中2 h,使其完全溶解,向预冷的96孔板中加入Matrigel胶,每孔80 μl,37℃放置1 h成胶,将两种稳定转染后的HUVEC分别消化成细胞悬液,接种于已铺好胶的96孔板中,每孔100 μl,置于培养箱中培养12 h后进行照相,取6个培养孔观察并计算血管腔的数目。
1.7 Western blot检测
将两种稳定转染后的HUVEC分别接种至60 mm培养皿,待细胞密度长至80%,提取各组细胞总蛋白,取各组细胞裂解液 20 μl,经 8%SDS-PAGE后,转移到硝酸纤维素膜上,封闭1 h。一抗4℃孵育过夜,耦联有辣根过氧化物酶的二抗室温反应1 h,采用ECL显色方法进行显色。用Image J图像分析系统对Western blot实验结果进行扫描分析。
1.8 明胶酶谱分析
用含0.1%明胶的8%SDS-PAGE检测基质金属蛋白酶(MMP)-2和MMP-9活性。取各组细胞无血清培养48 h的培养液20 μl,120V恒压电泳2.0~2.5 h,凝胶经2.5%TritonX-100漂洗3次后,加入反应缓冲液(pH7.6,50 mmol/L Tris-HCl,10 mmol/L CaCl2,50 mmol/L NaCl,0.05%Brij35),37℃ 孵 育 17 h,0.5%考马斯亮蓝染色1.5~2.0 h,脱色液(10%乙酸-40%甲醇)脱色至蓝色背景下白色条带清晰可见。用Image J图像分析系统对实验结果进行扫描分析。
1.9 细胞免疫荧光法观察细胞微丝骨架(F-actin)的变化
利用鬼笔环肽荧光探针(FITC-Phalloidin)对微丝作直接荧光染色。具体步骤如下:将两种稳定转染后的HUVEC分别接种至玻璃底培养皿,培养至密度达50%,PBS洗细胞3次;4%中性多聚甲醛室温固定15 min,PBS洗3次;0.1%TritonX-100处理细胞5 min,PBS洗3次;滴加1∶200稀释的 FITCPhalloidin,于湿盒中室温避光30 min,PBS洗3次;将染色后的细胞玻片置于激光扫描共聚焦显微镜(Eclipse TE2000-U,Nikon,Tokyo,日本)下观察。
1.10 统计学方法
采用SPSS 11.0统计学软件对数据进行分析,计量资料用表示,所有实验重复3次,各样本首先进行方差齐性分析,生长曲线测定结果用重复测量数据t检验进行分析,其他实验均再采用独立样本t检验对数据进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 HUVEC内源性EBP50的表达
应用RT-PCR方法检测发现,HUVEC的RNA反转录为cDNA后,可以从中扩增出EBP50片段,如图1所示,HUVEC细胞中有内源性EBP50的表达。
2.2 稳定转染细胞系的鉴定
为获得稳定过量表达外源性EBP50的阳性克隆,应用Western blot方法检测转染了pBK-CMVHA-EBP50及pBK-CMV-HA的HUVEC的两组细胞内目的蛋白的含量,如图2所示,应用HA抗体检测显示,转染了空白载体pBK-CMV-HA的HUVEC内未检测到外源性融合蛋白的表达,而转染了pBKCMV-HA-EBP50的HUVEC内在相对分子量50000处可见外源性融合蛋白的表达。
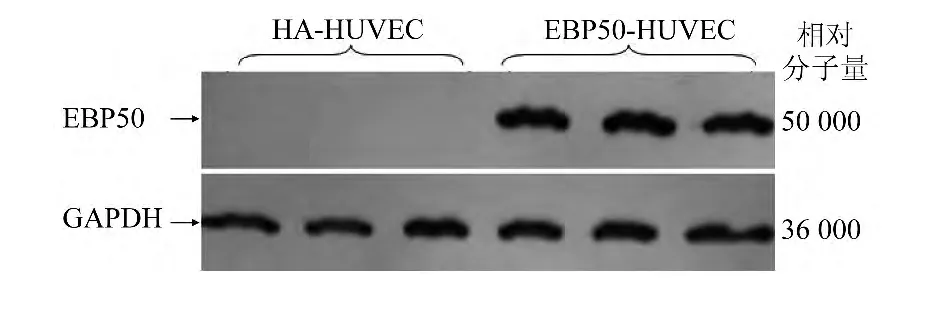
图2 稳定表达EBP50的HUVEC的鉴定
2.3 EBP50对HUVEC增殖的影响
采用MTT法检测HA-HUVEC及EBP50-HUVEC的增殖能力,见图3。
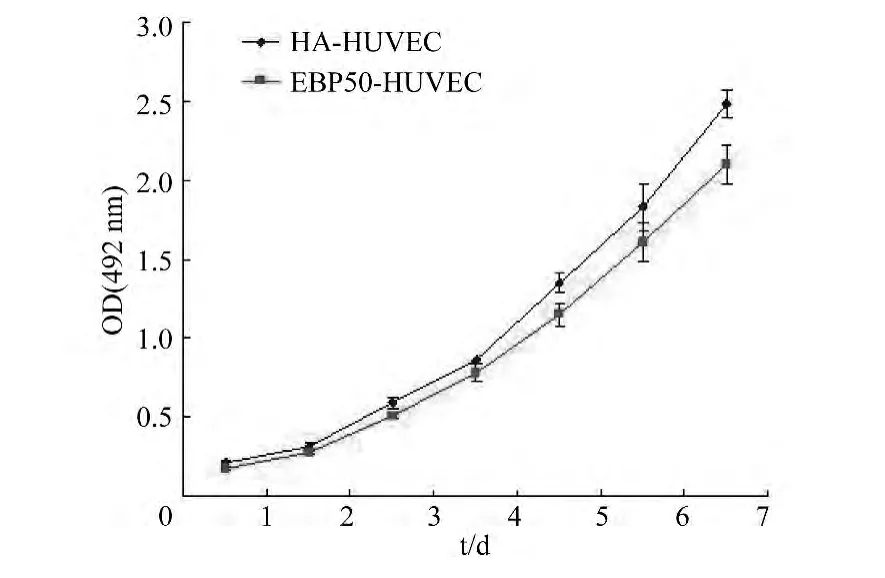
图3 EBP50对HUVEC增殖能力的影响
2.4 EBP50对HUVEC迁移能力的影响
采用划痕法检测HA-HUVEC及EBP50-HUVEC的迁移能力,见图4,与 HA-HUVEC相比,EBP50-HUVEC的迁移能力明显下降约20%(t=2.89,P<0.01)。
2.5 EBP50对HUVEC成管能力的影响
采用 Matrigel法检测 HA-HUVEC及 EBP50-HUVEC的成管能力,见图5。
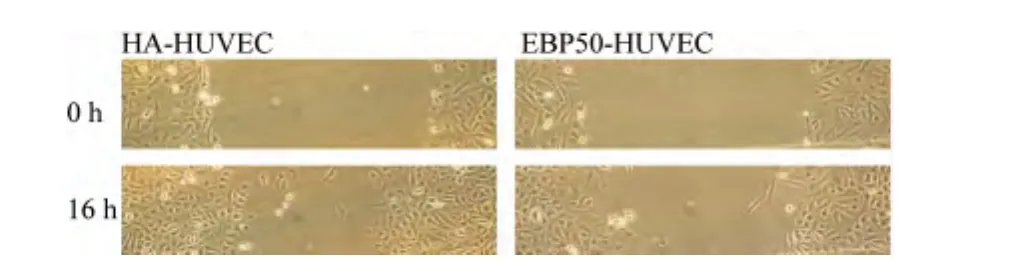
图4 EBP50对HUVEC迁移能力的影响
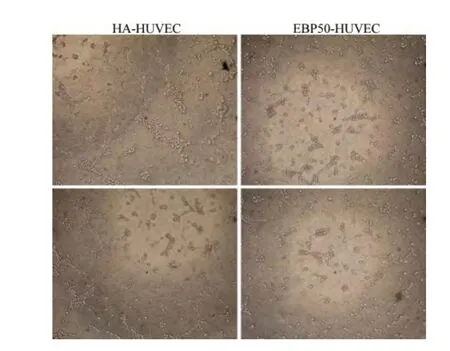
图5 EBP50对HUVEC成管能力的影响
2.6 EBP50表达对HUVEC Akt1磷酸化水平的影响
采用Westernblot法检测HA-HUVEC及EBP50-HUVEC的 Akt1的磷酸化水平,见图6,与HA-HUVEC相比,EBP50-HUVEC Akt1的磷酸化的水平明显下降约40%(t=2.98,P<0.01)。
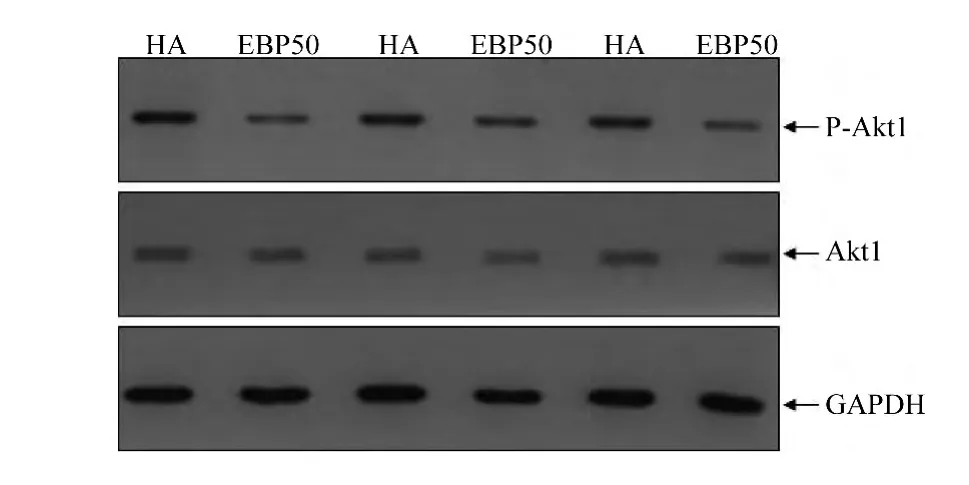
图6 EBP50表达降低HUVEC内Akt1的磷酸化水平
2.7 EBP50表达对HUVEC分泌的明胶酶活性的影响
采用明胶酶谱法检测HA-HUVEC及EBP50-HUVEC内的明胶酶的活性,如图7,与HA-HUVEC相比,EBP50-HUVEC内MMP2的活性下降约50%(t=4.75,P<0.01),而MMP-9的活性无明显改变。
与HA-HUVEC相比,EBP50-HUVEC内 MMP2的活性下降约50%(t=4.75,P<0.01),而MMP-9的活性无明显改变。
2.8 EBP50表达对细胞微丝骨架分布影响的研究
采用免疫细胞化学法检测HA-HUVEC及EBP50-HUVEC内微丝骨架的分布,见图8。

图7 EBP50表达对HUVEC分泌的明胶酶活性的影响
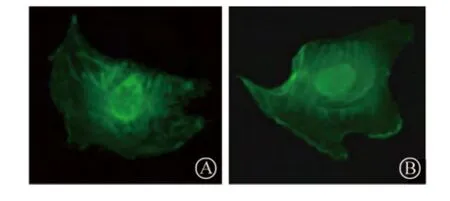
图8 EBP50表达对HUVEC微丝骨架分布的影响
3 讨论
EBP50是一个包含358个氨基酸的蛋白质,在组织中分布广泛。由氨基端两个串联PDZ结构域(PDZ-1和PDZ-2)和羧基端的ERM结构域构成。EBP50能够结合30余种蛋白质,包括脾源性酪氨酸激酶(spleen tyrosine kinase,SYK)[5]、磷酸酶与张力蛋白同源物(phosphataseandtensinhomolog,PTEN)[6]、血 小 板 衍 生 生 长 因 子 受 体 (plateletderived growth factor receptors,PDGFR)[6-8]、磷脂酶Cβ(phospholipase Cβ,PLCβ)、β-环 连 蛋 白 (βcatenin)和ERM家族蛋白[9-10]等,调节和整合多种信号通路。近年来对于EBP50的研究集中在其抑癌能力,该能力可能是通过与多种抑癌蛋白(如磷酸化肿瘤抑制基因、膜突蛋白及酪氨酸激酶等)的相互作用及增强抑癌蛋白的稳定性并与致癌蛋白结合而对其致癌功能进行抑制而实现的[5,9-12]。Simoncini等[13]曾在HUVEC内检测到EBP50的表达并推测其可能在血管的发生过程中起一定作用。Song等[14]研究发现,EBP50仅在正常的血管内皮细胞内表达,而在血管平滑肌细胞内几乎不表达,但在损伤后,EBP50在血管平滑肌细胞内的表达明显增高,特别是在血管成形的过程中,EBP50在形成新的血管内膜的细胞中表达明显增高。这些研究均提示EBP50可能在血管的发生发展过程中起着重要的作用。我们的前期研究结果显示,EBP50是在血管新生过程中表达显著上调的基因之一[4],在本研究中发现,EBP50能显著抑制HUVEC的增殖、迁移和成管能力。
磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)信号参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。近年来发现,IA型PI3K和其下游分子蛋白激酶B(PKB或Akt1)所组成的信号通路与人类肿瘤的发生发展密切相关。该通路调节肿瘤细胞的增殖和存活,其活性异常不仅能导致细胞恶性转化,而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等相关,目前以PI3K-Akt1信号通路关键分子为靶点的肿瘤治疗策略正在发展中。现有研究表明,在一些肿瘤细胞中,EBP50对Akt1信号通路起负性调控作用。Cardone等[15]研究表明,EBP50通过它的两个 PDZ结构域调节细胞的转移能力和亲器官性。
MMP家族与细胞迁移和增殖密切相关。明胶酶是MMP家族成员之一,包括MMP-2和MMP-9,两者均以酶原形式分泌,相对分子量分别为72000和92(或95000),活化后前者相对分子量为68000、66000或62000,后者相对分子量为88000或85000。明胶酶的底物包括明胶、Ⅳ、Ⅴ、Ⅶ、Ⅹ型胶原和纤连蛋白。在体内明胶酶可降解基底膜的主要结构成分之一Ⅳ型胶原,对肿瘤细胞穿过细胞外基质及转移至关重要,因而该酶与肿瘤的发生发展密切相关。
细胞骨架是细胞内蛋白质组成的网络系统,包括微管、微丝和中等纤维。微丝是调节细胞贴壁、伸展和形态的主要结构,在细胞行使多种功能如增殖时发挥重要作用,也是细胞骨架中与凋亡信号分子关系最密切的成员。细胞分化和运动时微丝骨架会发生重组,微丝骨架可能起着介导胞外信号分子的作用[5,7-8]。Phalloidin 能够特异性结合微丝骨架应力纤维主要成分F肌动蛋白,因而采用激光扫描共聚焦显微镜可以很好地观察细胞中F肌动蛋白的动态变化。Sun等[16]研究表明,cdc2/cyclin B能够调节EBP50的磷酸化水平,进而通过影响细胞骨架重组调节细胞的黏附和形态的改变。
综上所述,EBP50可抑制HUVEC的增殖和迁移,此作用可能与其调整Akt1的磷酸化水平、调节细胞分泌明胶酶的活性及影响微丝细胞骨架分布有关。
[1]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285:1182-1186.
[2]Carmeliet P,Jain RK.Angiogenesis in cancer and other diseases[J].Nature,2000,407:249-257.
[3]Auerbach R,Lewis R,Shinners B,et al.Angiogenesis assays:a critical overview[J].Clin Chem,2003,49:32-40.
[4]Peng Chen,Ye Wang,Lingling Yang,et al.Novel bioactivity of NHERF1 in corneal neovascularization[J].Graefes Arch Clin Exp Ophthalmol,2012,250:1615-1625.
[5]Dai JL,Wang L, Sahin AA, et al. NHERF(Na+/H+exchanger regulatory factor)gene mutations in human breast cancer[J].Oncogene,2004,23:8681-8687.
[6]Takahashi Y,Morales FC,Kreimann EL,et al.PTEN tumor suppressor associates with NHERF proteins to attenuate PDGF receptor signaling[J].EMBO J,2006,25:910-920.
[7]Maudsley S,Zamah AM,Rahman N,et al.Platelet-derived growth factor receptor association with Na+/H+exchanger regulatory factor potentiates receptor activity[J].Mol Cell Biol,2000,20:8352-8363.
[8]James MF,Beauchamp RL,Manchanda N,et al.A NHERF binding site links the betaPDGFR to the cytoskeleton and regulates cell spreading and migration [J].J Cell Sci,2004,117:2951-2961.
[9]Murthy A,Gonzalez-Agosti C,Cordero E,et al.NHE-RF,a regulatory cofactor for Na+-H+exchange,is a common interactor for merlin and ERM(MERM)proteins[J].J Biol Chem,1998,273:1273-1276.
[10]Reczek D,Berryman M,Bretscher A.Identification of EBP50:a PDZ-containing phosphoprotein that associates with members of the ezrin-radixin-moesin family [J].J Cell Biol,1997,139:169-179.
[11]Georgescu MM,Morales FC, MolinaJR, etal. Rolesof NHERF1/EBP50 in cancer[J].Curr Mol Med,2008,8:459-468.
[12]Mamonova T,Kurnikova M,Friedman PA.Structural basis for NHERF1 PDZ domain binding[J].Biochemistry,2012,51:3110-3120.
[13]Simoncini T,Scorticati C,Mannella P,et al.Estrogen receptor alpha interacts with Galpha13 to drive actin remodeling and endothelial cell migration via the RhoA/Rho kinase/moesin pathway[J].Mol Endocrinol,2006,20:1756-1771.
[14]Song GJ,Barrick S,Leslie KL,et al.EBP50 inhibits the antimitogenic action of the parathyroid hormone type 1 receptor in vascular smooth muscle cells[J].J Mol Cell Cardiol,49:1012-1021.
[15]Cardone RA,Greco MR,Capulli M,et al.NHERF1 acts as a molecular switch to program metastatic behavior and organotropism via its PDZ domains[J].Mol Biol Cell,2012,23:2028-2040.
[16]Sun C,Zheng J,Cheng S,et al.EBP50 phosphorylation by Cdc2/cyclin B kinase affects actin cytoskeleton reorganization and regulates functions of human breast cancer cell line MDA-MB-231[J].Mol Cells,2013,36:47-54.