基于吲哚半花菁结构的比值式p H荧光探针
2014-10-17周彬彬龙一国
曾 科,周彬彬,龙一国
(1.中南大学化学化工学院,湖南长沙 410083;2.湖南省食品质量监督检验研究院,湖南长沙 410000)
具有类花菁染料结构的化合物具有优越的光谱性能[1-3],当前已被广泛应用于生物标记[4-5]、荧光成像[6-8]、靶向治疗等[9]诸多领域。同时,由于该类分子的光谱性能对周围环境的变化异常敏感,也常被用于研究溶剂极性性质[10-11]。基于花菁类染料对周围化学环境敏感这一特点[12],目前,采用该结构并将其应用于溶液pH值检测的工作少有报道[13]。显然,合理设计花菁染料并研究其pH响应过程对该类分子的环境敏感行为研究具有重要意义。
本文设计合成了一种吲哚类半花菁探针,研究了该探针随pH值变化而产生的光谱性质改变以及其分子结构的影响,并研究了其细胞毒性,希望能为该类染料在生物领域进一步应用提供参考。
1 实验部分
1.1 试剂与仪器
二甲基亚砜、苯肼、3-甲基-2-丁酮、对羟基苯甲醛均为分析纯。
F4600荧光分光光度计;UV-2450紫外-可见分光光度计;Bio-TeK ELx800型酶联免疫检测仪。
1.2 实验方法
探针的合成路线如下:
1-乙基-2-[2-(4-羟基苯基)-乙烯基]-3,3-二甲基吲哚氢碘化物(CyP)

1.2.1 A的合成 将5 mL苯肼和15 mL 3-甲基-2-丁酮加至100 mL圆底烧瓶中,再加入冰醋酸25 mL,加热,120℃回流反应5 h。将反应溶液倒入约100 g碎冰中,静置于-20℃冰箱中2 h,取出,倒入分液漏斗,用二氯甲烷萃取,用饱和的氯化钠溶液洗涤,用无水硫酸钠干燥,旋蒸除去有机溶剂,用少量二氯甲烷溶解固体产物,用柱层析提纯,以石油醚/乙酸乙酯(v/v)=6∶1的混合溶剂作为淋洗液,45℃旋转蒸发除去淋洗液,得到中间产物A,产率80%。
1.2.2 B的合成 将4 g中间产物A和9 g碘乙烷溶于约60 mL无水乙腈中,加热回流过夜。将反应溶液冷却至室温,有固体析出,旋蒸除去乙腈,固体用乙酸乙酯淋洗,除去未反应的杂质,得到白色固体B。
1.2.3 CyP的合成 将0.2 g的中间产物 B和0.55 mmol对羟基苯甲醛溶于约20 mL无水乙醇中,氮气保护下加热回流12 h。旋蒸除去乙醇,用少量二氯甲烷溶解得到固体产物,用柱层析提纯,以二氯甲烷/甲醇(v/v)=10∶1的混合溶剂作为淋洗液,得到探针 CyP。1H NMR(500 MHz,DMSO)δ10.88(1H,s),8.42(1H,d,J=16.1),8.16(2 H,d,J=8.8),7.89 ~7.85(2H,m),7.64 ~7.56(2H,m),7.48(1H,d,J=16.1),6.97(2H,d,J=8.8),4.66(2H,q,J=7.2),1.78(6H,s),1.43(3H,s)。
1.3 工作溶液的配制
称取适量的探针CyP,溶于二甲亚砜(DMSO)中,配制成浓度为25 mmol/L的储存液。将适量储存液加入到浓度为10 mmol/L的不同pH值的缓冲溶液(pH为3~6,柠檬酸-柠檬酸钠缓冲溶液;pH为6~9,磷酸二氢钠-磷酸氢二钠缓冲溶液;pH为9~10.5,碳酸氢钠-碳酸氢钠缓冲溶液)中,得到DMSO含量5%(v/v),CyP探针浓度为10μmol/L的工作溶液,用于紫外-可见吸收光谱和荧光发射光谱的测定。
1.4 干扰金属阳离子的溶液配制
在10 mmol/L,pH=5.6 的柠檬酸-柠檬酸钠缓冲溶液中,分别配制金属离子浓度为20 mmol/L(NaCl,KCl)和 50 μmol/L(MgCl2,CaCl2,Zn(NO3)2,CuCl2,AgNO3,BaCl3,SnCl2)的测试溶液,用于离子干扰实验的荧光光谱测定。
1.5 细胞毒性实验
采用四唑盐比色法 (MTT法),对CyP探针的体外细胞毒性进行研究。
(1)收集对数生长期的HeLa细胞株,用0.25%胰蛋白酶进行消化,取每孔100μL接种于96孔培养板上,调整细胞悬浮液浓度至5×103cells/孔。置于37℃、5%CO2培养箱中过夜。
(2)含CyP的培养液的配制:用含有胎牛血清的DMEM培养液配制一系列不同浓度的含CyP的培养液。待细胞贴壁后,吸弃旧的培养液,向每孔100μL含CyP的培养液,每个浓度设5个复孔,同时设置只加培养液的调零孔和只加细胞悬浮液、不加CyP的对照孔。CyP设有6个浓度梯度,分别为0.1,0.5,5,10,50,150 μmol/L。继续培养 48 h,并在倒置显微镜下观察细胞形态。达到指定的培养时间后,每孔加入含有MTT且浓度为5 mg/mL的培养液200μL,再向每个孔中加入100μL的DMSO,溶解紫色结晶。用Bio-TeK ELx800型的酶联免疫检测仪测定各孔的吸光度OD,选490 nm为测定波长,以635 nm作为参考波长,重复测3次。以不加CyP的细胞作为对照组,计算不同CyP浓度组的细胞生长存活率。
2 结果与讨论
2.1 探针溶液紫外-可见吸收光谱分析
探针溶液紫外-可见吸收光谱分析,见图1。
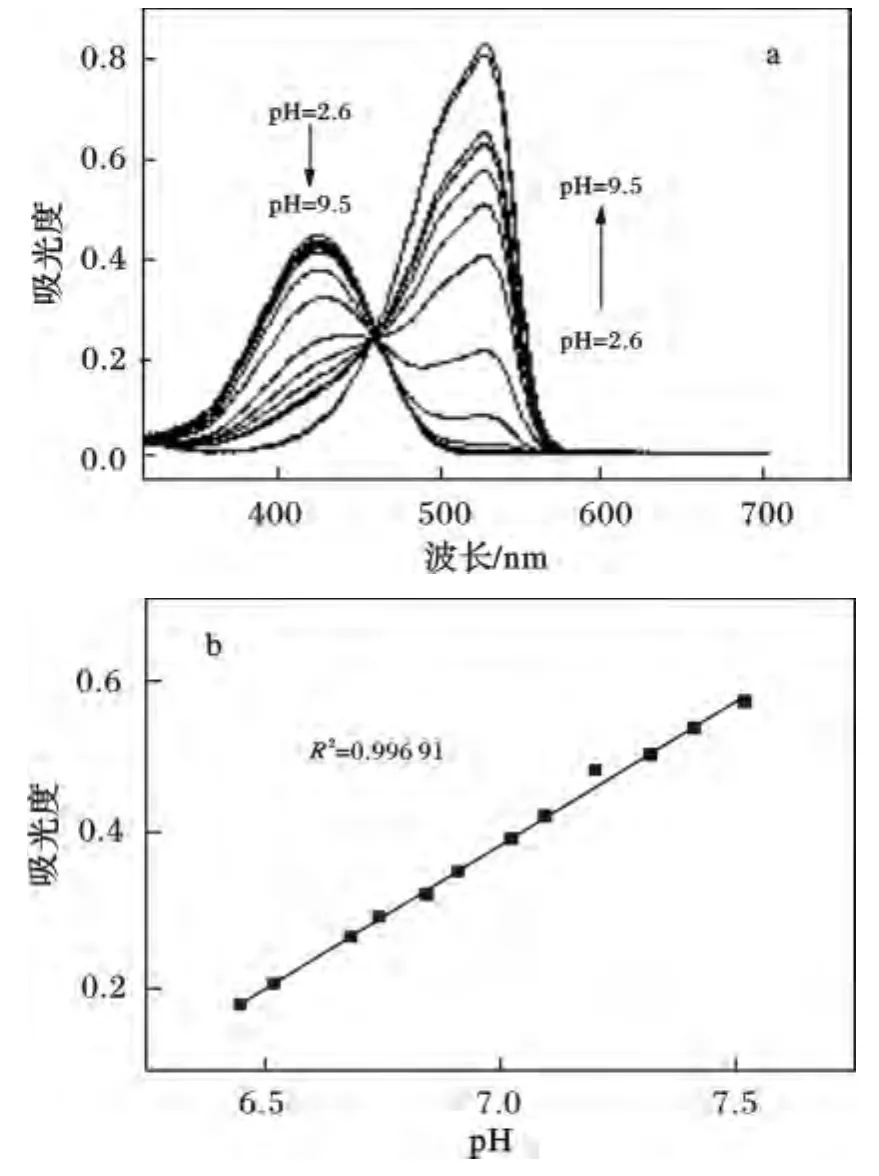
图1 在DMSO/缓冲溶液(DMSO 5%,v/v)中,探针的紫外吸收光谱Fig.1 UV-Vis absorption spectra with pH increase from 2.6 to 9.5
由图1可知,在较低pH情况下(pH <5),探针溶液的紫外吸收光谱仅在422 nm处有吸收峰,当pH逐渐增大(pH >5),该处吸收峰的强度逐渐降低,同时在525 nm处出现新的吸收峰,随着pH增大,525 nm处吸收峰值逐渐增大,当 pH=9.5时,525 nm处吸收峰达到最大值。同时,探针溶液在457 nm处有等吸收点,意味着探针在酸碱环境下,存在着两种状态的平衡。整个变化过程紫外光谱出现了明显的红移(约100 nm),所以当pH由5上升至8时,溶液的颜色由亮黄色转变为橙色,最终变为红色,且变化非常明显。这意味着该探针同时具有裸眼检测的潜在应用价值。
2.2 探针荧光光谱的分析及其p K a值计算
当波长为430 nm激发光激发时,探针在pH4.8~8.4范围内的荧光发射光谱见图2。

图2 在DMSO/缓冲溶液(DMSO 5%,v/v)中,探针的荧光发射光谱(λex=430 nm)Fig.2 Fluorescence emission spectra with pH increase from 4.8 to 8.4(λex=430 nm)
由图2可知,随着pH升高,513 nm处荧光发射峰强度逐渐下降,至pH=8.4时完全消失,同时在550~560 nm处荧光发射峰逐渐上升。取两荧光峰513 nm处的荧光强度与553 nm处的荧光强度的比值(I513nm/I553nm),考察其与pH的关系,发现在pH 5.4~7.2 范围内,I513nm/I553nm的值与 pH 值有良好的线性关系(见图 2,R2=0.990 23),说明在 pH 5.4~7.2范围内可以通过513 nm与553 nm荧光强度的比值检测溶液的pH。
波长为520 nm激发光激发时,荧光发射光谱见图3,当pH <4.3时,探针溶液无明显的荧光发射峰,当pH >4.3时,在560 nm处出现明显的荧光发射峰,随着pH增大,发射峰强度明显增大,至pH=8时达到最大值。根据亨德森-哈塞尔巴尔赫方程,通过对不同pH值下560 nm处发射峰强度的计算,得出该探针溶液的p Ka值约为6.25(见图3C)。同时探针在pH 6.0~7.2范围内560 nm处峰强度与pH值有较好的线性关系。
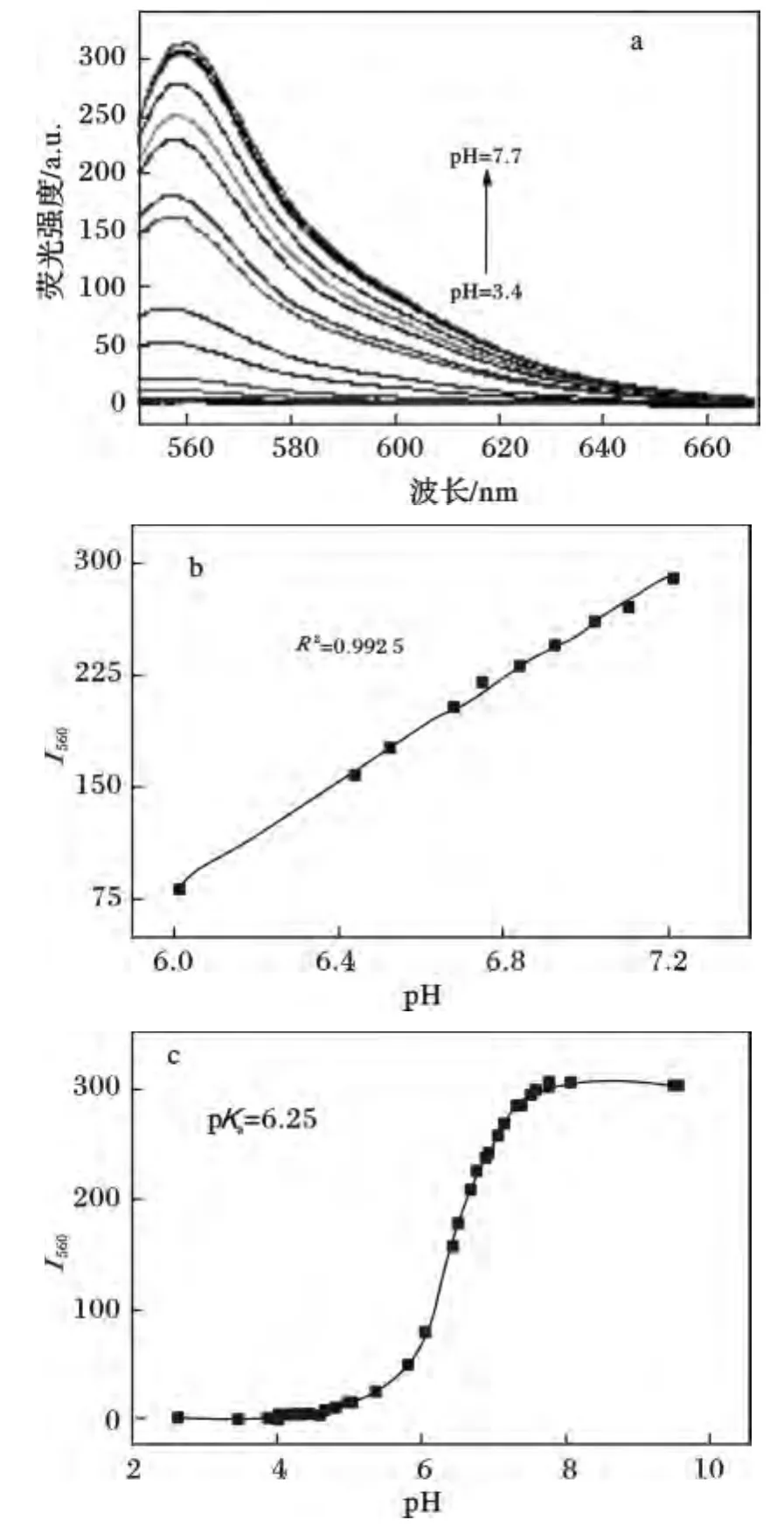
图3 在DMSO/缓冲溶液(DMSO 5%,v/v)中,探针的荧光发射光谱(λex=520 nm)Fig.3 Fluorescence emission spectra with pH increase from 3.4 to 7.7(λex=520 nm)
2.3 探针的选择性分析
选取常见金属离子作为干扰物质进行检测分析。待测阳离子种类及浓度为 Na+,K+(50 mmol/L),Mg2+、Ca2+、Zn2+、Cu2+、Ag+、Ba2+、Sn2+(50 μmol/L),缓冲液 pH=5.4,结果见图4。

图4 探针对常见阳离子的选择性Fig.4 Selectivity of the probe for common cation
由图4可知,在相同pH情况下,不同阳离子的加入,对探针I513nm/I553nm荧光强度的比值基本无影响,说明该探针可在不同的离子环境下对pH的变化进行检测。
2.4 探针的细胞毒性分析
为了进一步验证该探针具有在生物体内检测pH值的可能,我们首先对探针的细胞毒性进行了研究,将不同浓度的探针与HeLa细胞培养48 h,结果见图5。
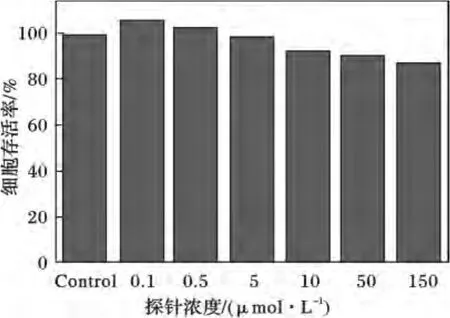
图5 探针与HeLa细胞培养48 h的细胞存活率Fig.5 Cell viability of probe against HeLa cells at various probe concentration after 48 h
由图5可知,随着探针浓度的增加,HeLa细胞的存活率略微下降,当培养浓度远大于工作浓度时(100μmol/L),细胞存活率仍大于80%,说明该探针具有较高的生物相容性,对细胞的毒副作用较小。因此,该探针具有较好的体内应用价值。
2.5 检测机理讨论
该探针的检测机理见图6,当pH <4.3时,探针分子中的酚羟基处于未解离状态,此时分子骨架整体电子云极化度较小,呈现强度较弱的短波长荧光发射,当pH >4.3时,探针分子中的酚羟基氢发生解离,结构变为酚氧负离子,该结构具有很强的供电能力,与吲哚环上的正电荷构成D-π-A结构,此时分子骨架整体电子云极化度变大,产生ICT效应,使得分子荧光发射光谱向长波长移动,波长560 nm处出现明显的荧光发射峰。随着pH值升高,溶液中电离的分子比例加大,至pH=8时,全部电离,该处荧光发射峰强度达到最大值。同时,溶液的颜色由酸性条件下的亮黄色转变为橙色,最终变为碱性条件下的红色。
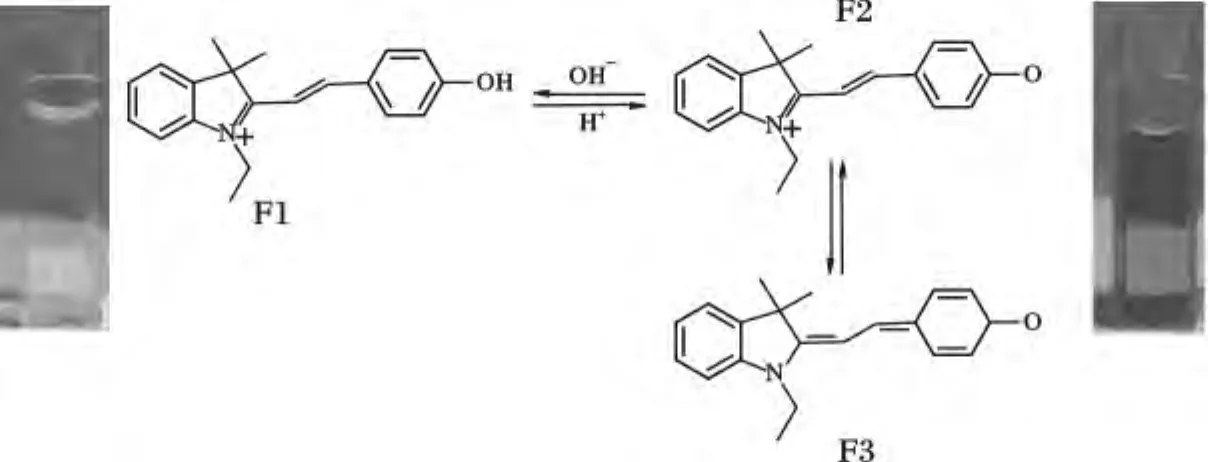
图6 探针检测机理及不同pH下的溶液颜色对比Fig.6 Detection mechanism of CyP and the color change at different pH
为进一步验证反应的pH响应机制,采用密度泛函理论对实验结果进行了初步模拟计算。对化合物在酸性条件下存在形式(F1型结构)及其碱性条件下存在形式(F2型结构)进行了优化,其优化的结构表明相比F1的羟基结构,F2的酚氧负离子结构更易于异构化为吸收及发射光谱波长较长的酮式结构F3。结构F1的HOMO和LUMO轨道能级均较结构F3低,且其能级差小于结构F3(见表1),这种趋势与光谱波长的移动是一致的。从C—O键的键长方面比较,在结构F1中,C—O键长高于结构F3中的C—O键长,说明结构F3中电荷分布更为均匀,能级更低。
由此,我们认为在pH较高的条件下,结构F1容易失去质子变为酚氧负离子,同时,发生异构化,转变为吸收及发射光谱波长较长的酮式结构F3(见图7)。这一过程导致了不同pH条件下的光谱差异。

表1 F1,F3结构的密度泛函理论计算结果(HOMO,LUMO及C—O键长)Table 1 Result of DFT with HOMO,LUMO and C—O bond length
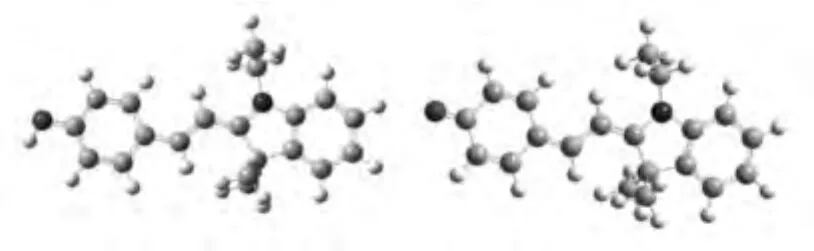
图7 探针的密度泛函理论优化分子结构(左F1,右F3)Fig.7 DFT optimized structures of CyP F1(phenol configuration,left),F3(enol configuration,right)
3 结论
设计合成了一种用于检测pH值的比值式荧光探针,研究了探针在溶液中随pH值变化所产生的紫外-可见吸收光谱和荧光发射光谱变化,当激发波长为430 nm时,其发射峰强度的比值I513nm/I553nm的变化与pH值(pH 5.4~7.2)具有良好的线性关系,且探针溶液的颜色随pH值变化有明显改变,并对探针的响应机理进行了理论计算和探讨。同时对探针的细胞毒性进行了研究,发现探针在工作浓度下具有较低细胞毒性的特性。因此该探针有进一步应用于体内检测生物体内pH值的潜在应用价值。
[1] Greville Williams C.Researches on chinoline and its homologues[J].Transactions of the Royal Society of Edinburgh,1857,21(3):377-401.
[2] Zholt Kormosh,Yaroslav Bazel,Andriy Tolmachov.The state and chemical analytical properties of certain polymethine dyes in aqueous solutions[J].Acta Chimica Slovenica,2002,49:795-804.
[3] 陈秀英.新型3H吲哚荧光菁染料的合成与性能研究[D].大连:大连理工大学,2006:62-76.
[4] Stefka Kaloyanova,Ivo Crnolatac,Nedyalko Lesev,et al.Synthesis and study of nucleic acids interactions of novel monomethine cyanine dyes[J].Dyes and Pigments,2012,92(3):1184-1191.
[5] 费学宁,刘丽娟,张宝莲,等.荧光染料探针分子对变异细胞的识别[J].化学进展,2006,18(6):801-807.
[6] Jorge O Escobedo,Oleksandr Rusin,Soojin Lim,et al.NIR dyes for bioimaging applications[J].Current Opinion in Chemical Biology,2010,14:64-70.
[7] 施峰,李宏洋,彭孝军.生物分析用近红外荧光染料研究进展[J].精细化工,2003,20(5):268-272.
[8] Lin Yuan,Lin Weiying,Zheng Kaibo,et al.Far-red to near infrared analyte-responsive fluorescent probes based on organic fluorophore platforms for fluorescence imaging[J].Chemical Society Reviews,2013,42:622-661.
[9] Maged Henary,Andrew Levitz.Synthesis and applications of unsymmetrical carbocyanine dyes[J].Dyes and Pigments,2013,99:1107-1116.
[10] Cunderlíková B,ikurová L.Solvent effects on photophysical properties of merocyanine 540[J].Chemical Physics,2001,263:415-422.
[11] John OMorley,Richard M Morley,Robert Docherty,et al.Fundamental studies on Brooker’s merocyanine[J].Journal of American Chemical Society,1997,119:10192-10202.
[12] Andérs-Bello A,Barreto-Palacios V,García-Segovia P,et al.Effect of pH on color and texture of food products[J].Food Engineering Reviews,2013,5:158-170.
[13] Zeng Lintao,Fan Ne,Zha Jiayu.A novel and photostable pH probe for selectively staining nucleus in living cells[J].Analyst,2013,138:7083-7086.
