FQ-PCR法检测人骨肉瘤MG63细胞系中β-catenin基因表达
2014-09-27,,,,
,,,,
(1 青岛大学医学院附属医院脊柱外科,山东 青岛 266003; 2 中国人民解放军第107医院)
·肿瘤学研究·
FQ-PCR法检测人骨肉瘤MG63细胞系中β-catenin基因表达
张鹏1,李书忠1,张明进1,张豹1,曲邵政2
(1 青岛大学医学院附属医院脊柱外科,山东 青岛 266003; 2 中国人民解放军第107医院)
目的研究β-catenin基因在人骨肉瘤MG63细胞内表达的变化。方法培养人骨肉瘤MG63细胞,不同浓度Wnt3a及WIF-1蛋白刺激MG63细胞,用实时荧光定量PCR(FQ-PCR)法测定细胞中β-catenin mRNA表达水平。培养人骨肉瘤MG63细胞,用90 μg/L的Wnt3a及WIF-1刺激细胞,分别于12、24、48、72、96 h对各组细胞进行计数,观察空白组、Wnt3a及WIF-1组细胞数目变化情况。结果不同浓度WIF-1组β-catenin mRNA表达差异有统计学意义(F=215.58,P<0.05),随着WIF-1浓度的增高而呈递减趋势;不同浓度Wnt3a组β-catenin mRNA的表达差异有统计学意义(F=185.64,P<0.05),随着Wnt3a浓度的增高而呈递增趋势。空白组细胞增殖情况优于WIF-1组,低于Wnt3a组,差异有统计学意义(F=4.88,P<0.05)。结论不同浓度Wnt3a及WIF-1刺激下β-catenin基因在人骨肉瘤MG63细胞内表达的变化,证明wnt/β-catenin信号通路对人骨肉瘤MG63细胞有重要的调控作用。
骨肉瘤;基因,β-catenin;聚合酶链反应
骨肉瘤是儿童及青少年时期常见的骨肿瘤之一,好发于10~20岁,约占骨恶性肿瘤的20%[1-2]。近年来,化疗方案的完善及化疗药物的更新使得骨肉瘤病人的生存率有了明显的提高[3-4]。然而,肺转移及骨肿瘤复发仍然是骨肉瘤病人长期生存的限制性因素。Wnt/β-catenin 信号转导通路在多种细胞的增殖、分化中扮演重要角色。 PEIFER等[5]研究显示,Wnt信号在骨细胞的基因信号转导中起重要作用。本研究通过将外源性Wnt3a 及 WIF-1作用于MG63细胞,在基因水平观察β-catenin的表达情况,进而探讨Wnt/β-catenin 信号转导通路在骨肉瘤发病中的作用。
1 材料与方法
1.1主要材料
人骨肉瘤细胞株MG63(中国科学院上海生物细胞研究所),Wnt3a蛋白干粉、WIF-1蛋白(美国R&D公司),PCR试剂盒(TaKara公司),β-catenin、GAPDH引物(大连宝生物工程有限公司),胎牛血清(美国Hyclone公司)。
1.2实验方法
1.2.1细胞培养 MG63细胞株置于DMEM高糖培养液(添加体积分数0.10胎牛血清、100 kU/L青霉素及100 mg/L链霉素)中,在37 ℃、含体积分数0.05 CO2的培养箱中培养。待细胞70%融合时进行传代,吸除旧培养液,加入胰蛋白酶少许,以能覆盖瓶底为宜,倒置显微镜下观察到细胞胞质回缩、间隙增大时加入培养液以终止消化。吸管吸取培养液,轻轻反复吹打瓶壁细胞,使之呈细胞悬液。按1∶2比例进行传代。
1.2.2不同浓度Wnt3a、WIF-1蛋白刺激MG63细胞 取对数生长期的MG63细胞,传代后接种到6孔板中的5孔中,于恒温箱中进行培养。待每孔大约70%的细胞融合时,加入不同浓度的Wnt3a及WIF-1溶液刺激MG63细胞24 h。
1.2.3实时荧光定量PCR(FQ-PCR)法检测β-catenin基因的表达 对上述加入Wnt3a及WIF-1溶液培养24 h的细胞采用TRIzol法提取RNA,用紫外线分光光度计根据波长260 nm处的吸光度值测定RNA的纯度,并进行定量。用cDNA反转录试剂盒(code:DDR047S)反转录合成cDNA。用PCR试剂盒(Code:DRR081A)对目的基因及内参照进行扩增。β-catenin的上游引物为5′-TGAGGACAAGCCACAAGATTAC-3′,下游引物为5′-TCCACCAGAGTGAAAAGAACG-3′;GAPDH的上游引物为5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物为5′-GAAGATGGTGATGGGATTTC-3′。PCR反应体系为25 μL,含Premix Ex TaqTMⅡ(2×)12.5 μL,10 μmol/L PCR Forward Primer和Reverse Primer各1 μL,DNA模板2 μL,dH2O 8.5 μL。PCR反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。按照Livak公式计算目的基因β-catenin的相对表达量,其相对表达量采用2-△△CT表示。
1.2.4细胞形态学观察 将人骨肉瘤MG63细胞计数后等分接种于3盘30 mm×60 mm大小的培养基中,空白组用DMEM高糖培养液培养,Wnt3a组及WIF-1组分别用含90 μg/L Wnt3a、WIF-1的DMEM高糖培养液培养,培养相同时间后于倒置显微镜下观察细胞形态。
1.2.5Wnt3a及WIF-1蛋白刺激下细胞生长情况将处于对数生长期的MG63细胞接种于48孔培养板,其初始细胞数约为103个,空白组、Wnt3a组及WIF-1组分别用DMEM高糖培养液、含90 μg/L Wnt3a及WIF-1的DMEM高糖培养液培养。每天换液,各组分别于12、24、48、72、96 h取4孔细胞,滴入锥虫蓝染液后在计数器上计数。按每天细胞平均数目绘制细胞生长曲线。
1.3统计学分析
2 结 果
2.1不同浓度Wnt3a及WIF-1蛋白刺激下β-catenin mRNA的表达
空白组2-△△CT均为1;30、60、90、120 μg/L WIF-1组2-△△CT分别为0.55±0.05、0.44±0.04、0.35±0.04、0.24±0.03;30、60、90、120 μg/L Wnt3a组2-△△CT分别为1.96±0.06、2.08±0.15、2.84±0.09、3.29±0.17。随着WIF-1浓度的增高,β-catenin mRNA表达量下降,差异有统计学意义(F=215.58,P<0.05);随着Wnt3a浓度的增高,β-catenin mRNA表达量增加,差异有统计学意义(F=185.64,P<0.05)。
2.2细胞形态学观察
各组细胞均呈贴壁生长,细胞形态均呈梭形;Wnt3a组细胞较空白组细胞排列紧密,WIF-1组细胞较空白组细胞排列稀疏。
2.3细胞生长曲线的测定
以细胞培养时间为横坐标,细胞计数为纵坐标,绘制生长曲线。WIF-1组细胞增殖速度较空白组减慢,空白组细胞增殖速度较Wnt3a组减慢,差异有统计学意义(F=4.88,P<0.05)。见图1。
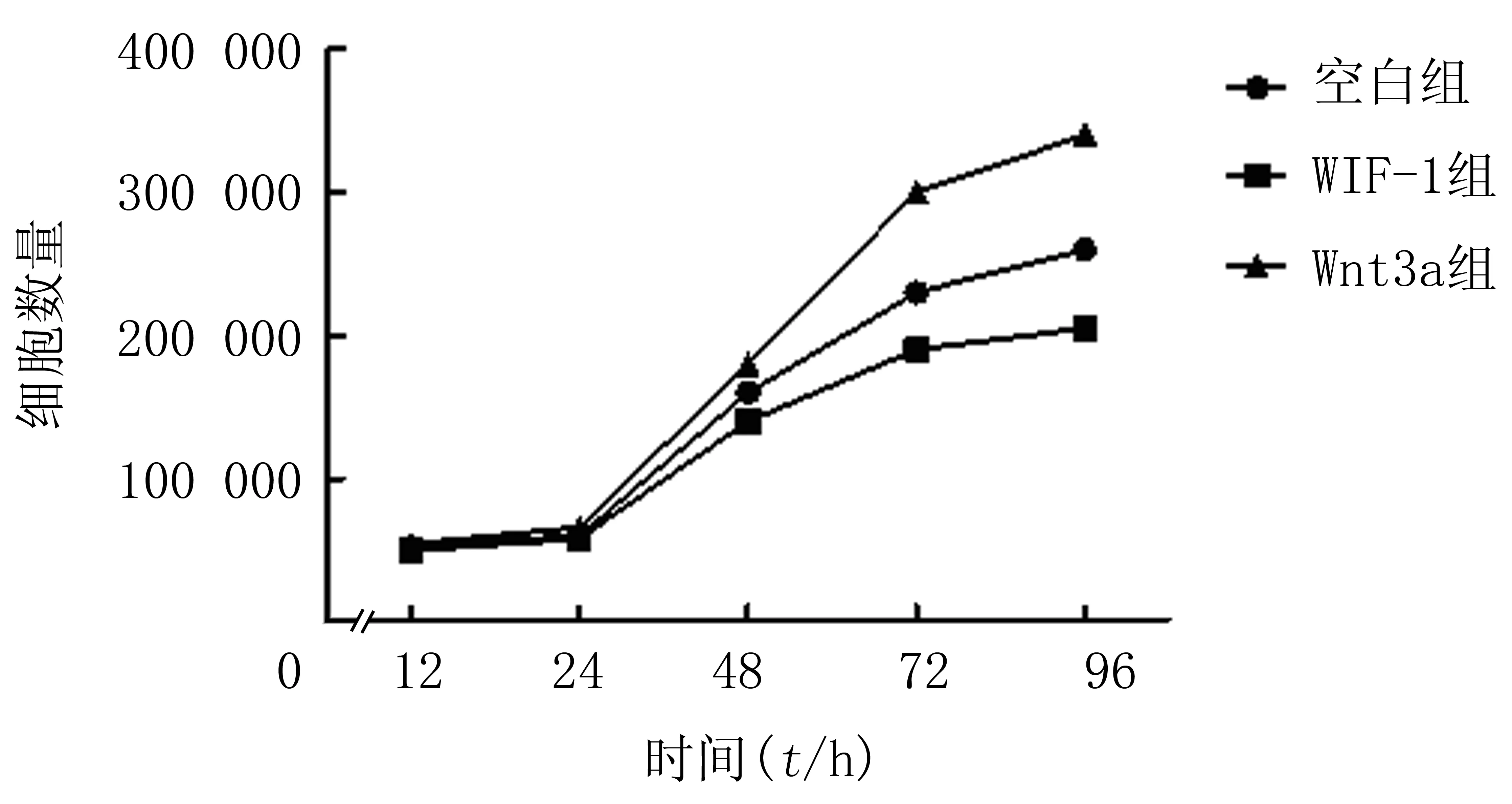
图1 各组细胞生长曲线
3 讨 论
骨肉瘤是青少年及年轻人最常见的恶性骨肿瘤之一[1-2,6]。近年来,新化疗药物虽屡屡出现,但转移瘤及骨肿瘤复发仍影响病人长期生存[7]。阐明骨肉瘤发生、转移及复发的机制,提供针对性靶向治疗是
目前最需迫切解决的问题。随着分子生物学的发展,包括p53基因、p16基因、 FFEN基因、Survivin、CTRP3等在内的骨肉瘤信号转导途径及作用逐步被发现,使人们对骨肉瘤发病机制有了新的认识。
在信号转导通路中,Wnts作为由半胱氨酸残基组成的分泌型糖蛋白家族,对组织细胞的生长发育发挥重要作用,因此,近年来受到了广泛关注[8]。Wnts信号转导通路包括经典型和非经典型通路两种。在经典型通路中,活化的Wnt与膜受体Fz及LRP5、6结合激活转导通路,促进下游Wnt靶基因的转录;抑制Wnt通路时,被酪蛋白激酶-1和GSK-3β磷酸化的β-catenin泛素化而使蛋白酶破坏,进而抑制Wnt靶基因转录[9]。非经典型Wnt通路主要包括Wnt/Ca2+、Wnt/PCP等信号通路,目前具体作用机制尚不清楚。
Wnt在多种细胞的分化、增殖及生长调节中起重要作用。KARIM等[10]结果表明,许多肿瘤的发生与Wnt信号转导通路有联系。MATSUDA[11]和LEE[12]的研究结果显示,Wnt信号在乳癌、肝癌的发病中起重要作用。HE等[13]也曾报道结直肠癌的发生与Wnt信号的紊乱有关。BARKER等[14]研究显示,活化的Wnt信号通路与多种人类肿瘤的发生紧密相关。CHEN等[15]研究显示,骨肉瘤可由Wnt10b诱导而产生,且肿瘤的迁移及生长与其相关。激活Wnt5a/Ror2信号转导通路,骨肉瘤细胞株U2OS侵袭性增强;其侵袭性也可因该通路的阻断而抑制[16]。HOANG等[17]研究显示,LRP5作为Wnt信号转导通路中重要受体,在骨肉瘤恶化进程中可以作为标志物来预测转归。而CAI等[18]研究显示,活化Wnt/β-catenin信号通路可抑制骨肉瘤细胞的增殖;失活的Wnt/β-catenin信号通路反而促进骨肉瘤的发生发展。
本实验体外培养人骨肉瘤MG63细胞,通过加入外源性Wnt3a及WIF-1蛋白来刺激经典Wnt信号通路,然后采用FQ-PCR技术检测细胞内β-catenin基因表达。FQ-PCR技术具有高扩增效率、高扩增灵敏度、高扩增特异性等优点,并且能在宽广的范围内进行更准确的定量[19-20]。实验表明,Wnt3a激活人骨肉瘤MG63细胞内Wnt/β-catenin信号通路,强化Wnt信号通路下游通路β-catenin,从而增加MG63细胞数量;WIF-1刺激下β-catenin mRNA表达量均降低,随着WIF-1浓度的增加,其表达抑制作用更明显。通过细胞生长曲线绘制及倒置显微镜下观察细胞形态及细胞生长密集程度也同样证实了该观点。本研究提示,Wnt/β-catenin信号通路在骨肉瘤细胞生长、增殖、凋亡中发挥了重要作用,为进一步研究骨肉瘤基因水平的分子靶向治疗提供了依据。但Wnt/β-catenin信号转导通路中具体分子的相互作用机制尚不清楚。另外,本研究局限于体外实验,体内Wnt/β-catenin的具体作用机制尚需进一步研究。
[1] NISWANDER L M, KIM S Y. Stratifying osteosarcoma:minimizing and maximizing therapy[J]. Curr Oncol Rep, 2010,12(4):266-270.
[2] 徐万鹏,冯传汉. 骨科肿瘤学[M]. 北京:人民军医出版社, 2008:6-7.
[3] MEYERS P A, SCHWARTZ C L, KRAILO M D, et al. Osteosarcoma: the addition of muramyl tripeptide to chemotherapy improves overall survival——a report from the Children’s Oncology Group[J]. J Clin Oncol, 2008,26:633-638.
[4] 杨迪生,范顺武,陶惠民,等. 骨肉瘤辅助化疗方案的中远期疗效观察[J]. 中华骨科杂志, 2000,20:35-39.
[5] PEIFER M, POLAKIS P.Wnt signaling in oncogenesis and embryogenesis——a look outside the nucleus[J]. Science, 2008,287:1606-1609.
[6] 解思信,李书忠,赵作雨,等. MMP-2、PTEN在骨肉瘤组织中的表达及临床意义[J]. 青岛大学医学院学报, 2007,43(6):500-502.
[7] GERYK-HALL M, HUGHES D P. Critical signaling pathways in bone sarcoma:candidates for therapeutic interventions[J]. Curr Oncol Rep, 2009,11(6):446-453.
[8] MILLER J R. The Wnts [J]. Genome Biol, 2001,3:1-15.
[9] CLEVERS H. Wnt/beta-catenin signaling in development and disease[J]. Cell, 2006,127(3):469-480.
[10] KARIM R, TSE G, PUTTI T, et al. The significance of the Wnt pathway in the pathology of human cancer [J]. Pathology, 2004,36(2):120-128.
[11] MATSUDE Y. WNT signaling enhances breast cancer cell motility and blockade of the WNT pathway by sFRP-1 suppresses MDA-MB-231xenograft growth[J]. Breast Cancer Res, 2009,11(3):32.
[12] LEE H H. Wnt-1 protein as a prognostic biomarker for hepatitis B-related and hepatitis C-related hepatocellular carcinoma after surgery[J]. Cancer Epidemiol Biomarkers Prev, 2009,18(5):1563-1569.
[13] HE B, REGUART N, YOU L, et al. Blockade of Wnt-1 signaling induces apoptosis in human colorectal cancer cells containing downstream mutations[J]. Oncogene, 2005,24(18):3054-3058.
[14] BARKER N, CLEVERS H. Mining the Wnt pathway for cancer therapeutics[J]. Nat Rev Drug Discov, 2006,5(12):997-1014.
[15] CHEN K, FALLEN S, ABAAN H O, et al. Wnt 10binduces chemotaxis of osteosarcoma and correlates with reduced survival[J]. Pediatric Blood Cancer, 2008,51:349-355.
[16] ENOMOTO M, HATAKAWA S, ITSUKUSHIMA S, et al. Autonomous regulation of osteosarcoma cell invasiveness by Wnt5a/Ror2 signaling[J]. Oncogene, 2009,28(36):3197-3298.
[17] HOANG B H, KUBO T, HEALEY J H, et al. Expression of LDL receptor-related protein 5 (LRP5) as a novel marker for disease progression in high-grade osteosarcoma[J]. Int J Can-cer, 2004,109:106-111.
[18] CAI Y, MOHSENY A B, KARPERIEN M, et al. Inactive Wnt/beta-catenin pathway in conventional high-grage osteosarcoma[J]. J Pathol, 2010,220(1):24-33.
[19] GINZINGER D G. Gene quantification using real-time quantitative PCR: an emerging technology hits the mainstream [J]. Exp Hematol, 2002,30:503-512.
[20] 赵立红,于红,李莉莉,等. 实时荧光定量PCR法检测淋病奈瑟菌感染的效果[J]. 齐鲁医学杂志, 2004,19(2):141-144.
(本文编辑 马伟平)
DETECTIONOFβ-CATENINEXPRESSIONINHUMANOSTEOSARCOMAMG63CELLLINEUSINGFQ-PCR
ZHANGPeng,LIShuzhong,ZHANGMingjin,ZHANGBao,QUShaozheng
(Spine Surgery Department, The Affiliated Hospital of Medical College, Qingdao University, Qingdao 266003, China)
ObjectiveTo study the expression of β-catenin expression in human osteosarcoma MG63 cell line.MethodsHuman MG63 cells interfered with Wnt3a and WIF-1 in different concentrations was cultured. The expression of β-catenin was detected by real-time fluorescent quantitative polymerase chain reaction (FQ-PCR). Culturing human MG63 cells, interfered with the same concentration of Wnt3a and WIF-1 (90 μg/L), the cells were counted respectively at 12, 24, 48, 72 and 92 hours in each group, the cell number in the blank-observation group, Wnt3a group and WIF-1 group was observed.ResultsThe differences of β-catenin expression between different-concentration WIF-1 groups were significant (F=215.58,P<0.05), the expression tended to decrease along with the increase of WIF-1 concentration; The differences of β-catenin expression between different-concentration Wnt3a groups were significant (F=185.64,P<0.05), the expression increased by degrees along with the increase of the concentration of Wnt3a. The blank group was found to have a higher cell proliferation than WIF-1 group, and lower than Wnt3a group, the difference was significant (F=4.88,P<0.05).ConclusionThe changes of the expressions of β-catenin in MG63 cells stimulated by different concentrations of Wnt3a and WIF-1 prove that Wnt/β-catenin signal pathway play an important regulation role in human osteosarcoma MG63 cells.
osteosarcoma; genes, β-catenin; polymerase chain reaction
2013-09-03;
2013-12-06
张鹏(1988-),男,在读硕士研究生。
李书忠(1958-),男,教授,主任医师,博士生导师。
R738.1
A
1008-0341(2014)03-0189-04
