两种脱细胞真皮基质材料在兔颅骨缺损引导骨再生术中的成骨效果评估
2014-09-20陈畅行宋晓陵达静姝
陈畅行,宋晓陵,达静姝,陈 武
(江苏南京210009:1.南京医科大学附属口腔医院牙周科;2.南京医科大学附属口腔医院病理科;3.南京医科大学口腔医学研究所)
GBR(guided bone regeneration)是针对骨组织的一项引导性组织再生(guided tissue regeneration,GTR)技术。面对临床上越来越多有牙周炎病史或者缺牙时间过长患者的种植修复需要,为了解决种植区牙槽骨量不足不能满足种植体最佳植入位置所需要的相应软硬组织体积这一问题,常需采用GBR技术进行种植术区的骨增量治疗。目前,GBR技术已经成为临床上解决患者种植体植入后局限性骨量不足以及种植术区骨缺损修复的重要手段[1]。
GBR技术中,屏障膜材料的选择是决定其引导骨组织再生效果的关键。目前最常用的膜材料为可吸收性胶原膜,并已被大量研究证实其在GBR过程中能发挥良好的屏障膜作用[2]。除此之外,近年来又推出了一种成本相对低廉的脱细胞真皮基质(acellular dermal matrix,ADM)膜,也是一种可吸收膜材料,并已开始应用于临床。但ADM材料作为屏障膜在GBR技术中所发挥的实际效果,目前尚未得到充分的评价和验证。本实验以兔为实验对象建立颅顶骨缺损动物模型[3-4],分别将两种不同动物来源的ADM材料配合骨替代物共同应用于动物骨缺损GBR技术中[5-6],并以屏障效果肯定的胶原膜作为阳性对照,以验证不同ADM材料作为屏障膜引导骨组织再生的效果。
1 材料和方法
1.1 主要实验材料
新西兰大白兔(南京医科大学实验动物研究中心提供);猪脱细胞真皮基质(porcine acellular dermal matrix,P-ADM)膜(10 mm ×10 mm,厚度1~1.5 mm,北京大清生物技术有限公司提供);牛脱细胞真皮基质(bovine acellular dermal matrix,B-ADM)膜(商品名海奥口腔修复膜,10 mm×10 mm,B型,烟台正海生物科技公司提供);瑞士Geistilich公司产胶原膜(Bio-gide Collagen membrane,10 mm×10 mm)。羟基磷灰石-磷酸钙双相复合骨替代材料(60%HA-40%TCP,Ф700 ~900 μm,上海贝奥路生物材料有限公司提供)。
1.2 实验方法
1.2.1 兔颅顶骨缺损模型的建立
取1~2周龄健康雄性新西兰大白兔20只(体质量1.5~2 kg),20%乌拉坦氯化钠注射液耳缘静脉注射(3~4 mL/kg体质量)麻醉后,术区常规消毒,并于颅顶部作环形切口;分离软组织和骨膜并暴露颅顶骨后,用慢速直机(卡瓦K4)分别在矢状缝两侧与两眼眶后缘连线后5 mm处各制备一个直径8 mm的全层颅骨缺损,注意保留完整的硬脑膜及骨膜组织。生理盐水冲尽骨屑并拭干后,按以下分组进行相应的处理。
1.2.2 实验分组和GBR处理
将上述制备有颅顶骨缺损的20只大白兔按观察时间随机分为8周、12周两大组(每组10只共20个骨缺损区);每一大组的20个骨缺损区再按不同处理方法各随机分为 A、B、C、D、E 5个亚组(每组4个骨缺损区)。其中A组骨缺损区植入HA-TCP,用P-ADM膜覆盖后缝合;B组骨缺损区植入HA-TCP,用B-ADM膜覆盖后缝合;C组骨缺损区植入 HA-TCP,用 Bio-gide膜覆盖后缝合;D组骨缺损区仅植入HA-TCP直接缝合;E组骨缺损区不植入任何材料直接缝合。术后24~48 h肌肉注射10~20万单位青霉素.术后10 d拆除缝线。所有动物均于相同条件下常规饲养。
1.2.3 取材和大体观察
分别于术后8周和12周处死相应组大白兔,分别截取各缺损区及其周围10 mm以内的全层骨组织,并肉眼观察各缺损区愈合情况和屏障膜降解情况。
1.2.4 组织学观察
各组颅顶骨标本经常规固定后树脂包埋,用硬组织切片机(德国leica 2155)平行于骨组织面作水平方向切片(片厚5 mm)。然后取各标本中心层切片,分别进行HE染色和马松染色(Masson Goldner Trlchrome),光学显微镜下观察新生骨组织成骨情况、新生组织血管化及其他组织学变化情况。HE染色切片用计算机图像分析系统随机采集同一样本不同成骨区域40倍视野下的图像各14张,并用图像分析软件IMAGEPRO PLUS 6.0进行定量分析,计算同一图像下新生骨小梁面积(new bone area,NBA)占图像骨缺损初始面积(total defect area,TDA)的百分比。取同一样本所有图像百分比均数作为该样本新生骨量的百分比(The percentage of new bone ,PNB)。
1.3 统计学分析
2 结果
2.1 大体观察
观察期间各组动物均进食、活动正常,并健康成活至处死;术后10 d拆线时,各动物的创口愈合均良好。
GBR术后8周,B、C组屏障膜材料均基本降解,而A组则余留有少量未降解的P-ADM,并与成骨区粘连。A、B、C、D组骨缺损区均可见少量HA-TCP颗粒残余,并可探及实质性修复;而E(空白对照)组骨缺损中心仍可探及小范围不规则的骨组织缺损区(直径1~2 mm),其周围可见新生骨组织。
术后12周,A、B、C、D组骨缺损区均无残余的屏障膜材料存在,并可探及实质性新生骨组织,其中D组新生骨组织表面可见少量HA-TCP颗粒;而E组骨缺损区亦可探及质地较疏松的新生骨组织,中心区肉眼未见明显骨缺损。
2.2 组织学观察
8、12周各组成骨区域组织切片HE染色后光学显微镜观察显示:40倍视野下各组均可见新生骨小梁结构和纤维结缔组织,100倍视野下,部分样本可见纤维结缔组织区域内有新生血管形成及未降解HA-TCP颗粒;马松染色显示:新生骨组织、纤维结缔组织与宿主骨组织的颜色、形态均清晰可辨(图1~8)。
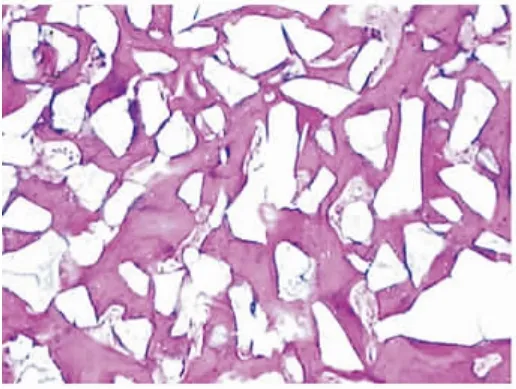
图1 12周B组成骨区,可见大量新生骨小梁组织(HE×40)
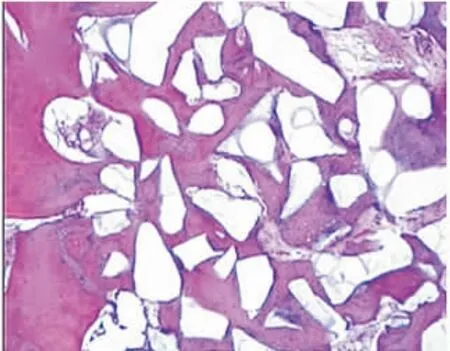
图2 12周C组新生骨组织与宿主骨组织交界区域(HE×40)

图3 12周A组成骨区,红色深染处为新生骨小梁,红色淡染处为未骨化的纤维结缔组织(HE×40)

图4 12周E组(空白组)成骨区,以纤维结缔组织为主(HE×40)
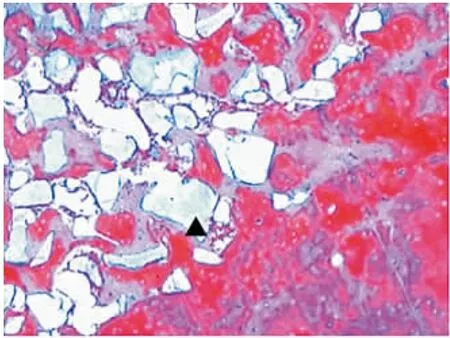
图5 8周B组新生骨组织与宿主骨组织交界区,黑色三角示未降解HA-TCP颗粒(Masson×100)

图6 8周A组成骨区,蓝染部分为纤维结缔组织,三角(红染部分)为已开始矿化的新生骨组织,箭头示纤维结缔组织间分布的新生血管(Masson×100)
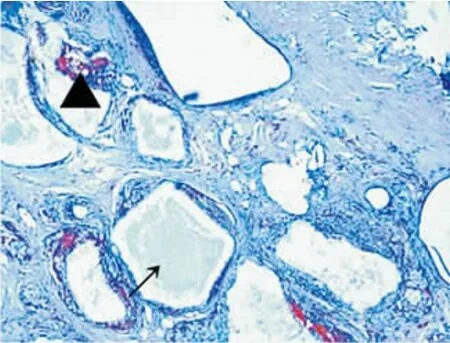
图7 8周D组成骨区,蓝染处为纤维结缔组织,三角部分为新生血管,箭头示未降解HA-TCP颗粒(Masson×100)
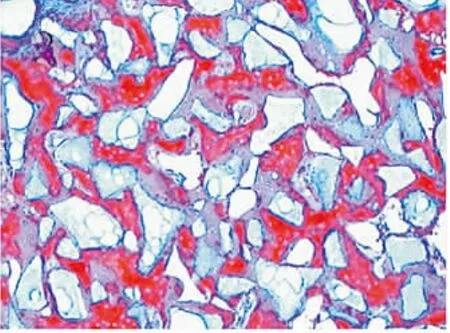
图8 8周C组成骨区,红色深染处为已矿化的新生骨组织,红色淡染处为未完全矿化的骨样基质(Masson×100)
2.3 组织学定量分析
GBR术后各组骨组织样本新生骨量定量分析结果显示:8、12周大组内的新生骨量均为C组>B组>A组>E组,其中除B组与C组相比无统计学差异(P>0.05)外,其余各组之间两两相比差异均有统计学意义(P<0.05);8、12周大组中各亚组两两相比,均为12周组高于8周组(P<0.05)(表1)。
表1 各组新生骨量百分比比较(%,s)
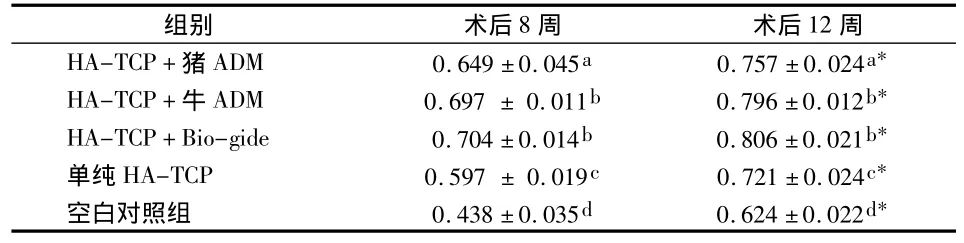
表1 各组新生骨量百分比比较(%,s)
同一时间内各组间相比,不同字母P<0.05;*为同组内12周与8周相比P<0.05
组别 术后8周 术后12周HA-TCP+猪ADM 0.649±0.045a 0.757±0.024a*HA-TCP+牛ADM 0.697±0.011b 0.796±0.012b*HA-TCP+Bio-gide 0.704±0.014b 0.806±0.021b*单纯HA-TCP 0.597±0.019c 0.721±0.024c*空白对照组 0.438±0.035d 0.624±0.022d*
3 讨论
GBR技术中,屏障膜的使用是保障该技术成功的关键。屏障膜是一类能够选择性阻挡上皮和成纤维细胞进入拟成骨空间,同时又不妨碍组织缺损自然愈合过程的生物相容性膜材料[2,7]。屏障膜的使用一方面可以在局部维持足够的成骨空间,以利于来充填足量的人工材料或自体骨;另一方面因其自身具有一定的稳定性,可保证有充足的时间让成骨细胞占据成骨空间,同时还可在其降解过程中让新生血管长入,从而促进和引导屏障膜两侧组织的自我修复过程[8]。
Bio-gide胶原膜是一种已被实验证实能有效发挥屏障膜作用的胶原膜材料[9],以I型胶原纤维和Ⅲ型胶原纤维为主要成分构成了空间三维网状结构,并通过双层膜设计而使其能保持较长时间的屏障作用。ADM则是动物皮肤通过去细胞、化学交联等步骤处理后脱去表皮和真皮中的细胞成分,仅保留真皮的不溶性基质成分所获得的屏障膜材料,其具有较低的抗原性并能促进新生组织血管化[5,10]。ADM同样为规则的空间三维网状支架,Ⅰ型胶原纤维占主要地位,构成ADM的基本骨架;Ⅲ型胶原纤维减少至原来真皮层的一半;Ⅳ型和Ⅶ型胶原纤维几乎消失[10]。在GBR过程中以ADM材料和胶原膜作为屏障膜时,其空间三维网状结构能够调节、诱导并促进宿主细胞长入;随着成骨细胞、血管内皮细胞及多种生长因子的长入和增殖,便可形成新生骨组织和新生血管,并逐渐将膜内物质降解、吸收,替换成为有宿主自体特征的细胞外组织基质[6]。
本实验中将ADM材料、Bio-gide胶原膜和人工骨替代物HA-TCP配合使用,充分利用了双相磷酸钙复合物良好的生物相容性、可降解性和骨引导活性[11]。分别于 GBR术后8、12周时观察发现,B组(牛ADM)和C组(胶原膜)在组织学表现上较为类似,8周即可观察到大量的新生骨小梁并伴有部分未骨化的纤维结缔组织,12周时两组的新生骨小梁数量均显著增加。无论8周还是12周,各组的新生骨量均为C组最高,其次为B组,两者间无统计学差异(P>0.05);而 A组(猪ADM)的新生骨量则明显低于B、C组,但 A、B、C组的新生骨量均明显高于D、E组(P<0.05),其中E组最低。12周与8周相比,各组的新生骨量均有显著增加(P<0.05);但组织学观察显示,12周时的所有实验组仍未形成完全成熟的致密骨板和哈弗系统,仅可见部分骨小梁融合和少量骨髓腔形成。
本结果表明,P-ADM、B-ADM、Bio-gide均能在GBR技术中发挥屏障膜作用,并促进兔颅骨缺损的骨组织再生和修复。其中牛脱细胞真皮基质和胶原膜的成骨效果无明显差异,但其促进和引导缺损区骨组织修复的远期效果是否存在差异尚需进一步的实验论证。
[1]芮宇欣,王屹.GBR技术应用于上前牙种植骨缺损的临床研究[J].临床口腔医学杂志,2011,27(7):418-420.
[2]余粤海,邓飞龙.GBR技术中屏障膜的应用和研究进展[J].中国口腔种植学杂志,2006,11(3):137-140.
[3]薛英,刘强.神经生长因子结合骨基质明胶修复兔颅骨缺损的实验研究[J].中国当代医药,2012,19(23):15-21.
[4]李琦,周延民,翟静捷,等.富血小板纤维蛋白修复兔颅骨骨缺损的实验研究[J].口腔医学研究,2011,27(7):587-589.
[5]Fugazzotto PA.GBR using bovine bone matrix and resorbable and nonresorbable membranes.Int Part 2:Clinical results[J].Int J Periodontics Restorative Dent,2003,23(6):599-605.
[6]Clokie CM,Moghadam H,Jackson MT,et al.Closure of critical sized defects with allogenic and alloplastic bone substitutes[J].J Craniofac Surg,2002,13(1):111-121.
[7]王韦玮,陈武.引导组织再生术膜材料的研究进展[J].口腔生物医学,2010,1(4):207-209,212.
[8]白彭.引导骨再生技术中屏障膜的应用研究进展[J].中国口腔种植学杂志,2010,15(3):157-159.
[9]陈铁楼,王刚,陈婷,等.引导骨再生术和引导组织再生术治疗牙周根分叉病变的临床研究[J].口腔医学,2006,26(6):404-407.
[10]王乾锋,刘宏伟,郑秋林.脱细胞真皮基质作为引导组织再生屏障膜在体内的组织学变化研究[J].口腔医学,2010,30(9):523-525.
[11]Sun JS,Lin FH,Wang YJ,et al.Collagen-hydroxyapatite/tricalcium phosphate microspheres as a delivery system for recombinant human transforming growth factor-beta 1[J].Artif Organs,2003,27(7):605-612.
