假单胞菌多糖为壁材微胶囊的制备
2014-09-19陈敦,苗雨,叶淑红,王晗,肖珊,王际辉
陈 敦,苗 雨,叶 淑 红,王 晗,肖 珊,王 际 辉
(大连工业大学 辽宁省食品生物技术重点实验室,辽宁 大连 116034)
0 引 言
微胶囊是由天然或合成的高分子包裹材料制成的直径1~2 000μm的一种具有半透性或封闭性的微型容器[1]。微胶囊技术已被广泛应用于医药、农药、香料、食品、染料等行业或领域微胶囊化过程中。微胶囊壁材是决定微胶囊性能的关键因素。目前,微胶囊壁材的研究主要体现在载药量、生物相容性以及缓释性能等方面。但公认较好的微胶囊壁材价格昂贵,用其制备的微胶囊产品价格居高不下,这些问题都限制了微胶囊技术的广泛利用[2]。因此,如何开发有竞争力的高分子包裹材料是当前微胶囊研究的重要课题。
微生物多糖是细菌、真菌和蓝藻等微生物在代谢过程中产生的对微生物有保护作用的一类生物高聚物,其作为胶凝剂、成膜剂、保鲜剂、乳化剂等,广泛应用于食品、制药、石油和化工等领域[3]。它安全无毒,理化性质独特,生产周期短,且不受季节、地域和病虫害等条件限制,因而已经在许多领域得到应用[4]。本试验选择有抗氧化活性的多糖[5]为壁材,利用复凝聚法将红花油制备成微胶囊油脂粉末[6],使红花油与外界环境隔绝,延缓氧化,增强其溶解性,以提高其在生产中的应用价值。
1 试 验
1.1 材料与仪器
1.1.1 菌 株
假单胞杆菌PT-8,大连工业大学食品学院实验室保藏菌株。
1.1.2 培养基
基础培养基:葡萄糖10g、蛋白胨10g、牛肉膏3g、氯化钠5g,用蒸馏水溶解,定容至1 000mL。
发酵培养基:蔗糖35g、牛肉膏20g、磷酸氢二钾1g、磷酸二氢钾0.5g、硫酸锰0.5g、硫酸镁1g、氯化钠30g,用蒸馏水溶解,定容至1 000mL。
1.1.3 主要仪器与试剂
FE20精密pH计,R104分散机,JJ-1精密增力电动搅拌器,JSM-64602LV扫描式电子显微镜,XSP-24N光学显微镜,BIOECH-5JG-2002A发酵罐,UV5100紫外分光光度计;红花油,明胶,正己烷,冰乙酸,戊二醛。
1.2 方 法
1.2.1 发酵方法
假单胞菌PT-8以5%接种量于5L发酵罐中30℃恒温培养48h。
1.2.2 多糖的提取
发酵液经离心去除菌体,再使用Sevag试剂除去蛋白,醇沉得多糖,然后冷冻干燥18h,获得淡黄色多糖粉末[7]。
1.2.3 微胶囊的制备
将红花油边搅拌边加到明胶溶液中,30 000r/min均质1min,形成稳定的乳液,然后将多糖溶液在400r/min、50℃逐滴添加到乳液中,用10%的冰乙酸溶液调整其pH为3.6,反应1h,400r/min下使微胶囊乳液降温至5℃以下,按比例加入交联剂戊二醛,经过一段时间的交联反应,冷冻干燥得到胞外多糖红花油微胶囊产品[8]。
1.2.4 单因素试验
分别以壁材质量浓度、交联剂质量分数、交联时间、壁材质量比、pH为单因素,考察各因素对制备微胶囊的影响。各因素水平梯度分别为:壁材质量浓度(A)为10、30、50、70、90g/L;交联剂质量分数(B)为0、1%、3%、5%、7%;交联时间(C)为0、30、60、90、120、150、180min;壁材质量比为5∶1、5∶2、5∶3、5∶4、5∶5、5∶6、5∶7;pH 为2.0、2.4、2.8、3.2、3.6、4.0、4.4。
1.2.5 正交试验
在单因素试验的基础上,进行三因素三水平,每个试验作3个平行,采用L9(33)试验。其因素和水平见表1。

表1 微胶囊制备的影响因素和水平Tab.1 The influence factors and level of microcapsule preparation
1.2.6 微胶囊包埋率的测定
微胶囊表面油含量的测定:称取冻干后微胶囊样品(1.0±0.05)g于250mL锥形瓶中,加入20mL正己烷,剧烈震摇2~3min,有机滤膜过滤,重复3次,收集滤液,蒸去正己烷,烘干至恒重,瓶体增加的质量即为表面油的量。
微胶囊总油含量的测定:使用索氏抽提法提取总油[9]。
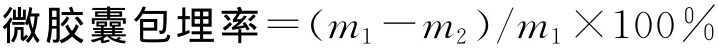
式中:m1为总油质量,mg;m2为表面油质量,mg。
1.2.7 微胶囊形态
光学显微镜观察:取少许微胶囊粉末溶于水中,吸取若干滴,置于载玻片上,滴1~2滴番红指示剂,盖上盖玻片,采用光学显微镜观测,放大倍数600倍,用相机拍照。
扫描电子显微镜(SEM)观察:采用扫描电子显微镜,将微胶囊粉末喷金后观察其形态[10]。
2 结果与讨论
2.1 单因素试验
2.1.1 pH对复凝聚反应的影响
在酸性条件下,明胶与多糖带相反电荷,因而会发生凝聚现象[11],当反应较为充分时,会出现明显的沉淀物,静置后,反应体系的透光率会增高。从图1可以看到随着冰乙酸溶液的添加,反应体系的透光率在2.4~4.0较高。从pH 4.0开始,明胶与多糖发生剧烈的复凝聚反应,反应体系的透光率开始上升,至pH 3.6时透光率达到最高,之后透光率开始降低,复凝聚现象逐渐减弱,当pH小于2.4时透光率骤然降低,说明此条件下复凝聚现象已经不太明显,由此可定最佳pH为3.6。
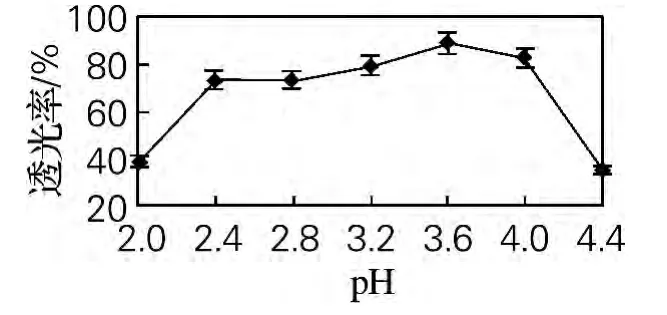
图1 pH对反应体系透光率的影响Fig.1 Effect of pH on the reaction system light transmittance
2.1.2 壁材质量比对复凝聚反应的影响
从图2可以看出,对于同等质量浓度的明胶和多糖,溶液体积比为5∶4时,混合溶液的透光率最高。由此确定当质量比为5∶4时,明胶和多糖能够充分发生复凝聚反应。
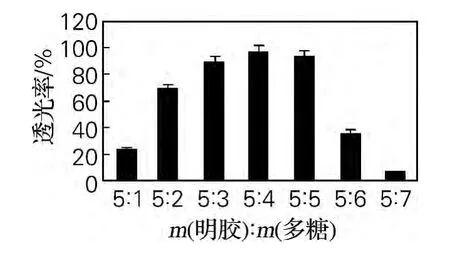
图2 壁材质量比对微胶囊透光率的影响Fig.2 Effect of the ratio of wall material quality on the light transmittance
2.1.3 壁材质量浓度对制备红花油微胶囊的影响
从图3可以看出,微胶囊的包埋率先随着壁材质量浓度的增高而增高,当壁材质量浓度为50g/L时,微胶囊产品的包埋率达到最高,之后包埋率开始略微下降。随着壁材质量浓度增加,高黏度的凝聚相有利于产生更稳定的微胶囊,但是如果黏度过高,微胶囊壁会相互黏结,不利于圆整、分散、颗粒均匀的微胶囊产品的形成,因此包埋效果反而会削弱。
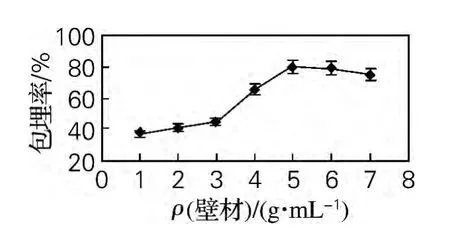
图3 壁材质量浓度对微胶囊包埋率的影响Fig.3 Effect of the wall material concentration on the microcapsule embedding rate
2.1.4 交联剂质量分数对制备红花油微胶囊的影响
从图4可以看出,戊二醛用量太少,微胶囊壁交联作用较弱,明胶和多糖分子可以重新进入水相,影响微胶囊包封率[8]。随着交联剂质量分数的增高,至3%时包埋率最高,之后随着交联剂质量分数的增高,微胶囊的包埋率随之下降,这可能因为用量过大,交联过度,影响微胶囊形状和包埋率。
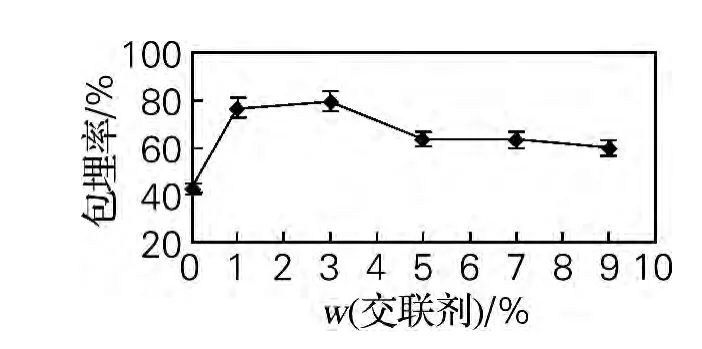
图4 交联剂质量分数对微胶囊包埋率的影响Fig.4 Effect of the mass fraction of crosslinker on the microcapsule embedding rate
2.1.5 交联时间对制备红花油微胶囊的影响
从图5可以看出,加入戊二醛进行交联反应需要时间[11]。时间太短,交联反应来不及发生,形成的微胶囊壁不够坚韧,影响微胶囊的包埋率,随着交联时间的延长,交联反应逐渐发生,至120min时,交联反应已经基本完成,持续增加时间,交联效果不会有显著变化。
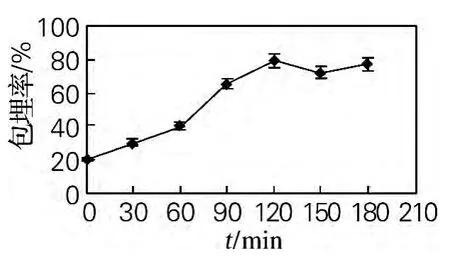
图5 交联时间对微胶囊包埋率的影响Fig.5 Effect of the crosslinking time on the microcapsule embedding rate
2.2 正交试验
正交试验结果如表2所示。由表2可以看出,3个因素对试验结果影响的主次顺序为:B>A>C,即交联剂质量分数>壁材质量浓度>交联时间,这说明交联剂质量分数对提高微胶囊包埋率的作用更显著,最佳提取组合为A2B2C3,即壁材质量浓度为50g/L,交联剂质量分数为3%,交联时间为140min。在此最佳提取条件下进行验证试验,微胶囊的包埋率可达81.12%。
2.3 微胶囊的微观效果
经扫描式电子显微镜观察发现,微胶囊粉末内部是由许多的微小圆粒组成,粒径大小为1~10μm,且形态不一,相互之间有一定黏结[10](图6(a))。如果将微胶囊粉末溶于水,又经番红染色后发现,微胶囊可被染色,形态较为圆整、均匀、分散(图6(b))。
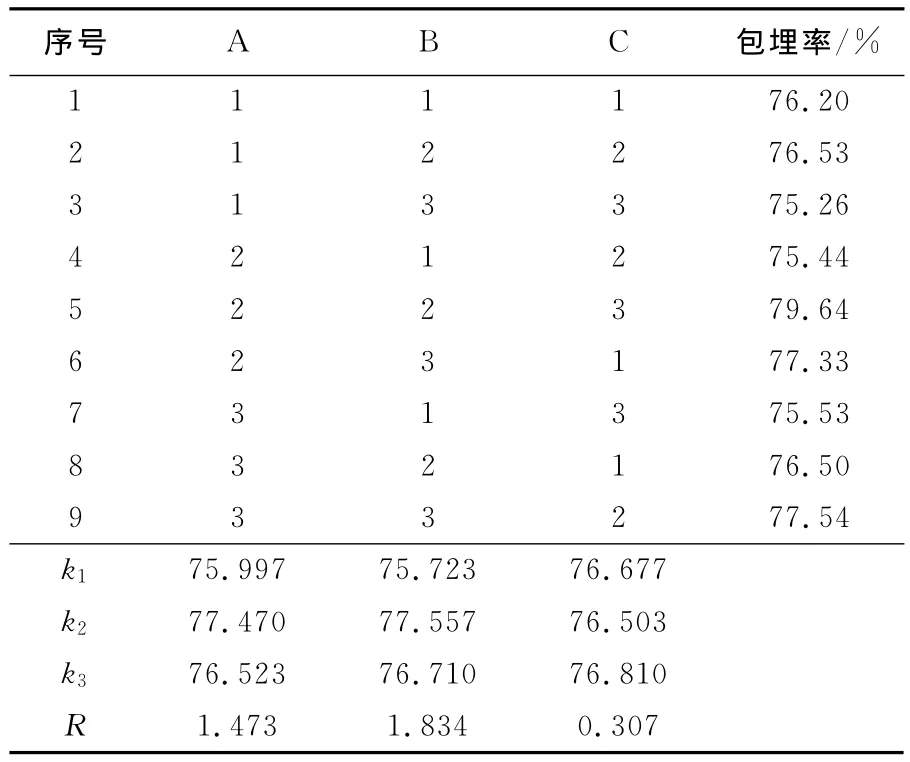
表2 L9(33)正交试验表Tab.2 Orthogonal table

图6 微胶囊的微观图片Fig.6 Microscopic image of microcapsule
3 结 论
试验确定以假单胞菌PT-8胞外多糖和明胶为壁材制备红花油微胶囊的最佳包埋率为81.2%,形成的粒子形态较好。明胶和假单胞菌PT-8胞外多糖在酸性条件下电负性不同,正负电荷相互作用,从溶液中解析出来,包覆在乳化的油滴表面,使用戊二醛进行一段时间的交联反应,形成微胶囊。戊二醛交联剂的文献有很多,就本研究而言,交联剂处于核心地位。由于戊二醛中的醛基与明胶酰胺中的氨基发生交联反应,交联反应的结果形成了多个蛋白分子交接的网状结构,随着戊二醛用量的增加,蛋白分子间的“搭桥”频繁,交联网点密度提高,增强微胶囊壁的强度和密封性。
以假单胞菌胞外多糖和明胶为复合壁材,用复凝聚法制备红花油微胶囊是一种既简便又经济的方法。因此,假单胞菌PT-8胞外多糖可以作为制备红花油微胶囊的壁材。
[1]张碳,谭天伟,凌沛学.微胶囊壁材在食品工业中的研究进展[J].食品与发酵工业,2011,37(5):132-137.
[2]甘孝勇.药物微胶囊壁材研究进展[J].广州化工,2012,40(5):56-57.
[3]黄汉武,曾伟,陈桂光.微生物多糖工业化研究进展[J].轻工科技,2012(5):19-23.
[4]张国民,申可佳,文礼湘,等.微生物多糖的应用研究进展[J].世界科技研究与发展,2009,31(5):889-891.
[5]汪洋,陈靠山.微生物多糖的功能研究进展[J].科技信息,2013(16):131-132.
[6]HOSSEINI S M H,EMAM-DJOMEH Z,RAZAVI S H,et al.Complex coacervation ofβ-lactoglobulinκ-Carrageenan aqueous mixtures as affected by polysaccharide sonication[J].Food Chemistry,2013,141:215-222.
[7]孙红梅,张星星,白玉,等.海洋假单胞菌胞外多糖的抗氧化性 [J].大连工业大学学报,2012,31(6):395-398.(SUN Hong-mei,ZHANG Xing-xing,BAI Yu,et al.Antioxidant effects of extracellular polysaccharides from a marinePseudomonas[J].Journal of Dalian Polytechnic University,2012,31(6):395-398.)
[8]GU Xiangling,ZHU Xiaoli,KONG Xiangzheng,et al.Comparisons of simple and complex coacervations for preparation of sprayable insect sex pheromone microcapsules and release control of the encapsulated pheromone molecule[J].Journal of Microencapsulation,2010,27(4):355-364.
[9]DEVI N,HAZARIKA D,DEKA C,et al.Study of complex coacervation of gelatin A and sodium alginate for microencapsulation of olive oil[J].Journal of Macromolecular Science,Part A:Pure and Applied Chemistry,2012,49:936-945.
[10]CONTO L,GROSS C,GONCALVES L.Chemometry as applied to the production of omega-3microcapsules by complex coacervation with soy protein isolate and gum Arabic[J].LWT-Food Science and Technology,2013,53:218-224.
[11]谢艳丽,蒋敏,陈鸿雁.复凝聚法制备明胶/阿拉伯胶含油微胶囊工艺过程的研究[J].化学世界,2010,51(1):33-37.
