重组人白细胞介素-2活化的自然杀伤细胞对大鼠梗死心肌功能的影响
2014-09-19葛顺朱宝亮王福文
葛顺,朱宝亮,王福文
(1.济宁医学院 基础学院,山东 济宁 272067;2.山东省医学科学院药物研究所山东省罕少见病重点实验室,山东 济南 250062)
重组人白细胞介素-2活化的自然杀伤细胞对大鼠梗死心肌功能的影响
葛顺1,朱宝亮1,王福文2
(1.济宁医学院 基础学院,山东 济宁 272067;2.山东省医学科学院药物研究所山东省罕少见病重点实验室,山东 济南 250062)
目的 探讨注射重组人白细胞介素-2(recombinant human interleukin-2,rhIL-2)活化后的自然杀伤细胞(natural killer cells,NKC)对大鼠梗死心肌功能的影响。方法 体外提取大鼠NKC,实验组经rhIL-2活化,对照组未活化,比较2组NKC的杀伤能力;体外提取大鼠心肌微血管内皮细胞,分成3组,分别与rhIL-2-NKC、NKC和PBS液共培养0 d和10d,观察3组共培养液对内皮细胞增殖的影响;取大鼠梗死1h的心肌组织,分别注射rhIL-2-NKC、NKC和 PBS(空白对照组),并于注射后0、1、2、4、8、16 d采用 RTPCR检测各组单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-2(interleukin-2,IL-2)的mRNA表达水平;取处理16 d的3组大鼠用于测定血液动力学指标:左心室收缩压(left ventricular systolic pressure,LVSP)、舒张末压(left ventricular end diastolic pressure,LVEDP)、平均动脉压(mean arterial pressure,MAP)、压力最大上升速率(+dp/dt)和压力最大下降速率(-dp/dt),并以免疫组织化学方法检测心肌梗死区域面积和微血管密度(MVD)及梗死边缘区域的血管密度以及血小板内皮细胞粘附分子(CD31)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的蛋白表达水平。结果 rhIL-2-NKC杀伤力增加,且随效应细胞与靶细胞比例增加而增加;心肌微血管内皮细胞与rh IL-2-NKC共培养处理后,细胞增殖数量为空白对照组的1.28倍,差异有统计学意义(P<0.05);RT-PCR结果表明:rh IL-2-NKC处理组大鼠心肌组织MCP-1、TNF-α和IL-2 mRNA表达均上调,于2~8 d时显著高于NKC组和空白对照组(P<0.05);血液动力学指标检测表明:rhIL-2-NKC组大鼠LVEDP、MAP和+dp/dt均高于NKC组和空白对照组,但LVSP和-dp/dt均低于NKC组和空白对照组,rhIL-2-NKC组各指标与对照组相比差异均有统计学意义(P<0.05);免疫组化检测结果表明:rhIL-2-NKC组心肌梗死面积(19.23±5.61)最低,而MVD(15.29±1.77)最高,与其他2组差异均有统计学意义(P<0.05);rhIL-2-NKC组梗死边缘区域 CD31(238.17±16.82)和VEGF(221.32±16.97)蛋白表达水平高于NKC(CD31和VEGF分别为66.81±11.84和87.33±10.18)和空白对照组(CD31和VEGF分别为29.23±5.57和76.21±9.23),差异均有统计学意义(P<0.05)。结论 心肌注射rhIL-2-NKC能够促进梗死心肌的血管再生,具有改善大鼠心肌功能的作用。
重组人白细胞介素-2;自然杀伤细胞;心肌功能
心血管疾病(cardiovascular disease,CVD)是东西方国家病患死亡的主要因素[1],其中之一即为心肌梗死(myocardial infarction,MI)。MI在病理学上是指长时间缺血导致的心肌细胞死亡[2],研究表明急性心肌梗死(acute myocardial infarction,AMI)是世界上导致人类死亡人数最多的疾病[3]。改善心肌功能以预防或治愈心肌梗死是国内外学者研究的重要方向。
自然杀伤细胞(natural killer cells,NKC)是机体先天免疫系统中发挥关键作用的一类淋巴细胞[4-5],对组织器官功能的维持或恢复具有重要作用。研究发现在CVD患者中,NKC活性和循环水平显著降低[7]。NKC功能与单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和白细胞介素-2(interleukin-2,IL-2)等有关。在免疫应答中,NKC可产生多种细胞因子以参与调控先天或获得性免疫系统[6],其中干扰素-γ(interferon-γ,IFN-γ),粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是 NKC被激活后产生的主要细胞因子[8]。 TNF-α可促进血管内皮生长因子(vascular endothelial growth factor,VEGF)及其内皮受体(VEGF receptor 2)的表达,进而促进血管再生[9]。虽然多种因素可促进NKC的活性,但关于IL-2对MI患者心肌功能的影响鲜有研究报道。本实验以大鼠为研究对象,通过对其梗死心肌注射rhIL-2-NKC,以探讨rhIL-2-NKC对梗死心肌功能的影响及其可能的分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SD大鼠,6周龄。实验大鼠(SPF级)由医学科学院动物中心提供,合格证号为SCXK2012-0014。
1.1.2 实验试剂:rhIL-2(沈阳三生公司);RPMI-1640和M199培养基(美国Gibco公司);胎牛血清(北京索莱宝科技有限公司);NKC培养试剂盒(江苏万华生物医药技术有限公司);抗体CD31和 VEGF(美国 Invitrogen公司);DNA marker(美国Promega公司)。
1.1.3 实验仪器:Synergy 2多功能酶标仪(美国Biotek公司);SHELLAB CO2培养箱(美国SHELLAB公司);Stratedigm流式细胞仪SE1000/1200EX(美国Stratedigm公司);Biometra梯度PCR仪T3000(德国Biometra公司);KDSModel35小动物呼吸机(美国Kent公司)。
1.2 方法
1.2.1 细胞分离和培养:实验大鼠脱颈处死后分离肝脏,根据NKC试剂盒操作说明提取NKC并进行纯化。将NKC接种于培养瓶(75 cm2)中。培养液成分包括:RPMI-1640完全培养基(含10%胎牛血清)、Hepes(1%)、丙酮酸钠(1%)、青霉素(100 U/mL)和链霉素(100μg/mL)。NKC培养条件为:温度37℃、CO25%饱和湿度60%。培养48 h后加入rhIL-2(6 000U/mL)继续培养24 h,制成活化的NKC。
取实验大鼠,剖离左心室并剪碎,依次加入胶原酶和胰酶各消化5min,1 000 g,4℃离心10min,弃上清,重悬后再次离心,所得沉淀即为心肌微血管样本。取适量沉淀接种于培养板,培养48 h制备心肌微血管内皮细胞(cardiac microvascular endothelial cell,CMEC)。培养液成分包括:M199完全培养基(含20%胎牛血清)、Hepes(20mM)、丙酮酸钠(1mM)、肝素(12 U/mL)、非必需氨基酸(1%)和双抗(青霉素和链霉素)。培养条件同NKC。
1.2.2 NKC杀伤力检测:靶细胞(T)为淋巴瘤细胞(YAC-1)。效应细胞为rhIL-2-NKC(实验组)和NKC(对照组)。按照比例1∶1、1∶5、1∶10、1∶20和1∶50将靶细胞和效应细胞共培养48 h。取上清液,按照试剂盒说明测定乳酸脱氢酶(lactate dehydrogenase,LDH)的OD值(500 nm)。LDH标准曲线由不同数量靶细胞(0~5×104个)按相同操作所得OD值制成。
1.2.3 CMEC增殖检测:培养的 CMEC分成3组。待CMEC融合度达90%后,分别加入等量的rhIL-2-NKC、NKC和培养液,分别于培养0d和10 d后以第VIII因子相关抗原和CD31标记,采用流式细胞术检测CMEC数量,10 d和0 d的差值即为细胞增殖数量。实验以rhIL-2-NKC为阴性对照组,培养液为空白对照组。
1.2.4 相关基因mRNA表达检测:取实验大鼠45只,腹腔注射水合氯醛(10%)麻醉后,经口腔插入14 G套管枕套行,连接动物呼吸机。打开大鼠胸腔,并分离心包。将与左心房相连的冠状动脉前降支结扎以建立心肌梗死大鼠模型(标志为心脏前壁发白)。建模完成后将大鼠分成3组,于心肌梗死1 h后,分别注射50μL rhIL-2-NKC液、NKC液和PBS液(空白对照组),每次注射均于心肌梗死区域选取3点。rhIL-2-NKC液和NKC液均为将106个细胞溶于50μL PBS溶液(pH=7.4)配制而成。分别于注射 0、1、2、4、8、16 d 后取各组心脏组织,用于检测MCP-1、
1.3 统计学方法 以SPSS13.0软件进行分析。正态计量资料用“±s”表示,组间两两比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 rhIL-2-NKC和NKC的杀伤力比较 rhIL-2-NKC和NKC对淋巴瘤细胞均有杀伤作用,且随着效应细胞含量的升高而升高。当效应细胞含量为靶细胞的50倍时,rhIL-2-NKC可致70.31%细胞死亡,为NKC杀伤力(45.32%)的1.55倍(见图1)。TNF-α和IL-2的mRNA表达水平。以大鼠开胸但左前降支不结扎为假手术组,且不进行注射。按照试剂盒方法提取总RNA,反转录合成cDNA和RT-PCR扩增。GAPDH设为内参。实验重复测定3次。
1.2.5 血液动力学指标检测:取1.2.4处理16 d的实验大鼠,每组15只,按0.5mL/100 g腹腔注射水合氯醛(10%)。大鼠麻醉并固定后,打开胸腔,导管一端插入左心室,另一端连接RM6240生理信号采集分析系统。记录大鼠左心室收缩压(left ventricular systolic pressure,LVSP)、舒张末压(left ventricular end diastolic pressure,LVEDP)、平均动脉压(mean arterial pressure,MAP)、压力最大上升速率(+dp/dt)和压力最大下降速率(-dp/dt)。
1.2.6 梗死心肌的组织形态学分析:血流动力学指标测定完成后,经颈总静脉注射1mL KCl(10%)。待大鼠心跳停止后,解剖取其左心室,以10%多聚甲醛固定。取梗死心肌制成石蜡包埋切片,分别经Masson's Trichrome和HE染色后,以Image-Pro Plus 6.0医学图像分析系统分析心肌梗死区域的面积和微血管密度(micro-vascular density,MVD)。MVD为单位视野(mm2)内微血管(MVC)数。
取结扎处(梗死心肌与正常心肌的交界)组织,制成石蜡包埋切片。分别以血管内皮标记抗体CD31(PECAM-1)和血管内皮生长因子标记抗体VEGF(1∶200)作为一抗对切片进行免疫组化染色。染色结果以Image-Pro Plus 6.0医学图像分析系统进行分析,分别计算高倍镜(×400)下5个视野内的心肌梗死边缘区域的血管密度值(A),CD31和VEGF的蛋白表达水平。

图1 rh IL-2-NKC和NKC的杀伤力Fig.1 Lethality of rhIL-2-NKC and NKC
2.2 不同处理对CMEC增殖的影响 rhIL-2-NKC处理组的CMEC增殖数为2.73×105,为空白对照组(BC,2.13×105)的1.28倍,差异具有统计学意义(P<0.05)。阴性对照组(NC)、NKC组和空白对照组CMEC增殖数相近,分别为2.13×105、2.28×105和2.15×105,差异无统计学意义。

图2 不同处理组CMEC的增殖*P<0.05,与BC组相比Fig.2 CMEC proliferation in different treatment groups*P<0.05,compared with BC group
2.3 各处理组MCP-1、TNF-α和IL-2 mRNA表达水平比较
实验期间,空白对照组MCP-1表达水平变化较小;rhIL-2-NKC和NKC组的MCP-1 mRNA表达水平先升高后降低,4 d时达到最大值,分别为70.15和30.27,且1~8 d期间各组差异均具有统计学意义(P<0.05,见图3A)。实验期间各组大鼠 TNF-α mRNA表达水平变化趋势与MCP-1相似,但rhIL-2-NKC和NKC组的TNF-αmRNA表达水平在2 d时即达最大值;1~8 d期间各组差异均具有统计学意义(P<0.05,见图3B)。NKC组和空白对照组IL-2 mRNA表达水平在实验期间变化较小,而rhIL-2-NKC组IL-2mRNA表达水平在0~4 d内持续升高,4 d时达最大值(61.82),之后逐渐下降;2~8 d期间 rhIL-2-NKC组 IL-2 mRNA表达均高于NKC组和空白对照组,差异有统计学意义(P<0.05,见图3C)。

图3 不同处理组MCP-1(A)、TNF-α(B)和IL-2(C)mRNA表达水平比较*P<0.05,与BC组相比;#P<0.05,与NKC组相比Fig.3 MCP-1(A),TNF alpha(B)and IL-2(C)mRNA expression in different treatment groups*P<0.05,compared with the BC group;#P<0.05,compared with NKC group
2.4 不同处理组大鼠血液动力学指标变化比较 不同处理组中,rhIL-2-NKC组大鼠各参数值更接近假手术组。rhIL-2-NKC组LVSP值高于NKC组,且2者均高于空白对照组,但仅rhIL-2-NKC组与空白对照组间比较差异有统计学意义(P<0.05)。NKC组和rhIL-2-NKC组LVEDP值均显著低于空白对照组,且rhIL-2-NKC组值亦显著低于NKC组,差异均有统计学意义(P<0.05)。各组MAP值大小依次为:rhIL-2-NKC>NKC>空白对照组,rhIL-2-NKC组与空白对照组差异有统计学意义(P<0.05)。rhIL-2-NKC组的+dp/dt值显著高于空白对照组和NKC组,而-dp/dt值显著高于空白对照组和NKC组,差异均有统计学意义(P<0.05);而NKC组+dp/dt和-dp/dt与空白对照组比较差异无统计学意义(见表1)。

表1 不同处理组的血液动力学指标结果Tab.1 Hemodynamic index results in different treatment groups
2.5 各组大鼠梗死心肌的组织形态学观察 各组大鼠梗死心肌结果见表2。空白对照组心肌梗死面积最大,其次为NKC组,rhIL-2-NKC最小且显著低于前2者,差异有统计学意义(P<0.05);NKC组与空白对照组比较差异无统计学意义。rhIL-2-NKC组的梗死区域MVD值显著高于其他组,且NKC组显著高于空白对照组,差异均具有统计学意义(P<0.05);rhIL-2-NKC组心肌梗死边缘区域的CD31和VEGF蛋白表达水平均显著高于其他组,差异具有统计学意义(P<0.05);NKC组的CD31和VEGF蛋白表达水平高于空白对照组,但仅2者CD31蛋白表达水平间的差异有统计学意义(P<0.05)。
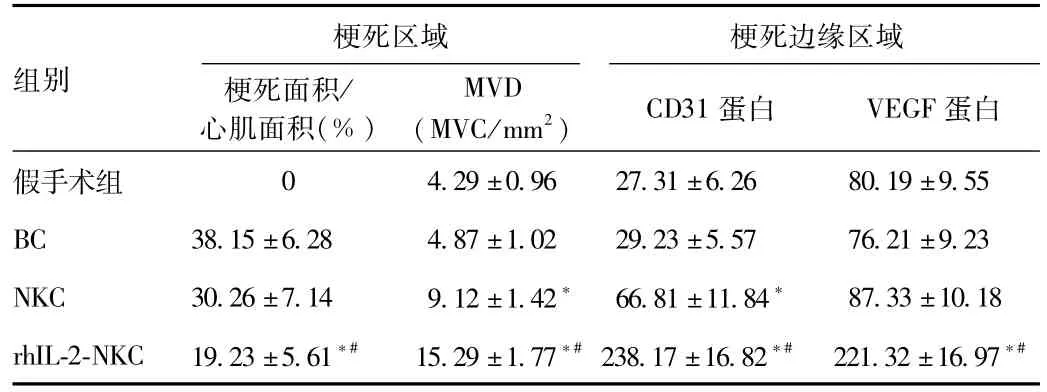
表2 各组大鼠梗死心肌的组织形态学分析结果Tab.2 Histomorphology analysis results of infarcted myocardium in each groups
3 讨论
心肌梗死是致死或致残率极高的一种心血管疾病。MI由心肌缺血引起[2],同时受到温度等环境条件和IL等内源性因素的影响[10-12]。 MI可导致心肌部位瘢痕的形成[13],不利于患者康复,甚至加重MI的反复发作。组织再生是医学上治愈受损心肌的重要方法[14],而心肌再生与心肌功能的维持及改善密不可分。NKC在机体组织器官参与免疫活动中发挥关键作用。本研究通过大鼠肝脏分离、纯化和培养等获得NKC,一部分经rhIL-2活化制得rhIL-2-NKC,一部分未活化,比较2者杀伤力及其对大鼠心肌和血液影响的差异。结果显示虽然rhIL-2-NKC和NKC均能杀伤淋巴瘤细胞,但前者的杀伤能力更大,可见rhIL-2对NKC的活化能够增加NKC对心肌的保护能力。研究发现IL-13、IL-17和 IL-18等其他IL家族成员亦有活化NKC的能力[11-12,15]。与NKC相比,rhIL-2-NKC能显著促进 CMEC的增殖,这可能与rhIL-2-NKC分泌的相关细胞因子(如α4β7)作用的发挥有关[16]。
分别对大鼠各组梗死心肌注射rhIL-2-NKC、NKC和PBS液,并对心肌组织MCP-1、TNF-α和IL-2 mRNA表达水平进行RTPCR检测,结果表明:经rhIL-2活化的NKC可显著促进此3种基因的表达上调。MCP-1由内皮细胞等基质细胞和炎症细胞产生,对单核细胞和淋巴细胞表型的调节,纤维组织沉积和血管再生等具有重要作用[17]。NKC能够诱导靶细胞裂解,而TNF家族是参与该过程的重要因子[18]。因此梗死心肌TNF-α表达上调可裂解病变细胞,并在一定程度上防止正常心肌细胞病变。此外,TNF-α还可激活机体相关通路,与MCP-1协同促进血管再生[19]。IL-2可激活淋巴细胞,并通过一系列反应最终引发心肌炎症反应[20]。因此,IL-2表达的上调有利于心肌组织对病变部位的修复。本实验结果显示rh IL-2-NKC促进了MCP-1、TNF-α和IL-2的表达,对心肌组织再生产生积极作用,这说明rhIL-2-NKC有利于心肌功能的改善及组织的恢复。
血液动力学指标测定结果表明:与空白对照组相比,NKC和rhIL-2-NKC均可改善心肌功能,但rhIL-2-NKC的促进作用更大。受TNF-α表达上调的影响[9],rhIL-2-NKC组CD31和VEGF蛋白表达水平亦增加,显著高于其他组,这有利于心肌血管内皮细胞的增殖。以上结果表明,rhIL-2-NKC对血液动力学参数和心肌组织形态结构均有改善作用。
综上所述,rhIL-2-NKC杀伤力增加,提高了心肌 MCP-1、TNF-α和IL-2的mRNA表达水平,对细胞增殖和血管再生具有促进作用。本研究证实了rhIL-2-NKC对大鼠梗死心肌功能的改善作用,但具体的作用机制仍需进一步研究。
[1] Zhang H,Wang H,Li N,et al.Cardiac progenitor/stem cells on myocardial infarction or ischemic heart disease:what we have known from current research[J].Heart failure reviews, 2014,19 (2):247-258.
[2] Thygesen K,Alpert JS,Jaffe AS,et al.Third universal definition of myocardial infarction [J].Journal of the American College of Cardiology,2012,60(16):1581-1598.
[3] Arregoces FE,Uriza CL, Velosa J, et al.Relation between ultrasensitive C-reactive protein,diabetes and periodontal disease in patients with and without myocardial infarction [J].Arq Bras Endocrinol Metab,2014,58(4):362-368.
[4] Yan X,Hegab AE,Endo J,et al.Lung natural killer cells play amajor counter-regulatory role in pulmonary vascular hyperpermeability after myocardial infarction[J].Circulation research, 2014,114 (4):637-649.
[5] 吴赛飞,梁宜,杜俊英,等.自然杀伤细胞在癌症中的角色探讨及针灸干预[J].中华中医药学刊,2014,32(4):796-800.
[6] Backteman K,Ernerudh J,Jonasson L.Natural killer(NK)cell deficit in coronary artery disease:no aberrations in phenotype but sustained reduction of NK cells is associated with low-grade inflammation[J].Clinical&Experimental Immunology,2014,175(1):104-112.
[7] Szymanowski A,Li W,Lundberg A,et al.Soluble Fas ligand is associated with natural killer cell dynamics in coronary artery disease[J].Atherosclerosis,2014,233(2):616-622.
[8] Souza-Fonseca-Guimaraes F,Adib-Conquy M,Cavaillon JM.Natural killer(NK)cells in antibacterial innate immunity:angels or devils? [J].Molecular Medicine,2012,18(2):270-285.
[9] Murdaca G,SpanòF,Miglino M,etal.Effects of TNF-αinhibitors upon themechanisms of action of VEGF[J].Immunotherapy,2013,5(2):113-115.
[10] Madrigano J, Mittleman MA, Baccarelli A, et al.Temperature,Myocardial Infarction,and Mortality:EffectModification by Individual and Area-Level Characteristics[J].Epidemiology(Cambridge,Mass.),2013,24(3):439-446.
[11] Simon T,Taleb S,Danchin N,et al.Oc026-Impact Of Circulating Levels Of Interleukin-17 And Cardiovascular Outcomes In Patients With Acute Myocardial Infarction[J].Clinical Therapeutics,2013,35(8):e11.
[12] Hofmann U, Knorr S, Vogel B, et al.Interleukin-13 Deficiency Aggravates Healing and Remodeling in Male Mice After Experimental Myocardial Infarction [ J].Circulation:Heart Failure, 2014:CIRCHEARTFAILURE.113.001020:113-114.
[13] Makkar RR,Smith RR,Cheng KE,et al.Intracoronary cardiospherederived cells for heart regeneration after myocardial infarction(CADUCEUS):a prospective, randomised phase 1 trial[J].The Lancet,2012,379(9819):895-904.
[14] Welt FGP,Gallegos R,Connell J,et al.Effect of cardiac stem cells on left-ventricular remodeling in a canine model of chronic myocardial infarction[J].Circulation:Heart Failure, 2013,6(1):99-106.
[15] Serti E,Werner JM,Chattergoon M,et al.Monocytes activate natural killer cells via inflammasome-induced interleukin 18 in response to hepatitis C virus replication[J].Gastroenterology,2014,84(1001):17-18.
[16] Bouchentouf M,Forner KA,Cuerquis J,et al.Induction of cardiac angiogenesis requires killer cell lectin-like receptor 1 and α4β7 integrin expression by NK cells[J].The Journal of Immunology,2010,185(11):7014-7025.
[17] Turillazzi E,Di Paolo M,Neri M,et al.A theoretical timeline for myocardial infarction:immunohistochemical evaluation and western blot quantification for Interleukin-15 and Monocyte chemotactic protein-1 as very early markers[J].Journal of translationalmedicine,2014,12(1):188-189.
[18] Frese-Schaper M,Keil A,Yagita H,et al.Influence of natural killer cells and perforin-mediated cytolysis on the development of chemically induced lung cancer in A/J mice[ J].Cancer Immunology,Immunotherapy,2014,63(6):571-580.
[19] Jiao Z,Wang W,Ma J,et al.Notch signaling mediates TNF-alphainduced IL-6 production in cultured fibroblast-like synoviocytes from rheumatoid arthritis[J].Clin Dev Immunol,2012, 2012:209-305.
[20] Thavendiranathan P, Verhaert D, Kendra KL, et al.Fulminant myocarditis owing to high-dose interleukin-2 therapy for metastatic melanoma[J].The British Journal of Radiology,2014, 84(1001):99-102.
(编校:吴茜)
Restructuring human interleukin-2 activation of natural killer cells rat infarction m yocardial function
GE Shun1,ZHU Bao-liang1,WANG Fu-wen2
(1.Basic Medicine,Jining Medical College,Jining 272067,China;2.Institute of Materia Medica,Shandong Academy of Medical Sciences,Key Laboratory for Rare Diseases of Shandong Province,Jinan 250062,China)
Objective To investigate the effect of recombinant human interleukin-2(rhIL-2)activated natural killer cells(NKC)on infarcted myocardium.Methods NKCwas isolated from mice and cultured in vitro,with one partof them was activated with rhIL-2.Then the lethality of two parts of NKC were determined.Cardiac microvascular endothelial cells in vitrowere co-cultured with rhIL-2-NKC,NKC and PBS solution,respectively for 0d and 7d,and evaluate the effect of rhIL-2-NKC on endothelial cells proliferation,with NKC group as negative control and PBS group as blank control.Three groups ofmyocardial infarcted micewere injected with rhIL-2-NKC,NKC and PBS solution respectively,and mRNA expression levels of monocyte chemoattractant protein-1(MCP-1),tumor necrosis factor-α(TNF-α)and interleukin-2(IL-2)in myocardium were determined by RT-PCR method after 0,1,2,4,8,16 d treatment.After that,three groups of mice were used to measure left ventricular systolic pressure(LVSP),left ventricular end diastolic pressure(LVEDP),mean arterial pressure(MAP),maximum rate of pressure rise(+dp/dt)and maximum rate of pressuredecrease(-dp/dt),and to determine the area and micro-vascular density(MVD)ofmyocardial infarction and protein levels of platelet endothelial cell adhesion molecules(CD31)and vascular endothelial growth factor(VEGF)ofmarginal area ofmyocardial infarction.Results The lethality of rhIL-2-NKC was increased,which was positively related with the ratio of effector cells to target cells.The cell proliferation of rhIL-2-NKC group was 1.28 times of blank control group,and the difference was significant(P<0.05).RT-PCR results demonstrated an upregulation of MCP-1,TNF-αand IL-2 mRNA levels,which were significantly higher than NKC and blank control groups during 2~8d(P<0.05).Results Hemodynamic parameters results showed that compared to NKC and blank control groups,rhIL-2-NKC goup had a higher level of LVEDP,MAP and+dp/dt,but a lower level of LVSP anddp/dt,the difference were all significant(P<0.05).Immunohistochemical results showed that rhIL-2-NKC group had a significant higher level of myocardial infarction area(19.23±5.61)and a significant lower level of MVD(15.29±1.77)than other groups(P<0.05).In the marginal area of myocardial infarction,the values of CD31 and VEGF protein levels of rhIL-2-NKC group were(238.17±16.82)and(21.32±16.97)respectively,which were significantly higher than that of NKC group(CD31=66.81±11.84,VEGF=87.33±10.18)and blank control group(CD31=29.23±5.57,VEGF=76.21±9.23,P<0.05).Conclusion The myocardial injection of rhIL-2-NKC could promote angiogenesis and therefore improve myocardial function.
rhIL-2;NKC;myocardium
R36.1
A
1005-1678(2014)06-0024-05
山东省自然科学基金(ZR2009CL009)
葛顺,男,硕士,讲师,研究方向:药理学,E-mail:geshun@163.com。
