穿心莲内酯对肺癌细胞MMP-9表达的影响及分子机制研究
2014-09-18罗湘玉罗卫民郑雪松
罗湘玉,罗卫民,郑雪松
(湖北医药学院附属太和医院 胸心外科,湖北 十堰 442000)
穿心莲内酯对肺癌细胞MMP-9表达的影响及分子机制研究
罗湘玉,罗卫民Δ,郑雪松
(湖北医药学院附属太和医院 胸心外科,湖北 十堰 442000)
目的观察穿心莲内酯(Andrographolide, AD)对肺癌细胞基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)表达的影响及其分子机制。方法体外培养肺癌细胞系H3255,分别用1.0,3.0和5.0 μmol/L AD处理细胞24 h,未处理组为空白对照。伤口愈合实验和侵袭实验分别检测AD对H3255细胞迁移与侵袭的影响。RT-PCR检测MMP-9 mRNA的表达;Western blot检测MMP-9蛋白表达和Akt磷酸化。荧光素酶报告基因分析NF-κB和MMP-9的活性。结果伤口愈合实验和Transwell小室实验结果显示,AD能在不影响细胞活性的条件下显著抑制H3255细胞侵袭和迁移。同时,Western blot和RT-PCR结果证实AD能抑制MMP-9蛋白及mRNA表达。此外,AD能抑制Akt磷酸化以及NF-κB的转录活性。PI3 K抑制剂LY 294002处理后,NF-κB-luc活性以及MMP-9蛋白表达显著降低。此外,不同浓度AD处理能显著抑制MMP-9的启动子活性。结论AD是一种潜在的抗肺癌细胞转移药物,它可能通过影响PI3 K/NF-κB通路抑制MMP-9表达而发挥作用。
穿心莲内酯;肺癌细胞;基质金属蛋白酶9
1 材料与方法
1.1 主要实验试剂与仪器 AD购自Sigma-Aldrich公司(纯度≥95%),并用二甲基亚砜溶解。细胞培养基为Invitrogen产品,培养板和Transwell小室购自Corning。Trizol试剂购自Invitrogen公司。RT-PCR试剂盒购自大连宝生物。抗MMP-9和β-actin抗体购自Santa Cruz。磷酸化Akt,总Akt抗体购自Cell Signaling。ECl化学发光试剂盒购自Amersham Pharmacia。NF-κB荧光素酶报告基因购自SABioscicence,双重荧光素酶实验系统购自Promega。pGL 3-basic载体和DNA转染试剂购自Invitrogen。主要实验仪器:光测定仪(Luminometer 20/20 n,Turner BioSystems),酶标仪(iMark,BIO-RAD),PCR 仪(Veriti,Applied Biosystems),倒置显微镜(TS-2000,Nicon)。
1.2 细胞培养 H3255细胞株购自购自ATCC,用含10%胎牛血清的RPMI-1640培养基于37℃,5% CO2条件下培养。分别设立对照组(加入等体积的DMSO)及不同浓度AD处理组(分别加入终浓度为1.0,3.0,5.0 μmol/L的AD作用24 h)。采用MTT观察AD对H3255细胞的增殖情况,即H3255孵育结束后,每孔加入30 μL MTT溶液(1 mg/mL)孵育2 h。弃上清,并加入200 μL DMSO,充分混匀,用酶标仪测定各孔的吸光度值(OD 570),并计算抑制率。抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%。
1.3 RT-PCR检测MMP-9 mRNA表达 采用Trizol提取RNA,并根据试剂盒提供的步骤进行RTPCR。PCR反应条件如下:94℃变性 30 s,65℃(MMP-9)或 59℃(GAPDH)30 s,72℃延伸 30 s。随后进入 40(MMP-9)或35(GAPHD)个扩增循环。其中MMP-9引物分别为5’-CGCTACCACCTCGAACTTTG-3’和 5’-GCCATTCAC GTCGTCCTTAT-3’,产物 196 bp。GAPDH:5’-TCACCAT CTTCCAGGAGCGA-3’,5’-CACAATGCCGAAGT GGTCGT-3’,产物700 bp。扩增产物随后经2%琼脂糖凝胶电泳,并采用Image J软件进行灰度分析并计算2者比值。
1.4 伤口愈合实验 通过伤口愈合实验测定细胞的迁移能力。将5×106细胞接种于6孔板中37℃培养6 h。待细胞呈单层贴壁生长后,用200 μL的移液管尖端在板上划痕。PBS洗涤后加入含有AD的完全培养基孵育24 h。在显微镜下拍照并计算迁移率:(1-处理后划痕距离/对照组划痕距离)×100%。
1.5 侵袭性实验 将基质胶均匀铺至Transwell小室上室,并加入100 μL细胞悬液(106/mL),下室加入500 μL完全培养基,37℃孵育24 h。取出Transwell,多聚甲醛固定,风干后加入0.1%结晶紫染色20 min。擦除上室细胞,显微镜下随机选择视野拍照,计算迁移到下腔表面的细胞数。其中侵袭抑制率=(1-样本穿膜细胞数/对照组穿膜细胞数)×100%。
1.6 Western blot 根据试剂盒提供的步骤提细胞总蛋白并测定其浓度。获取100 μg蛋白用于SDS-PAGE。分离的总蛋白或核蛋白随后转印至PVDF膜上(Millipore),并利用含5%脱脂牛奶的TBST封闭1 h,随后加入抗MMP-9或抗Akt抗体4℃孵育过夜。多次洗涤之后,加入HRP标记的抗体孵育1 h。ECL法(Amersham)发光、显影。
1.7 瞬时转染和荧光素酶报告基因分析 从Genebank获取MMP-9基因启动子序列(上游720 bp~11 bp),采用PCR方法将其克隆至pGL 3-basic载体上,构建pGL 3-MMP-9-luc报告基因质粒。生长于6孔板中的6 H 3255细胞随后共转入0.2 μg pGL 3-MMP-9-luc(或NF-κB-luc)质粒,以及0.2 μg pSV-β-半乳糖苷酶质粒。随后细胞加入不同浓度AD作用24 h。采用双重荧光素酶报告系统(Promega)计算萤光素酶活性的相对值。
1.8 统计学方法 应用SPSS 17.0进行统计学分析,正态计量数据用“±s”表示,并采用单因素方差分析方法,P<0.05为差异有统计学意义。
2 结果
2.1 AD抑制H3255细胞的迁移和侵袭 为了观察AD对H 3255侵袭和迁移的影响,首先应确定AD的最大作用浓度。MTT结果显示,1.0~5.0μmol/L AD处理对细胞的活性无明显影响(结果未显示)。伤口愈合实验显示:1.0,3.0,5.0μmol/L AD处理H3255细胞后,细胞迁移率分为为(67.07±4.27)%,(49.82±3.71)%和(37.08±2.74)%,与对照组相比,差异具有统计学意义(P<0.05)。Transwell结果显示,不同浓度的AD也能呈剂量依赖性方式抑制H3255细胞侵袭(见表1)。
2.2 AD抑制H3255细胞MMP-9蛋白及mRNA表达RT-PCR结果显示,H3255细胞未处理前,MMP-9 mRNA表达水平较高,经不同浓度AD处理后,其mRNA水平随着浓度的增高而降低(见图 1 A)。Western blot结果也显示,1.0~5.0 μmol/L AD处理后,MMP-9蛋白含量逐渐降低(见图1 B)。

图1 AD对MMP-9 mRNA(A)与蛋白(B)表达的影响1. 对照组;2. 1.0μmol/L AD组;3. 3.0μmol/L AD组;4. 5.0μmol/L AD组Fig.2 Effect of AD on the mRNA expression (A) andprotein expression (B) of MMP-91. Control;2. 1.0μmol/L AD group;3. 3.0μmol/L AD group;4. 5.0μmol/L AD group
2.3 AD抑制PI3 K/NF-κB通路的活性 Western blot结果显示,AD处理后,H 3255细胞中磷酸化Akt水平明显降低,而总Akt无明显影响(见图2A)。此外,报告基因结果显示,AD也能影响NF-κB-luc的转录活性,同时,采用20 μmol/L PI3 K抑制剂LY 294002处理后,NF-κB-luc活性显著降低(见图2B)。

图2 AD对H3255细胞PI3K磷酸化(A)及NF-κB活性(B)的影响1. 对照组;2. 1.0μmol/L AD组;3. 3.0μmol/L AD组;4. 5.0μmol/L AD组; 5. 20μmol/L LY294002*P<0.05,与对照组相比Fig.2 Effect of AD on PI3K phosphorylation (A) and NF-κB activity (B) in H3255 cells1. Control;2. 1.0μmol/L AD group;3. 3.0μmol/L AD group;4. 5.0μmol/L AD group;5. 20μmol/L LY294002*P<0.05,compared with control group
2.4 AD经PI3 K/NF-κB抑制MMP-9的表达与转录 Western blot显示,PI3 K抑制剂LY 294002和NF-κB抑制剂PDTC处理H3255细胞后,MMP-9表达显著降低(见图3A)。此外,报告基因显示,不同浓度AD处理能显著抑制MMP-9的启动子活性,从而抑制MMP-9的转录(见图3B)。
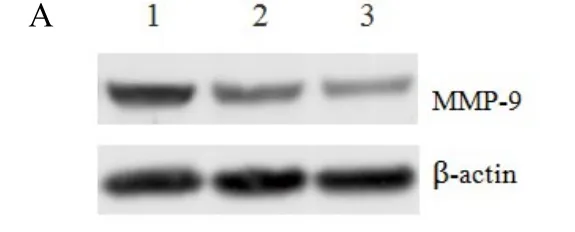
图3A PI3K和NF-κB抑制剂对MMP-9蛋白表达的影响1. 阴性对照;2. 20μmol/L LY294002;3. 20 μmol/L PDTCFig.3A Effect of PI3K and NF-κB inbitors on MMP-9 protein expression1. Control;2. 20μmol/L LY294002;3. 20μmol/L PDTC
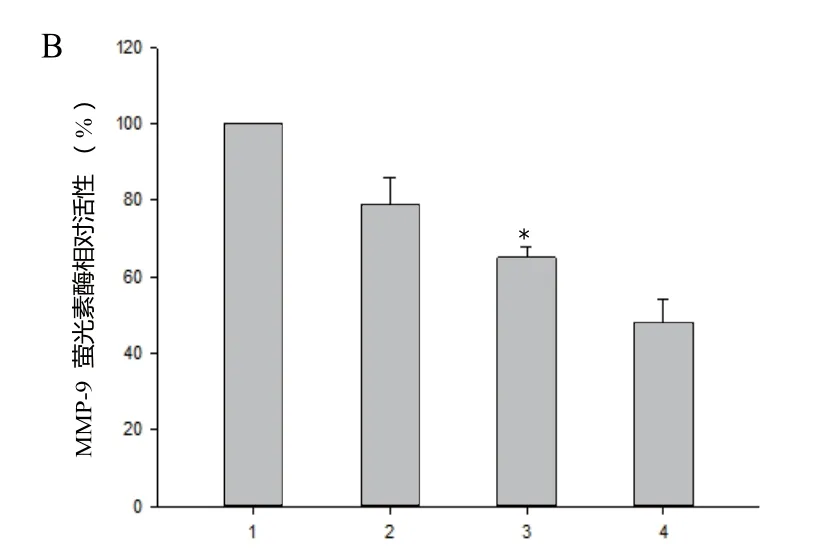
图3B AD对MMP-9转录活性的影响1. 对照组;2. 1.0μmol/L AD;3. 3.0μmol/L AD;4. 5.0μmol/L AD;*P<0.05,与对照组相比Fig.3B Effect of AD on MMP-9 transcriptional activity1. Control; 2. 1.0μmol/L AD;3. 3.0μmol/L AD;4. 5.0μmol/L AD*P<0.05,compared with control
3 讨论
对于肺癌而言,癌细胞的局部侵润以及远处转移是患者治疗失败和死亡的首要原因。癌细胞在侵润性生长过程中,ECM的降解是癌细胞从原发部位脱落,并经淋巴结或血液转移的关键[8]。而MMP-9在其中发挥至关重要作用[9]。因此,预防或抑制癌细胞侵润和转移在很大程度上可提高癌症患者的生存率。有研究显示:AD能抑制多种肿瘤细胞的增殖和转移[10-11];然而,AD对肺癌的抑制作用尚未完全清楚。本研究证实AD在无细胞毒性的浓度范围内能明显抑制H 3255细胞的侵润和转移,并能明显抑制明胶酶活性和MMP-9的表达,这表明AD在肺癌中通过抑制MMP-9的表达和活性而具有抗侵袭的潜能。
PI3 K是一种脂质激酶,通过激活Akt(蛋白激酶B)控制多种生理过程,它通过诱导P 21 WAF1定位于细胞质,并通过灭活前凋亡因子BAD和caspase-9发挥抗凋亡作用;此外,活化的Akt可通过诱导MMPs的表达而促进癌细胞侵袭和转移[12]。研究显示,MMP-9 mRNA含量与PI3 K的活性成正相关[13]。本研究也证实,AD能抑制PI3 K产物Akt磷酸化,从而抑制MMP-9的表达。NF-κB是Akt下游通路的重要靶分子。并参与调控MMP-9的表达,并与炎症、肿瘤细胞增殖、侵润和转移密切相关[14]。此外,NF-κB在多种肿瘤细胞中持续激活,并诱导多种抗凋亡蛋白表达而导致化疗/放疗耐受[15]。因此抑制NF-κB的活性可能有利于提高药物的疗效。本研究结果显示,AD可有效抑制NF-κB转录活性。由于MMP-9的启动子区域存在NF-κB的结合位点[16],因此本研究构建了MMP-9启动子序列的报告基因,结果也证实,AD可通过影响PI3 K/NF-κB的活性,从而抑制MMP-9的转录激活作用。
综上所述,本研究通过体外实验证明AD具有抑制H3255细胞侵润的能力。其机制可能通过抑制PI3 K/ NF-κB信号通路,最终下调MMP-9的活性及表达有关。这表明AD可能是一种富有前途的抗癌辅助药物。尽管如此,但其在体内的分布以及转运仍不清楚,此外,不同的肿瘤细胞,对AD的敏感性也可能有所不同。在随后的研究中,我们将通过动物实验对其安全性和代谢动力学等方面开展更进一步研究。
[1] Irwin KE,Greer JA,Khatib J,et al.Early palliative care and metastatic nonsmall cell lung cancer: potential mechanisms of prolonged survival[J].Chron Respir Dis,2013,10(1):35-47.
[2] Donington JS.Current readings: sublobar resection for non-small-cell lung cancer[J].Semin Thorac Cardiovasc Surg,2013,25(1):22-29.
[3] Nakayama Y,Okazaki K,Shibao K,et al.Alterative expression of the collagenase and adhesion molecules in the highly metastatic clones of human colonic cancer cell lines[J].Clin Exp Metastasis,1998,16(5):461-469.
[4] Schveigert D,Cicenas S,Bruzas S,et al.The value of MMP-9 for breast and non-small cell lung cancer patients' survival[J].Adv Med Sci,2013,58(1):73-82.
[5] Lee JC,Tseng CK,Young KC,et al.Andrographolide exerts anti-hepatitis C virus activity by up-regulating haeme oxygenase-1 via the p 38 MAPK/Nrf 2 pathway in human hepatoma cells[J].Br J Pharmacol,2014,171(1):237-252.
[6] Lin HH,Tsai CW,Chou FP,et al.Andrographolide down-regulates hypoxiainducible factor-1 alpha in human non-small cell lung cancer A 549 cells[J].Toxicol Appl Pharmacol,2011,250(3):336-345.
[7] Kuttan G,Pratheeshkumar P,Manu KA,et al.Inhibition of tumor progression by naturally occurring terpenoids[J].Pharm Biol,2011,49(10):995-1007.
[8] Mook OR,Frederiks WM,Van Noorden CJ.The role of gelatinases in colorectal cancer progression and metastasis[J].Biochim Biophys Acta,2004,1705(2):69-89.
[9] Klein G,Vellenga E,Fraaije MW,et al.The possible role of matrix metalloproteinase(MMP)-2 and MMP-9 in cancer, e.g. acute leukemia[J].Crit Rev Oncol Hematol,2004,50(2):87-100.
[10] Roy P,Das S,Mondal A,et al.Nanoparticle engineering enhances anticancer efficacy of andrographolide in MCF-7 cells and mice bearing EAC[J].Curr Pharm Biotechnol,2012,13(15):2669-2681.
[11] Manoharan S,Singh AK,Suresh K,et al.Anti-tumor initiating potential of andrographolide in 7,12-dimethylbenz anthracene induced hamster buccal pouch carcinogenesis[J].Asian Pac J Cancer Prev,2012,13(11):5701-5708.
[12] Chen JS,Wang Q,Fu XH,et al.Involvement of PI3 K/PTEN/AKT/mTOR pathway in invasion and metastasis in hepatocellular carcinoma:Association with MMP-9[J].Hepatol Res,2009,39(2):177-186.
[13] Hildebrandt MA,Yang H,Hung MC,et al.Genetic variations in the PI3 K/PTEN/AKT/mTOR pathway are associated with clinical outcomes in esophageal cancer patients treated with chemoradiotherapy[J].J Clin Oncol,2009,27(6):857-871.
[14] Kim Y,Kang H,Jang SW,et al.Celastrol inhibits breast cancer cell invasion via suppression of NF-kB-mediated matrix metalloproteinase-9 expression[J].Cell Physiol Biochem,2011,28(2):175-184.
[15] Lee CH,Jeon YT,Kim SH,et al.NF-kappaB as a potential molecular target for cancer therapy[J].Biofactors,2007,29(1):19-35.
[16] Wu HT,Sie SS,Kuan TC,et al.Identifying the regulative role of NF-kappaB binding sites within promoter region of human matrix metalloproteinase 9 (mmp-9) by TNF-alpha induction[J].Appl Biochem Biotechnol,2013,169(2):438-449.
Effect of andrographolide on MMP-9 expression in lung cancer cell and its molecular mechanism
LUO Xiang-yu, LUO Wei-minΔ, ZENG Xue-song
(Department of Cardiothoracic Surgery,Hubei University of Medicine Affiliated Taihe Hospital of Shiyan, Shiyan 442000, China)
ObjectiveTo investigate the effect and molecular mechanism of Andrographolide (AD) on matrix metalloproteinase-9 (MMP-9)expression in human colon cancer H3255 cells.MethodsHuman lung cancer H3255 cell line weve cultured in vitro, and treated with 1.0, 3.0, 5.0 μmol/L AD for 24 h, untreated cells were used as blank control. Cell viability, cell migration and cell invasion were analyzed by MTT assay, scratch healing assay and transwell membrane assay, respectably. Expression of MMP-9 mRNA was analyzed by RT-PCR. Protein expression and phosphorylation of Akt were detected by Western blot. Activity of NF-κB and MMP-9 were analyzed by luciferase reporter assay.ResultsAD could significantly reduced H 3255 cells invasion and migration without affecting the viability of cells, as demonstrated by scratch healing and transwell membrane assay. Furthermore,Western blot and RT-PCR results showed that AD could markedly inhibited MMP-9 activity and its expression in both protein and mRNA levels. AD could attenuated Akt’s phosphorylation and the activity of NF-κB. Moreover, LY 294002, an inhibitor of PI3 K, could significantly inhibited NF-κB transcriptional activity and MMP-9 expression. In addition, different concentrations of AD could inhibit the promote activity of MMP-9.ConclusionAD was a potential anti-invasive agent by inhibiting MMP-9 involved in PI3 K/NF-κB pathways.
Andrographolide; human lung cancer cells; matrix metalloproteinase-9
R 734.2
A
1005-1678(2014)02-0013-04
肺癌是各类癌症死亡的首位。尤其是非小细胞肺癌(non small cell lung cancer,NSCLC)最常见(占肺癌总数的 80%以上)[1]。肺癌起病隐匿,90%以上患者死于癌细胞的侵袭和转移[2]。在此过程中,肿瘤细胞从原发灶脱落,并降解细胞外基质(extracellular matrix, ECM)是肿瘤发生转移的最重要病理生理改变,而此过程与基质金属蛋白酶(matrix metalloproteinases,MMPs)的活性密切相关[3-4]。因此,以MMPs为研究靶点,探索抑制MMPs活性的治疗药物,对肺癌的治疗具有重要意义。
穿心莲内酯(Andrographolide,AD)是我国传统中草药穿心莲中提取出来的一类二萜类化合物。它通常作为一种消炎解毒药物用于治疗各种感染性疾病[5]。近年来研究发现,AD除了传统的抗病毒作用外,也具有抗肿瘤的潜能[6-7]。尽管如此,但AD能否影响肺癌细胞的迁移与侵袭目前仍不清楚。本研究旨在观察AD对肺癌H3255细胞的迁移与侵袭有何影响,并探讨其可能的调控机制。
国家自然科学基金(81372984)
罗湘玉,女,副主任护师,研究方向:心肺疾病的防治研究,E-mail:xiangyu_luo@126.com;罗卫民,通信作者,男,硕士,主治医师,研究方向:胸心外科疾病的诊断与治疗,E-mail: weiminluo@163.com。
