可断裂PEG与RGD共修饰脂质体的制备及其初步评价
2014-09-18岳枫贾义军
岳枫,贾义军
(河南省鹤壁职业技术学院 护理学院,河南 鹤壁 458030)
可断裂PEG与RGD共修饰脂质体的制备及其初步评价
岳枫,贾义军
(河南省鹤壁职业技术学院 护理学院,河南 鹤壁 458030)
目的制备氧化-还原敏感的可断裂PEG(聚乙二醇,polyethylene glycol)与RGD(精氨酸-甘氨酸-天冬氨酸,Arg-Gly-Asp)共修饰脂质体(C/RGD-LP),并对其体外性质进行评价。方法采用薄膜分散法制备可断裂PEG与RGD共修饰脂质体,测定脂质体的粒径、电位以及血清稳定性。采用流式观察肝癌HepG2细胞在PEG断裂前后对脂质体摄取效率的变化。MTT法检测该脂质体对细胞的毒性。结果C/RGD-LP的粒径为(104.8±5.5)nm,电位为(-4.45±1.75)mV,在血清中有良好的稳定性。加入还原剂半胱氨酸后,HepG2细胞对PEG断裂后的脂质体摄取效率为断裂前的2.8倍,差异有统计学意义(P<0.01);细胞摄取实验结果显示:加入还原剂半胱氨酸后,PEG断裂后细胞的荧光强度显著强于未加入Cys组和无RGD修饰普通脂质体组(P<0.01)。MTT实验结果表明:C/RGD-LP无明显细胞毒性。结论可断裂PEG与RGD共修饰脂质体制备方法简单,具有良好的稳定性,PEG能够有效屏蔽RGD肽,是一种潜在的肿瘤靶向给药系统。
可断裂PEG;脂质体;肿瘤靶向
1.2 方法
1.2.1 DSPE-S-S-PEG5000的合成:参照文献[3-4]方法合成DSPE-S-S-PEG5000。将63mg DSPE和25mg SPDP溶于4mL干燥的二氯甲烷,再加入60μL三乙胺,通氩气于室温避光反应5h,TLC(展开剂二氯甲烷∶甲醇∶水=65∶25∶4)监测至2种原料基本消失,旋转蒸发除去溶剂,用300~400目硅胶装柱(1.5 cm×10.0 cm),用二氯甲烷∶甲醇=4∶1洗脱,得到DSPEPDP纯品。将61mg DSPE-PDP和180mg PEG5000-SH溶于6mL干燥的二氯甲烷,再加入5μL三乙胺,通氩气于室温避光反应72 h,TLC(展开剂二氯甲烷∶甲醇=2∶0.3)监测至反应基本完全。过滤除去不溶物,旋转蒸发浓缩至干,乙醚重结晶2次,再用300~400目硅胶装柱分离纯化,用DCM∶MeOH=50∶15洗脱,所得产物纯度约95%,-20℃储存备用。
1.2.2 C/RGD-LP的制备及其表征:使用薄膜分散法制备RGD与可断裂PEG共修饰脂质体[5-6]。将处方量的SPC,Cho,DSPE-PEG2000-RGD,DSPE-S-S-PEG5000,DSPE-PEG5000-OMe[保证总磷脂∶胆固醇=70∶30(摩尔比)],分别溶于氯仿,置50mL茄形瓶中旋转蒸发成膜后,再置真空干燥器中过夜。加入2.5mL PBS缓冲液(pH 7.4),置空气浴摇床中,37℃,180 r/min,20min水化,水浴超声5min脱膜,探头超声制备得到RGD与可断裂PEG共修饰的脂质体。用适量的FITC标记的磷脂取代SPC制备FITC标记的磷脂。
1.2.3 C/RGD-LP的体外血清稳定性实验:取LP、RGD-LP和C/RGD-LP脂质体样品各500μL,分别与等体积的磷酸盐缓冲液或含有50%FBS的磷酸盐缓冲液(pH7.4)混合,于37℃下分别孵育 1、4、8、12、24 h,测定 750 nm处的透光率[7-8]。以样品在磷酸盐缓冲液中的透光率值为对照,样品在含有50%FBS的磷酸盐缓冲液中的透光率与其在磷酸盐缓冲液中的透光率的比值来评价脂质体在血清中的稳定性。
1.2.4 细胞摄取实验:将对数生长期的HepG2细胞以5×105个/孔的密度接种于6孔板中,37℃培养24 h后分成4组,普通脂质体组(LP),RGD修饰脂质体组(RGD-LP),可断裂PEG和RGD共修饰脂质体(C/RGD-LP)组、可断裂PEG和RGD共修饰脂质体(C/RGD-LP)+半胱氨酸组。每组脂质体均用FITC标记,孔中脂质体浓度为0.20μg/mL。37℃孵育4 h后除去含脂质体培养基,冷PBS清洗3次,0.25%胰酶消化后离心,再用PBS清洗3次,采用流式细胞仪测定细胞荧光值。
取同样4种脂质体,与HepG2细胞共同孵育4 h后用PBS漂洗3次,加入2μg/mL DAPI溶液,室温孵育20min,冰PBS漂洗3次,加4%多聚甲醛固定15min,弃去多聚甲醛,置激光共聚焦显微镜观察细胞摄取情况。
1.2.5 细胞毒性实验:培养HepG2细胞,并以1×105/孔密度接种于96孔板中,随机分为 PBS组、LP组、C/RGD-LP组、RGD-LP组、半胱氨酸组。当孔板中细胞完全贴壁且处于对数生长期时加入无菌过滤后的脂质体或半胱氨酸。分别将孔板移入37℃5%CO2孵箱中培养24 h和48 h后取出,每孔加入20μL 5mg/mLMTT溶液,再放回孵箱中继续孵育4 h。将孔板中液体倒出,每孔加入200μL DMSO,37℃避光振摇15min,酶标仪测定490 nm处各孔的光密度值(OD)。
1.3 统计学方法 采用SPSS 21.0进行数据分析,正态计量数据以“±s”表示,2组间比较用t检验,多组间比较用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 DSPE-S-S-PEG5000的鉴定 将产物溶于 CDCl3,经400MHz核磁共振仪分析,结果见图 1。1H-NMR(CDCl3):δ=0.83(t,CH3,6H),1.2(s,CH2,52H),1.6(br,CH2CH2C=O,8H),3.4(s,3H,CH3O-),3.5-3.6(s,456H,PEG骨架),5.4(m,4H,DSPE双键)。
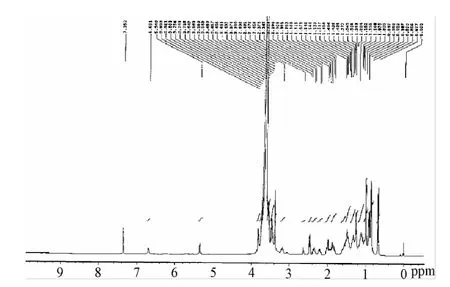
图1 DSPE-S-S-PEG5000的1 H-NMRFig.1 1 H-NMR of DSPE-S-S-PEG5000
2.2 可断裂PEG和RGD共修饰脂质体的表征 马尔文激光粒度仪测定结果显示:C/RGD-LP的粒径为(104.8±5.5)nm,电位为(-4.45±1.75)mV(见表1)。
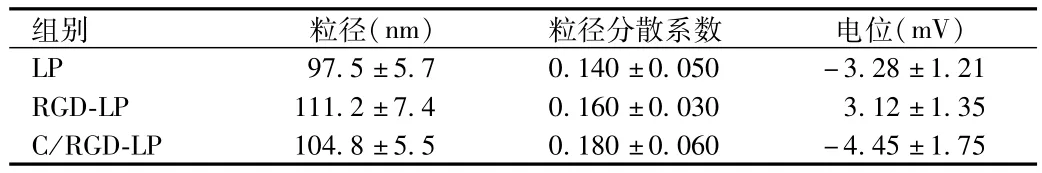
表1 不同脂质体表征Tab.1 Characteristics of C/RGD-LP,RGD-LP and LP
2.3 可断裂PEG和RGD共修饰脂质体的体外血清稳定性
各组脂质体在含50%FBS的PBS中透光率与其在不含血清的PBS中透光率的比值均大于90%,表明3种脂质体24h在血清中均具有较好的稳定性(见图2)。
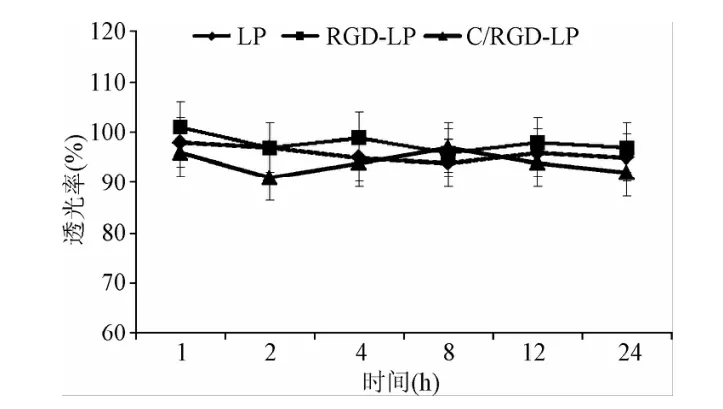
图2 不同脂质体在50%血清中的透光率Fig.2 Transmittance variation of different liposomes in 50%FBS
2.4 肿瘤细胞对可断裂PEG和RGD共修饰脂质体的摄取
加入还原剂半胱氨酸后,HepG2细胞对可断裂PEG与RGD修饰脂质体的摄取效率显著大于未加入半胱氨酸组,PEG断裂后细胞摄取是未加半胱氨酸组的2.9倍,差异具有统计学意义(P<0.01);可断裂PEG+半胱氨酸组的荧光强度与RGD修饰脂质体相当。未加入半胱氨酸组脂质体的荧强度与普通脂质体相当,差异无统计学意义(见图3、图4)。
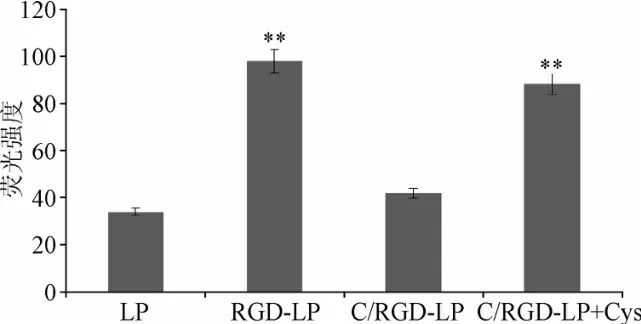
图3 HepG2细胞对不同脂质体摄取效率比较**P<0.01,与 LP和 C/RGD-LP比较Fig.3 Comparison of uptake efficacy of different liposomes by HepG2 cells**P<0.01,compared with LP and C/RGD-LP
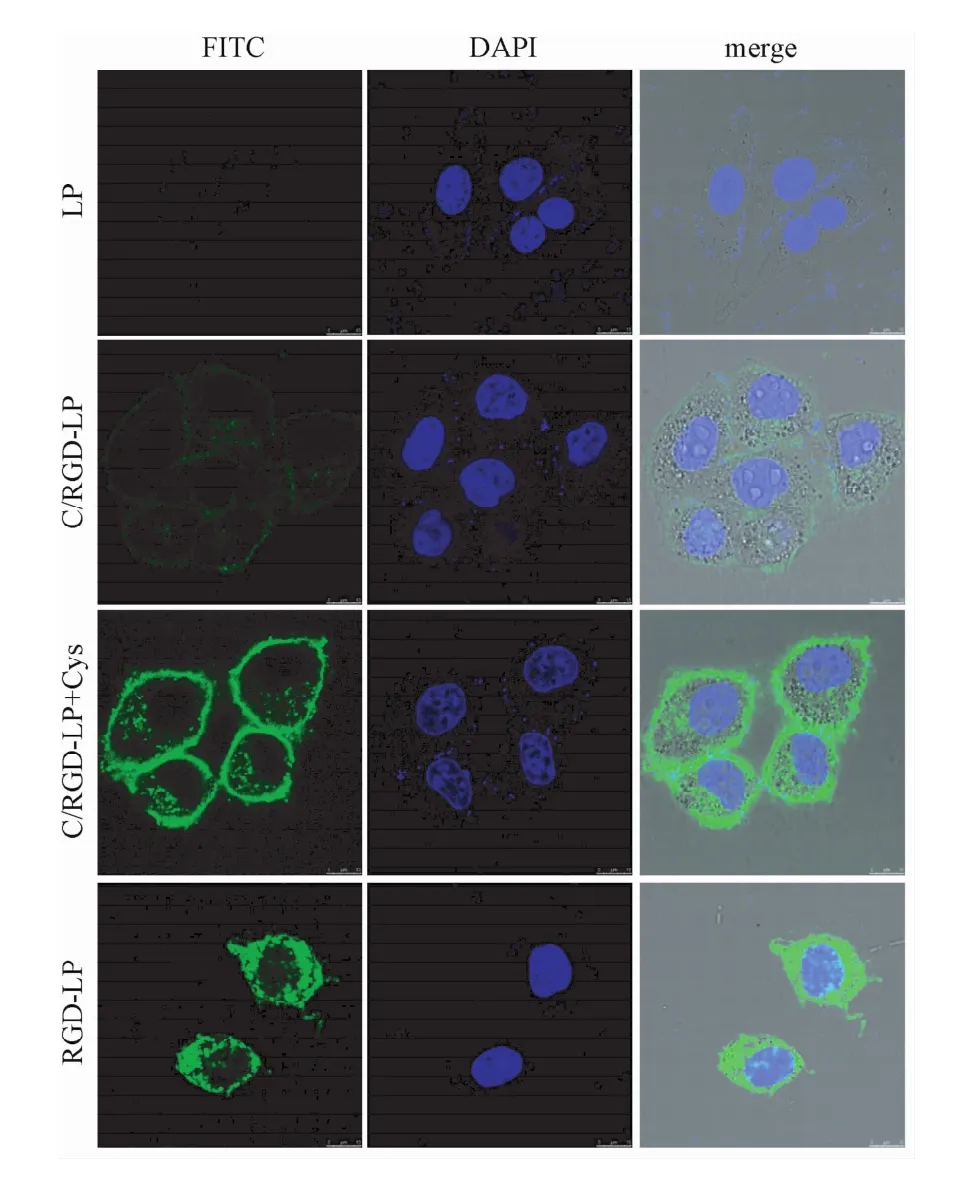
图4 激光共聚焦观察HepG2细胞对FITC标记脂质体的摄取Fig.4 Uptake of FITC labeled liposomes by HepG2 cell based on confocal laser scanningmicroscopy
2.5 可断裂PEG和RGD共修饰脂质体的细胞毒性 与PBS比较,各组脂质体和半胱氨酸在24 h和48 h对HepG2细胞毒性均较小,差异无统计学意义(见表2)。
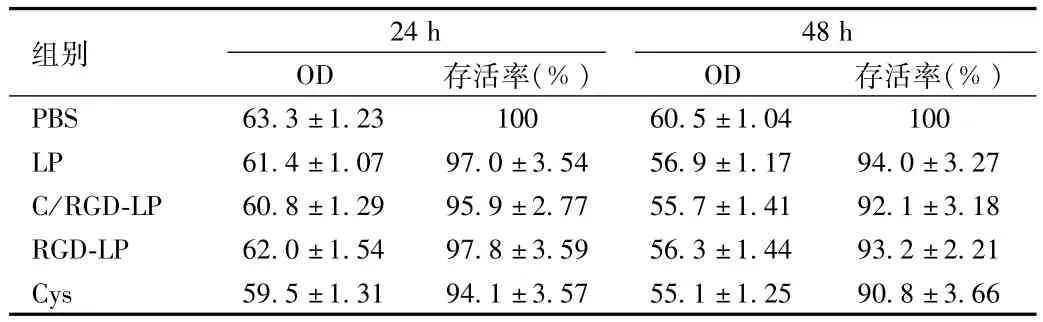
表2 HepG2细胞不同脂质体在不同时间下的OD值和存活率Tab.2 Cell viability and OD values of HepG2 cells at different times
3 讨论
整合素(Integrins)是一类细胞黏附受体分子,在有核细胞表面均广泛表达,其中整合素αvβ3在肝癌、黑色素瘤、肺癌等多种肿瘤细胞及肿瘤相关的内皮细胞表面高度表达,与肿瘤的血管发生、肿瘤转移及肿瘤的抗放射治疗密切相关,因此整合素αvβ3常被用作肿瘤靶向的特异性靶点[9-10]。有研究表明,精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)的三肽序列能够特异性地识别含αv亚基的整合素家族,具有高度亲和力[10]。近年来,脂质体表面的PEG化被广泛用于延长纳米载体的循环时间从而通过EPR效应(增强的穿透和滞留效应)增加其在肿瘤组织的蓄积,然而PEG并非在肿瘤靶向的整个过程中都是有利的,当脂质体在肿瘤组织蓄积以后,PEG会防碍纳米载体与肿瘤细胞的相互作用,抑制肿瘤细胞对纳米载体的摄取[11]。聚乙二醇PEG被广泛用于修饰到脂质体等纳米载体表面,不影响脂质体的长循环性能,而当脂质体蓄积在肿瘤组织以后,PEG脱离脂质体表面,这样既保留了PEG赋予脂质体的长循环的优点,又克服了PEG妨碍脂质体入胞的缺陷[12]。目前,基于不同原理的可断裂PEG技术相继被开发出来并被应用于纳米载体的修饰上,例如pH敏感型可断裂 PEG[13],基质金属蛋白酶敏感型可断裂 PEG[14],酯酶敏感型可断裂 PEG[15],还原敏感型可断裂 PEG[16]等,在众多的实现PEG断裂的策略中,还原敏感型可断裂PEG以二硫键作为桥接分子形成的可断裂PEG具有构造简单,断裂易于通过Cys控制等特点显示出了一定的优越性。
本研究制备了可断裂PEG和整合素受体特异性结合肽RGD共修饰的脂质体,能够首先通过EPR效应被动靶向到达肿瘤组织,加入半胱氨酸后,PEG与脂质体间的二硫键断裂,暴露出RGD后与肿瘤细胞表面的整合素受体结合,介导脂质体入胞。通过比较加入半胱氨酸前后肿瘤细胞对脂质体摄取效率的变化,发现加入半胱氨酸后,肿瘤细胞对脂质体的摄取效率显著增强(P<0.01)。肝癌细胞对未加入半胱氨酸组的摄取效率与普通脂质体相当,这说明脂质体表面大量PEG的存在能够有效屏蔽RGD,使脂质体在体内与血清蛋白隔绝,保持脂质体的稳定性。体外血清稳定性实验结果显示,可断裂PEG修饰后的脂质体在血清中能够保持良好的稳定性。体外细胞毒性实验结果显示,可断裂PEG和RGD共修饰的脂质体对肿瘤细胞几乎没有毒性。
综上所述,本研究制备的可断裂PEG修饰的脂质体能够有效保护脂质体,是一种潜在的肿瘤靶向给药系统。下一步将对可断裂PEG和RGD共修饰脂质体的载药性能进行研究。
[1] Jiang XY.Solid tumor penetration by integrin-mediated pegylatedpoly(trimethylene-carbonate)nanoparticles loaded with paclitaxel[J].Biomaterials,2013,34(6):1739-1746.
[2] Yao Q.Liposome formulated with TAT-modified cholesterol for enhancing the brain delivery[J].International Journal of Pharmaceutics,2011,419(1):85-95.
[3] Kuai R.Efficient delivery of payload into tumor cells in a controlled manner by TAT and thiolytic cleavable PEG Co-Modified liposomes[J].Mol.Pharmaceutics,2010,7(5):1816-1826.
[4] Kuai R.Targeted delivery of cargoes into a murine solid tumor by a cell-penetrating peptide and cleavable Poly(ethylene glycol)comodified liposomal delivery system via systemic administration [J].Mol.Pharmaceutics,2011,8(6):2151-2161.
[5] Ryo S,Tomoko T,Yasuhiro K,et al.Effective anti-tumor activity of oxaliplatin encapsulated in transferrin-PEG-liposome[J].International Journal of Pharmaceutics,2008,346(1-2):143-150.
[6] Yao Q.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeutic efficacy on brain glioma in animals[J].International Journal of Pharmaceutics,2011,420(2):304-312.
[7] Ikramy A.Octaarginine-modified liposomes:Enhanced cellular uptake and controlled intracellular trafficking[J].International Journal of Pharmaceutics,2008,354(1-2):39-48.
[8] Kale A.Enhanced transfection of tumor cells in vivo using“Smart”pH-sensitive TAT-modified pegylated liposomes[J].J.Drug Targeting,2007,15(7-8):538-545.
[9] Hegi ME.MGMT gene silencing and benefit from temozolomide in glioblastoma[J].N Engl JMed,2005,352(10):997-1003.
[10]Ying X.Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J].Journal of Controlled Release,2010,141(2):183-192.
[11]Li J.Targeting the brain with PEGPLGA nanoparticles modified with phage-displayed peptides[J].Biomaterials,2011,32(21):4943-4950.
[12]Zhan C.Cyclic RGD conjugated poly(ethyleneglycol)-co-poly(lactic acid)micelle enhances paclitaxel anti-glioblastoma effect[J].JControl Release,2010,143(1):136-142.
[13]Terada T.Novel PEG-matrixmetalloproteinase-2 cleavable peptide-lipid containing galactosylated liposomes for hepatocellular carcinomaselective targeting[J].J.Controlled Release,2006,111(3):333-342.
[14]Chang SF.Targeted microbubbles for ultrasound mediated gene transfection and apoptosis induction in ovarian cancer cells[J].Ultrasonics Sonochemistry,2013,20(1):171-179.
[15]Al SorajM.siRNA and pharmacological inhibition of endocytic pathways to characterize the differential role of macropinocytosis and the actin cytoskeleton on cellular uptake of dextran and cationic cell penetrating peptides octaarginine(R8)and HIV-Tat[J].Journal of Controlled Release,2012,161(1):132-141.
[16]Xu H.Esterase-catalyzed dePEGylation of pH-sensitive vesiclesmodified with cleavable PEG-lipid derivatives[J].J.Controlled Release,2008,130(3),238-245.
(编校:吴茜)
Preparation of cleavable PEG and RGD co-modified liposomes in vitro and evaluate its properties
YUE FengΔ,JIA Yi-jun
(Hebi City Occupational Technological College,Hebi458030,China)
ObjectiveTo prepare the cleavable PEG and RGD co-modified liposome for tumor targeting.MethodsLiposomes were prepared by film-ultrasonic method.The particle size,Zeta potentialand stability in FBSwere evaluated.Cellular uptake by HepG2 cellwas explored.MTT assaywas used to evaluate the cytotoxicity of blank liposomes.ResultsThe particle diameter of C/RGD-LP was(104.8±5.5)nm with the Zeta potential of(-4.45±1.75)mV.The cellular uptake of C/RGD-LP increased 2.8 times after Cys was added.The C/RGD-LP showed little cytotoxicity to HepG2 cell.ConclusionCleavable PEG and RGD co-modified liposomeswere easy to prepare and has a special application value for targeting tumor.
cleavable PEG;liposomes;tumor targeting
R945
A
1005-1678(2014)04-0056-04
随着现代生物研究的发展,对肿瘤疾病的治疗手段也日益丰富。其中靶向治疗成为了肿瘤研究和治疗的热点[1]。理想的肿瘤靶向药物传递系统不仅需要在全身给药后将药物浓集在肿瘤组织,而且还需要将药物高效地传递到肿瘤细胞内,从而将治疗作用最大化并减少抗肿瘤药物的副作用[2]。本研究旨在构建可断裂PEG与RGD共修饰的脂质体,使其能通过EPR效应到达肿瘤组织,在加入半胱氨酸后,二硫键断裂,暴露出RGD,再通过RGD与整合素受体介导入胞实现靶向治疗。现对其体外特征进行评价。
1 材料与方法
1.1 材料与仪器 人源肝癌细胞(HepG2,ATCC)。Sizer Nano ZS90型激光粒度仪及ZETA电位分析仪(英国 Malvern instruments Ltd)。大豆磷脂(SPC,上海太伟药业有限公司);SPDP[N-succinimidyl3-(2-pyridyldithio)propionate,美国 sigma公司];胆固醇(Chol,成都科龙化工);DSPE-PEG2000和 DSPEPEG5000(美国Avanti polar lipids);FITC标记的磷脂(美国sigma公司);DMEM高糖培养基和胎牛血清(美国GIBCO公司);其余试剂为国产分析纯。
岳枫,女,硕士,讲师,研究方向:药物新剂型,E-mail:yuefeng197@126.com。
