大黄乙醇提取物体外抗麻疹病毒作用实验研究*
2014-09-17李文娟宋艳艳王志玉
李文娟 宋艳艳 王志玉
(1济宁医学院法医学与医学检验学院,山东 济宁 272067;2山东大学公共卫生学院,山东 济南 250012)
麻疹是由麻疹病毒(measles virus,MV)引起的人类急性全身性呼吸道传染病,是世界性高传染性的病毒性疾病之一[1]。虽然减毒活疫苗的应用使麻疹发病率明显降低,但麻疹仍是发展中国家小儿死亡的重要原因[2-3]。对于麻疹的治疗,化学合成药物的抗病毒效果并不显著[4]。因此寻找有效抗麻疹病毒药物仍然是亟待解决的问题。研究显示,大黄对多种病毒具有抑制和杀灭作用[5-7],但是对麻疹病毒的功效还有待研究。为探讨大黄是否具有抗麻疹病毒的作用及其作用机制,本文通过抗病毒生物合成组、直接杀灭组、预防作用组3种加药方式,使用麻疹病毒野毒株、标准株和疫苗株,根据细胞病变效应(cytopathic effect,CPE),观察大黄乙醇提取物在Vero-SLAM细胞上的抗麻疹病毒的效果。
1 材料与方法
1.1 病毒
MV野毒株(MV1)由山东省疾病预防控制中心提供,2004年分离自山东济宁麻疹暴发的病人,MV标准株(MV2)、S191疫苗株(MV3) 由山东省疾病预防控制中心提供,于敏感细胞上稳定传代3次后保存备用,实验时稀释至100 TCID50/50μl使用。
1.2 细胞
Vero-SLAM细胞由山东省疾病预防控制中心提供,常规传代后使用。
1.3 药物
大黄乙醇提取物由山东省医学科学院药物所提供,用前将乙醇挥发后,以Hanks缓冲液稀释,生药含量为10g/L,置于4℃备用。病毒唑由山东鲁抗制药集团有限公司生产,规格为50g/L,以Hanks缓冲液稀释,置于4℃备用。
1.4 实验药物的细胞毒性作用
用Hanks缓冲液将待测药物倍比稀释,在96孔培养板中加入细胞悬液200μl,待细胞长成单层后,加入不同浓度的药物,50μl/孔,每一浓度加4复孔,同时设不加药物的正常细胞对照,于37℃ CO2培养箱中培养,每日观察细胞形态变化,观察至第7天判定结果。与细胞对照组相比,相同培养时间内未致细胞死亡的最大药物浓度为TC0。药物抗病毒实验时以TC0作为实验用药的上限剂量。
1.5 药物抗病毒生物合成作用
选择对细胞无毒性的药物浓度范围,用Hanks缓冲液稀释待测药物;用细胞维持液将病毒原液稀释至100 TCID50/50μl;在96孔培养板中加入Vero-SLAM细胞悬液200μl,待细胞长成致密单层后,弃去培养液,加入100μl维持液及稀释的病毒液和不同浓度的药物各50μl,每一浓度设4复孔,同时设正常细胞对照(只加细胞维持液,不加病毒和药物)和病毒对照(只加细胞维持液和病毒,不加药物);置于37℃ CO2培养箱中培养,每日于倒置显微镜下观察细胞形态变化,以细胞病变程度判断实验药物抗病毒作用[8]。
1.6 药物对MV直接杀灭作用
选择对细胞无毒性的药物浓度范围,用Hanks缓冲液稀释待测药物;用细胞维持液将病毒原液稀释至100 TCID50/50μl,将不同浓度的药物与病毒液等量混合后,置37℃培养箱中分别作用6h、24h;将药物和病毒液作用后的混合物加至Vero-SLAM细胞单层的96孔培养板上,每一浓度和时间设4复孔,同时设正常细胞对照和病毒对照;置于37℃ CO2培养箱中培养。
1.7 药物对MV感染的预防作用
选择对细胞无毒性的药物浓度范围,用Hanks缓冲液稀释药物;在96孔培养板中加入Vero-SLAM细胞悬液200μl,待细胞长成单层后,加入不同浓度的药物50μl/孔,分别作用24h、48h,然后弃去96孔培养板中的培养液,加入100μl 细胞维持液和100 TCID50/50μl病毒液50μl,同时设正常细胞对照和病毒对照;于37℃ CO2培养箱中培养。
1.8 结果判定
CPE一般是通观察整个单层区,权衡总的情况,以下列符号表示其病变程度:-:表示无细胞病变;+:表示25%的细胞有病变;:表示50%的细胞有病变;:75%的细胞有病变;:100%的细胞有病变[9]。 当细胞对照生长良好,病毒对照CPE达“”时,进行药物抗病毒作用的结果判定。以能抑制50% CPE 的最小药物浓度为药物抗病毒最小有效浓度(MIC)。治疗指数(TI)=TC0/ MIC。
2 结果
2.1 实验药物对Vero-SLAM细胞的毒性作用
将不同浓度的药物作用于Vero-SLAM细胞,对其毒性作用主要表现为细胞变圆、固缩、脱落等。当大黄乙醇提取物的浓度≤5000μg/ml时,细胞形态正常;当病毒唑浓度≤500μg/ml时,细胞形态正常。由此可知,大黄乙醇提取物和病毒唑的TC0分别为5000μg/ml和500μg/ml。
2.2 大黄乙醇提取物在Vero-SLAM细胞上抗麻疹病毒作用
倒置显微镜下观察显示,Vero-SLAM细胞对照(只加细胞维持液,不加病毒和药物),细胞形态良好,仅有个别衰老细胞。感染MV后出现细胞融合,胞浆内可出现包涵体,随着时间的延长,融合区域增大,并出现拉丝状改变。当加入抗病毒药物后,由于药物对病毒的抑制作用,细胞病变减轻,融合区域减小。
在抗病毒生物合成组,当大黄乙醇提取物的浓度≥156μg/ml 时,对MV所致CPE 均有抑制作用(抑制CPE≥50%),其中对MV2抑制作用更为明显, MIC为82μg/ml,TI为61,对MV1和MV3株的MIC则均为156μg/ml, TI为32。随着药物浓度的增加,抗病毒活性增强,当大黄乙醇提取物浓度≥1250μg/ml 时,能完全抑制MV所致CPE。见图1。
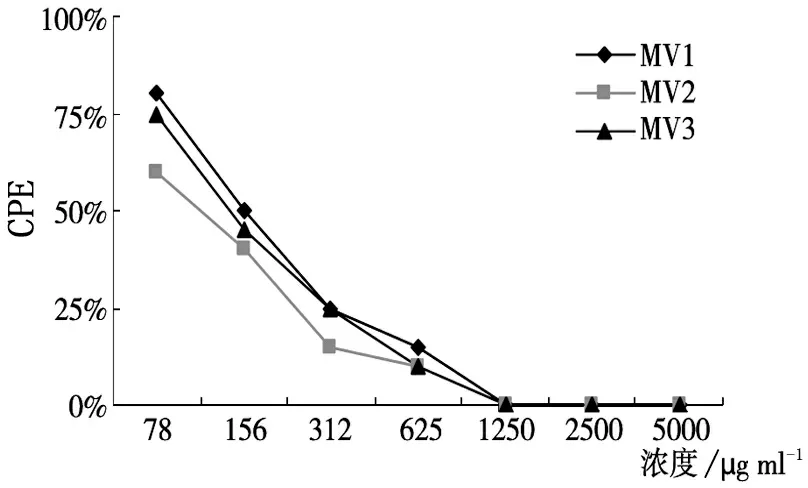
图1 大黄乙醇提取物对不同麻疹病毒株的抗病毒生物合成作用
针对MV1,大黄乙醇提取物抗病毒生物合成作用的MIC为156μg/ml,TI为32,阳性对照药物病毒唑MIC为31.2μg/ml,TI为16,大黄乙醇提取物对MV野毒株的抗病毒生物合成作用优于病毒唑(见图2)。对MV2,大黄乙醇提取物的MIC为156μg/ml,TI为32,病毒唑的MIC为15.6μg/ml,TI为32,大黄乙醇提取物和病毒唑抗病毒生物合成作用相当(见图3)。对MV3,大黄乙醇提取物的MIC为156μg/ml, TI为32,病毒唑的MIC为31.2μg/ml,TI为16,大黄乙醇提取物的效果优于病毒唑。见图4。
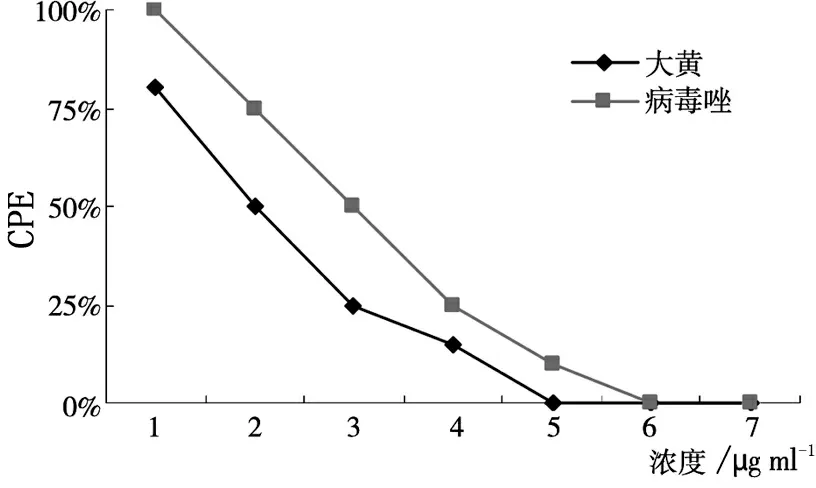
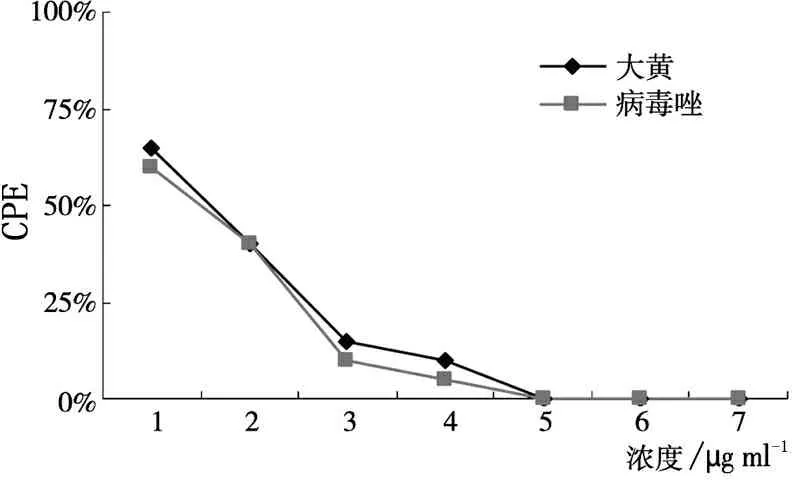
图2 药物对MV野毒株的抗病毒生物合成作用
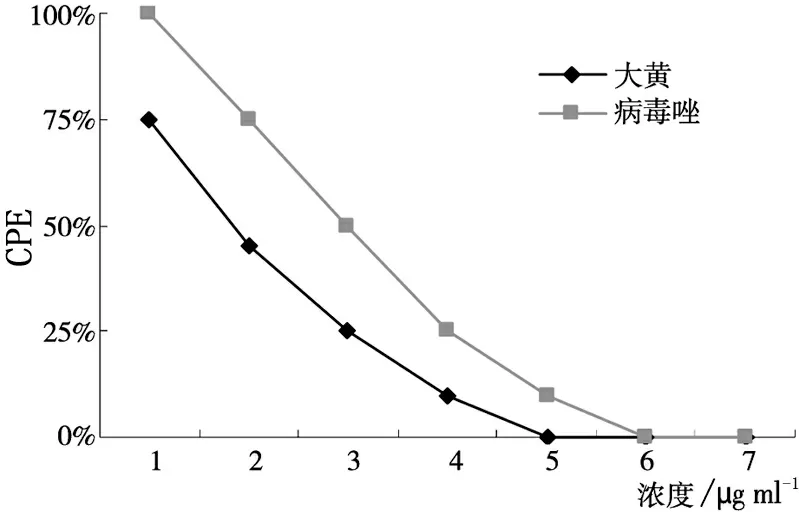
图3 药物对MV标准株的抗病毒生物合成作用
图4 药物对MV疫苗株的抗病毒生物合成作用
在直接杀灭组,当大黄乙醇提取物浓度为156μg/ml时,药物与病毒作用6h,即可抑制50% CPE 产生。随着药物浓度的增加,杀灭病毒的能力也在增强,当大黄乙醇提取物浓度≥625μg/ml 时,能完全抑制MV所致CPE。随着药物与病毒作用时间的延长,杀灭病毒的能力也在增强,当作用时间达到24h时,能完全抑制CPE 的产生。在预防作用组,大黄乙醇提取物对MV感染无明显阻断作用。
3 讨论
麻疹是世界性高传染性的病毒性疾病之一,该病通过呼吸道飞沫小滴或经接触传染,易感人群对麻疹的发病率几乎为100%,而且能够产生严重的并发症,包括巨细胞肺炎、包涵体脑炎和少见的亚急性硬化性全脑炎[10]。尽管已有安全的和具有较高成本效益比的麻疹疫苗,麻疹仍是造成幼儿死亡的主要原因之一。对于麻疹的治疗主要是采取各种对症治疗防止并发症,尚无针对麻疹病毒的特异性治疗药物。由于中药制剂来源广泛,易于提取,且有毒性较低、抗病毒效果显著、无明显耐药等优点,正日益受到国内外学者的重视。
以往的研究证实,大黄对单纯疱疹病毒、新城疫病毒、轮状病毒、流感病毒的增殖具有较强的抑制作用,表明大黄对RNA病毒、DNA病毒均有作用,抗病毒谱较广[5-7]。本研究选用大黄开展抗麻疹病毒的研究,以期寻找有效的麻疹治疗药物。实验结果表明,大黄乙醇提取物在细胞水平上对MV具有明显的抑制病毒生物合成的作用,治疗指数达32,具有较好的安全性,应用前景广泛。由于MV野毒株、标准株和疫苗株在细胞上的增殖特性不同[8],对药物的敏感性可能也存在差异,本研究选择MV野毒株、标准株和疫苗株进行研究,发现大黄对MV野毒株、标准株和疫苗株均有抗病毒作用,尤其是对标准株更为敏感,说明大黄对于不同来源的MV均有效。不同加药方式的结果表明,大黄能够通过多种途径发挥抗病毒作用,不仅具有直接杀灭病毒的作用,对于吸附细胞表面和进入细胞内的病毒也有明显的抑制生物合成作用,而具体的抗病毒作用机理尚不清楚,可能是药物改变了病毒的表面结构从而阻断病毒对受体细胞的吸附,或者是药物对细胞膜结构或功能产生了改变,或者药物进入细胞后对病毒核酸复制过程产生了干扰,也可能是阻断了病毒蛋白的表达。
大黄的生物活性成分包括蒽醌类化合物大黄酚(chrysophano)、大黄酸( rhein)、大黄素甲醚(physcion)、大黄素(emodin)、芦荟大黄素(aloe-emodin) 及其衍生物等[7]。研究显示蒽醌类化合物、大黄素、大黄多糖等均具有抗病毒作用[11-13]。本实验采用乙醇提取大黄的有效成分,经挥发去掉乙醇,溶于水溶剂,提示为结合状态的蒽醌,主要成分有大黄酚甙、大黄酸甙、大黄素甲醚甙等。对于何种成分起作用及其确切含量、作用机制等还有待于进一步研究。我们将在本研究的基础上,对大黄抗病毒作用扩展到药物成分分析和药理机制研究,为中医治疗麻疹提供基础的科学依据。
[1] Griffin D E. Measles virus and the nervous system[J]. Handb Clin Neurol,2014,123:577-590.
[2] 张璟,王文军,张海波.济宁市某地区麻疹流行病学特征分析[J].济宁医学院学报,2010,33(6):419-421.
[3] Fang X,Sun J,Zhang Y,et al.The first measles outbreak caused by imported genotype D9 measles virus in shandong province,China[J]. Jpn Infect Dis,2014,67 (4):300-303.
[4] Plemper R K,Hammond A L.Synergizing vaccinations with therapeutics for measles eradication[J]. Expert Opin Drug Discov,2014,9(2):201-214.
[5] 王志玉,许斌,宋艳艳,等.大黄乙醇提取物体内抗单纯疱疹病毒作用的研究[J].中华实验和临床病毒性杂志,2003,17(2):169-173.
[6] 贺凤兰,刘强,卫飞,等.大黄提取物和大黄素体外抗轮状病毒的实验研究[J].中国病毒病杂志,2013,3(2):112-116.
[7] 杨宏博,冯平,李宝才.大黄抗病毒作用的研究进展[J].华西药学杂志,2009,24(4):428-430.
[8] 刘冷,郑焕英,程雪. Vero/Slam细胞在麻疹病毒分离中的应用[J].中国计划免疫,2006,11(5):353-356.
[9] 李洪源,王志玉.病毒学检验[M].北京:人民卫生出版社,2006:78-80.
[10] Griffin D E.Measles virus and the nervous system[J].Handb Clin Neurol,2014,123:577-590.
[11] 梁荣感,罗伟生,李利亚,等.大黄蒽醌类化合物体外抗流感病毒作用的研究[J].华夏医学,2006,19(3):396-398.
[12] 蒋娜,廖雯婷,匡希斌.大黄素对病毒性心肌炎小鼠IL-23/IL-17炎症轴、Th17细胞及病毒复制的影响[J].南方医科大学学报,2014,34(3):373-378.
[13] 卫飞,刘婧,杨占秋.四种大黄多糖体外抗轮状病毒的实验研究[J].公共卫生与预防医学,2009,20(5):13-16.
