CHO细胞株开发技术策略探讨
2014-09-15陶维红秦民民张哲如
陶维红, 秦民民, 张哲如
上海津曼特生物科技有限公司, 上海 201210
20世纪80年代初,基因重组技术开始应用于动物细胞。1984年,Genentech公司首次实现重组中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞表达组织型纤溶酶原激活剂(tissue type plasminogen activator,t-PA),标志着哺乳动物细胞表达系统的建立[1]。随后,许多外源蛋白基因相继被转染到哺乳动物细胞,一些有价值的蛋白不断实现表达,包括凝血因子、促红细胞生成素(erythropoietin,EPO)、免疫球蛋白、尿激酶(urokinase,UK)、乙肝表面抗原(HBsAg)和单克隆抗体[2]等。近几年,平均每年有15种以上重组蛋白新药通过美国食品和药物管理局(FDA)批准[3],并且几个重磅生物抗体药专利即将到期促使生物仿制药的出现,全球生物抗体药销售额已超过1 200亿美元/年[4],预计到2015年,全球生物抗体药销售额将超过1 500亿美元[5]。最突出的重磅炸弹级药物包括:美罗华利妥昔单抗[Rituximab(Ritaxan),美国Genentech和Biogen Idec公司研制]、赫赛汀曲妥珠单抗[Trastuzumab(Herceptin),美国Genentech公司研制]、阿伐斯汀贝伐单抗[Bevacizumab(Avastin),美国Genentech公司研制]、艾比特思西妥昔单抗[Cetuximab(Erbitux),美国ImClone公司和Bristol-Myers Squibb公司研制]和修美乐阿木达单抗[adalimumab(Humira),美国Cambridge抗体公司和AbboR公司研制],这几种单抗药物在2011年全球销售额分别都在近50亿美元以上[6]。在国内,生产单抗药物的上市公司目前仅仅有上海的中信国建、赛金和北京的百泰,国内市场空间巨大,很多从事小分子药物或者中药的企业已经进军单抗药物领域,包括海正药业、复星医药、荣昌制药、丽珠药业和沃森药业等。最近几年,单抗药物领域中小型企业也应运而生,其中不具备单抗药物研发平台的企业在初始阶段会考虑技术外包,于是药明康德、睿智化学等生物医药研发外包公司(contract research organization,CRO)也进入单抗药物研发、生产等领域。但是我国动物细胞表达水平较低和发酵规模普遍偏小的现状制约了我国抗体药物产业化的发展。因此有必要对国内细胞株开发技术策略进行探讨。
1 宿主细胞
抗体药物生产的宿主细胞主要有NS0、HEK293、Hybridoma、SP2/0和CHO等[7]。其中,CHO细胞是生产抗体药物应用最广的宿主细胞[8],主要有以下原因[3]:①CHO细胞能够较好地适应悬浮培养,在生物反应器中可获得较高的密度,有利于工业上大规模培养;②CHO细胞不易传播人类感染病毒[9];③CHO细胞能够在无血清和化学成分明确的培养基中培养,能够确保不同批次培养的重现性;④CHO细胞能够在翻译后进行修饰[10],尤其是在糖蛋白糖基化方面,其糖型与人类基本一致;⑤dhfr和GS等基因能够在CHO细胞实现共扩增,并最终获得目的蛋白的高表达。此外,CHO细胞类型也比较多,例如:DG44、DXB11、CHO K1和CHO-S等。自20世纪80~90年代开始,工业上较早使用的是DHFR(二氢叶酸还原酶缺陷型)基因扩增筛选系统,宿主细胞株为DG44[11~13]。当细胞培养基内含有甲氨蝶呤(methotrexate,MTX)时,二氢叶酸还原酶被抑制,通过反馈调节,使得该基因进行扩增[14],其上下游100~1 000 kb范围内的基因都会随之扩增,因此将目的基因插入此位点范围即可得到扩增。现在很多单抗生产的体系依然是DG44的DHFR体系。GS(谷氨酰胺合成酶)扩增系统,以CHO-K1为宿主细胞,是近些年发展的一种新型基因扩增筛选系统,较DHFR系统有明显的优越性,目前在国际上得到了广泛的认可[15~17]。其原理是GS在ATP水解提供能量的同时,利用细胞内的氨和谷氨酸合成谷氨酰胺。在缺乏外源谷氨酰胺的培养基中加入GS抑制剂甲硫氨酸亚砜亚铵(L-methioninesulfoximine,MSX),可使GS基因及与之相连的目的基因得到有效扩增,从而达到提高目的基因表达水平的目的。该系统的优点主要在[17]:不需要基因缺陷型的CHO-K1细胞株作为宿主细胞;CHO-K1细胞易于培养,更强壮;在培养基中无需加谷氨酰胺,能够避免谷氨酰胺分解造成培养体系中氨水平高的问题,降低了工艺控制的难度,并且可有效提高细胞发酵密度和延长细胞生存时间。
2 表达载体的构建与转染策略
适合于CHO细胞表达的载体(Vector)的基本元素包括:启动子(promoter)、poly A 加尾信号(poly A signal)、筛选标记(selectable marker)、克隆位点(cloning site)和复制起始位点(origin of replication),有些还有报告基因(reporter gene)。启动子一般较多采用SV40和CMV两种,CMV启动子通常位于目的基因(轻链和重链可变区基因)之前,而SV40则位于筛选标记之前。筛选标记一般有两种:代谢型和抗生素型,或者也可称为扩增型基因筛选标记和非扩增型基因筛选标记。常见的筛选标记见表1,当前工业界较多采用的筛选标记为DHFR、GS、G418和puromycin等。
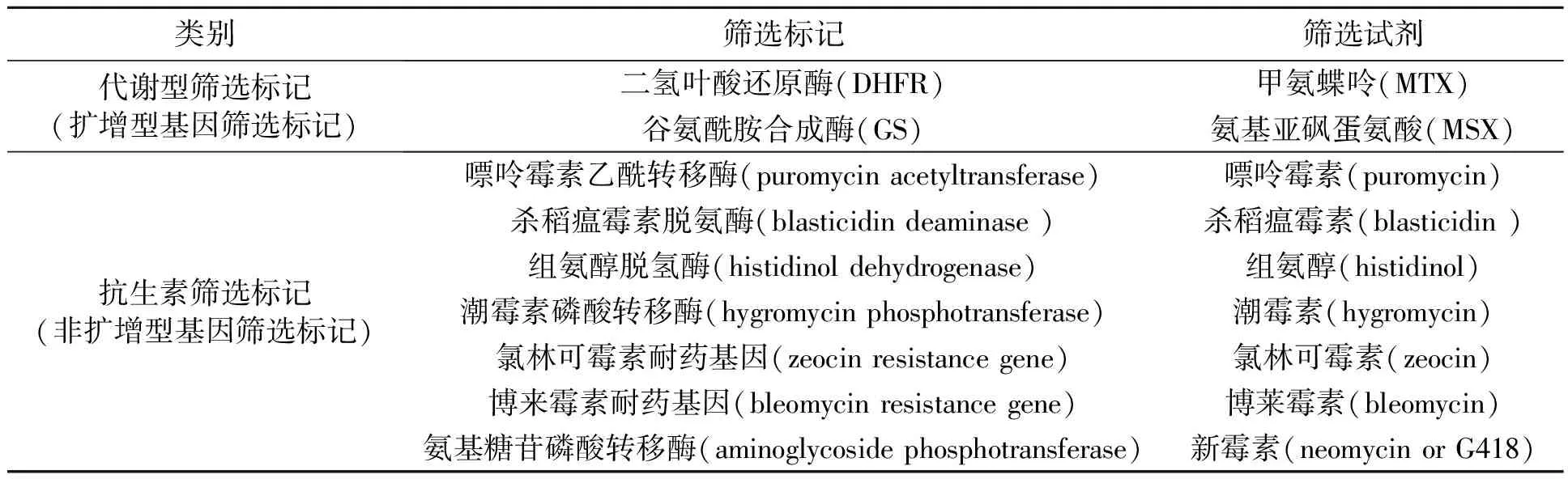
表1 哺乳动物细胞表达载体中常用的筛选标记
Li等[18]研究显示,在载体设计中插入筛选标记的不同策略,会影响最终的筛选结果。为比较不同质粒构建和筛选策略,分别设计了两种质粒,一种带有DHFR单个筛选标记, 另一种带有GS单个筛选标记,两种质粒都同时具有轻链和重链基因。共进行五组实验:Ⅰ转染质粒一,加入25 nmol/L MTX进行筛选;Ⅱ转染质粒二,加入25 μmol/L MSX进行筛选;Ⅲ转染质粒二,加入50 μmol/L MSX进行筛选;Ⅳ混合转染两种质粒,加入25 nmol/L MTX和25 μmol/L MSX进行筛选;Ⅴ混合转染两种质粒,加入25 nmol/L MTX和50 μmol/L MSX进行筛选。比较上述转染后的筛选结果显示,Ⅳ和Ⅴ条件筛选的高表达的克隆数量明显较高。因此,这种采用两种筛选标记的质粒构建与筛选方法又称双重筛选(double selection),比单筛选标记的质粒转染后筛选效率高很多。
目前,商业中所选择的载体供应商主要是Life technologies公司,从pcDNA3系列到Freedom pCHO1.0,其大小由原来的4 000~5 000 bp到现在的近13 000 bp不等。图1~图3分别显示了三种典型的载体图谱(均来自www.lifetechnologies.com)。pcDNA3.1是Life technologies公司早期开发的载体,其构造相对较简单。pOptiVEC-TOPO载体的最大特点在于具有TOPO酶和IRES(internal ribosome entry site)组件。TOPO酶具有无缝克隆的特点,与多克隆位点相比,优势在于插入目的基因时不会带有酶切位点;而IRES组件的功能主要是能够将它所连接的两个基因共用同一个启动子进行表达[3],即pOptiVEC-TOPO(4 420 bp)上的CMV启动子同时作用于目的基因和DHFR筛选标记基因。Freedom pCHO1.0是Life technologies最新开发的一个载体,大小为12 988 bp,具有以下特点:①目的基因的轻链和重链可以同时插入一个载体上,以前的载体设计多数是插入一个轻链或者重链;②外源基因插入位点之前设计的启动子在CMV基础上进行了较大的改善;③具有两个筛选标记。在启动子的设计上面,尤其是对于使用DHFR或GS这类扩增型基因筛选标记的表达体系,目的基因前面的启动子一般比筛选标记的启动子转录活性要强[19]。
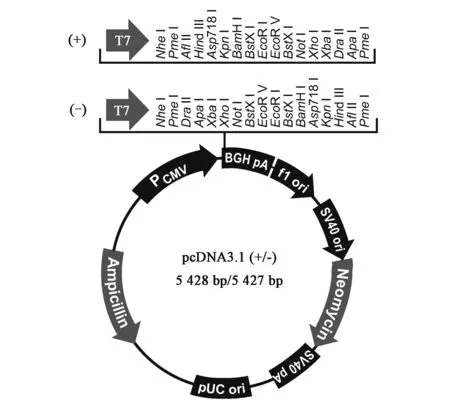
图1 pcDNA3.1图谱
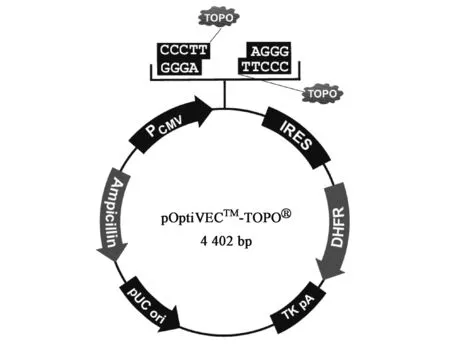
图2 pOptiVEC-TOPO图谱
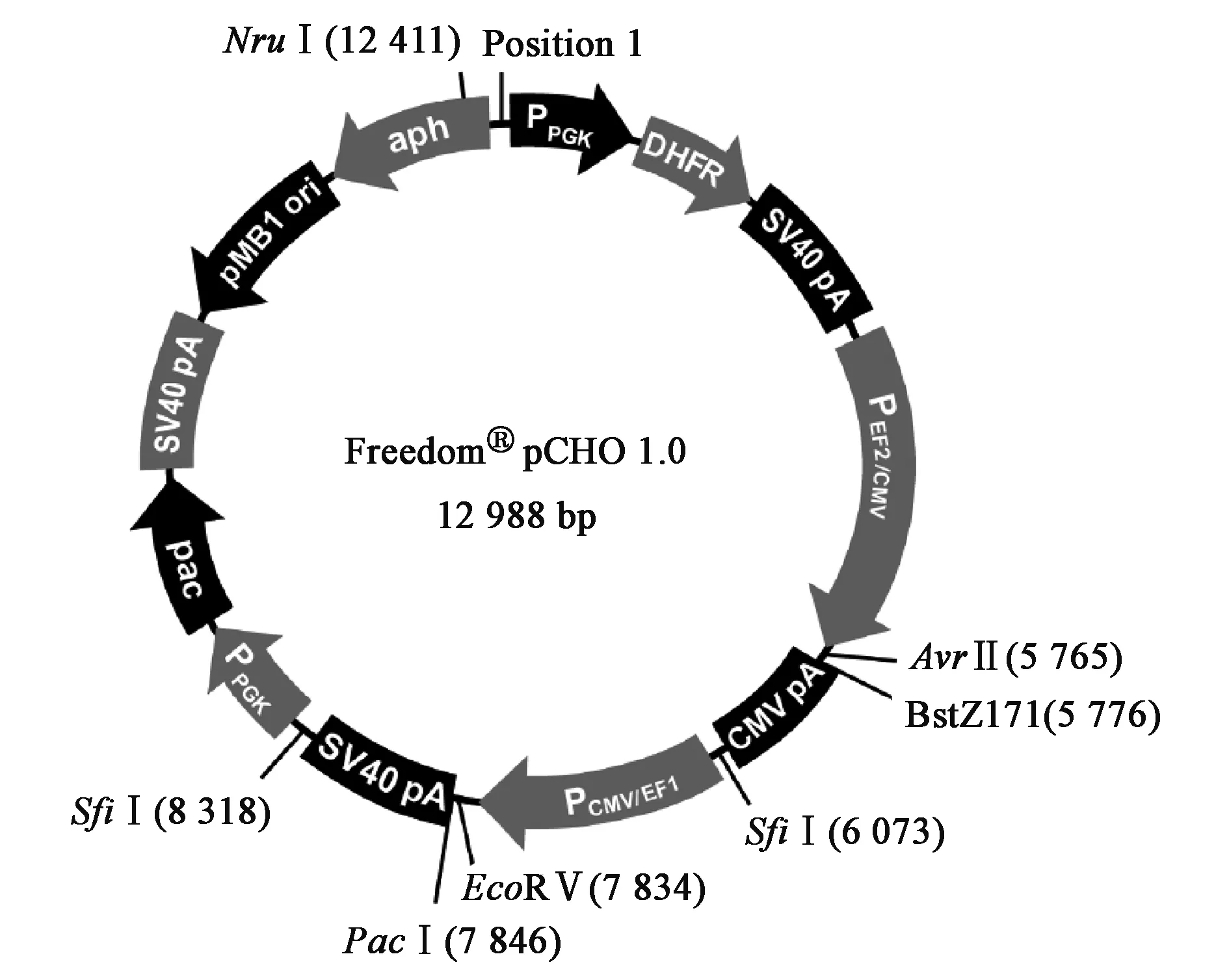
图3 Freedom pCHO1.0图谱
3 转染方法
转染类型一般有稳定转染和瞬时转染两种。在单抗细胞株筛选稳定转染前通常通过瞬时转染得到一些抗体,进行质量分析,以初步判断抗体是否满足需要;或者进行一些前期的启动子、密码子等组件的优化。稳定转染中外源DNA既可以整合到宿主染色体中,也可能作为一种游离体存在。在CHO细胞中进行稳定转染时,外源DNA整合到CHO染色体上,未整合的游离态的DNA会随传代而丢失。
常用于哺乳动物细胞转染的方法有磷酸钙法、阳离子脂质体法、阳离子聚合物法和电穿孔法,在工业界使用最多的是阳离子脂质体法和电穿孔法[18]。
4 筛选技术
CHO细胞转染之后,通常会做一个克隆池(pool),然后进行筛选。筛选策略主要涉及抗生素或药物的代谢途径,常见的筛选试剂包括puromycin、G418、MTX和MSX等。Puromycin为氨基糖甙类抗生素,通过干扰核糖体功能阻断哺乳动物细胞的蛋白质合成,来自链霉菌的pac基因具有解除嘌呤霉素(puromycin)毒性的作用。在筛选的时候,puromycin浓度一般在10 ~50 μg/mL。G418也是一种氨基糖苷类抗生素,是稳定转染最常用的抗性筛选试剂之一。G418在筛选的时候一般浓度范围为200~1 000 μg/mL。MTX为叶酸拮抗剂,在细胞内经过转换后可抑制DHFR的活性,抑制核酸合成,引起细胞毒性。Schimke等[14]的研究显示,随着MTX浓度的增加,绝大多数细胞死亡,但在极少数幸存下来的抗性细胞中,DHFR基因得以扩增,目的基因拷贝数随之增加,提高了表达量。MTX筛选时,一般浓度范围为25~1 000 nmol/L。MSX筛选采用的是谷氨酰胺合成酶基因GS系统压力。谷氨酰胺合成酶(GS)扩增系统是新近发展的更有效的系统,具有更高的扩增效应。MSX筛选时,一般浓度范围:25~500 μmol/L。
4.1筛选方法
哺乳动物细胞筛选稳定的细胞株常用的方法主要有三种:96孔单克隆有限稀释法[20]、流式细胞仪法[21]和Clone Pix System筛选法[22]。
96孔单克隆有限稀释法是早期最广泛应用的单克隆细胞株筛选法,理论上可以得到非常均一的单克隆,同时可以筛选悬浮细胞稳定株。其缺点是工作量比较大,效率较低。流式细胞仪法主要针对膜蛋白或者内分泌抗体,具有一定的局限性[3]。流式细胞仪可同时进行多参数测量,信息主要来自特异性荧光信号及非荧光散射信号。在应用中,通常细胞目的基因带有荧光报告蛋白基因或者加入带有荧光标记的抗抗体。
Clone Pix System筛选法是目前工业上较为流行的筛选法[3],是由Molecular Devices公司开发的自动挑选克隆的设备,较有限稀释法具有更高筛选效率(表2)。该方法使用半固体培养基,将细胞固定在半固体培养基中进行生长,并在半固体培养基中加入带有荧光标记的二抗,通过与细胞表达的抗体进行结合,形成荧光光圈,在荧光显微镜下可以看出所谓的“光晕”。如果光晕越大、荧光强度越强,理论上说明克隆表达量越高,也即筛选所得的克隆。Clone Pix System仪器主要结合这一原理,能够快速挑选高表达的单一克隆。与其配套的Clone Select Imager仪器可以客观定量评估孔板中的细胞生长,判断是否是单个克隆。最近出现了与Clone Pix System类似的筛选仪器,是德国ALS(Automated Lab Solutions)公司开发的Cell Celector[23],应用范围更广。
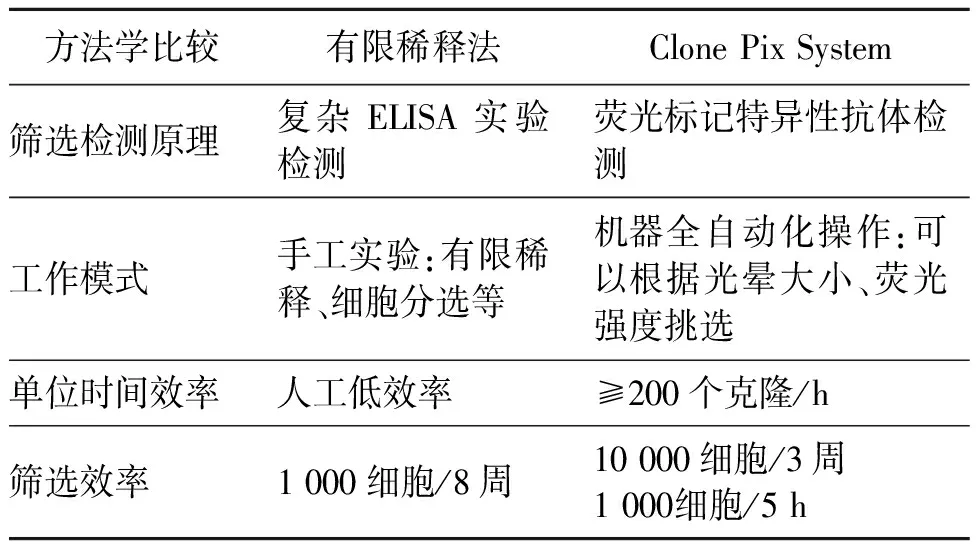
表2 有限稀释法和Clone Pix System方法比较
在工业上,单克隆细胞大部分是悬浮培养,所以在筛选细胞株的时候,应该尽量接近工业生产条件。结合实践经验来看,在筛选细胞株早期,应该考虑将细胞静止培养转向摇床或者动态培养,以便筛选出更为稳定的、接近生产型的细胞株。筛选稳定、高表达的细胞株,一般周期需要6~12个月。
4.2筛选准则以及检测方法
克隆的筛选通常关注滴度水平及单位时间单个细胞所表达的抗体量(cell specific productivity,Qp)选择克隆的Qp在所有克隆中至少要排在中等。工业上所用的克隆Qp一般在20~100 pg/cell·d。同时还要关注克隆生长状态,工业上CHO细胞的翻倍时间一般为15~24 h,在批次培养或者流加培养的时候,平台期能够尽量长些。
在孔板期间滴度的检测一般通过ELISA方法或者均相时间分辨荧光技术(homogeneous time resolved fluorescence,HTRF)[24],后者是目前高通量筛选克隆常用的检测方法。HTRF技术是对时间分辨荧光共振能量转移的检测技术(time-resolved fluoresence resonance energy transfer assay,TR-FRET assay)平台的进一步改良,可提供更高的灵敏度和稳定性。该技术是法国Cisbio Bioassays公司的专利技术。最近又有一种新的微量检测方法出现,该方法称为ForteBio Octet分析法[25],采用生物膜干涉技术,与ELISA法相比,Octet平台自动化程度高,测定的速度快,更贴近摇瓶和反应器中细胞表达量测定的试验需要,但其费用可能偏高,暂时没有在测定孔板滴度中得到广泛的应用。
筛选的克隆到达摇瓶之后,应尽快建立研究型细胞库(research cell banking,RCB),做稳定性试验。考察克隆的稳定性一般会传代至60代,并观察克隆生长的稳定性,即翻倍时间的稳定性;克隆表达的稳定性,即滴度或者Qp的稳定性;克隆遗传的稳定性;以及克隆质量的稳定性,即克隆前后表达抗体的质量是否有较大差别。克隆进入摇瓶的同时,还会进行cDNA序列的鉴定、肽图分析、CE-SDS和SDS-PAGE单抗纯度分析等,主要为避免抗体氨基酸序列突变或克隆的丢失;进行HPLC-SEC分析,以剔除容易形成多聚体的克隆;进行糖型分析,尽量避免一些糖型较差的克隆;进行等电聚焦电泳(isoelectric focusing electrophore-sis,IEF)或者成像毛细管等电聚焦电泳(imaged capillary isoelectric focusing,iCIEF),以及离子交换色谱HPLC分析,避免一些产生高酸或高碱变体的克隆等。
克隆在摇瓶考察后,需要选定一定数量的克隆进入反应器进行评价,主要考察细胞生长、单抗表达和单抗质量等。一般筛选克隆会做1~2次亚克隆,以确保是单克隆。当然如果在初期母克隆筛选的时候能够确保是单克隆,可以不做亚克隆。
5 培养工艺
细胞株开发的过程中,一般需要在一定的培养工艺平台基础上进行克隆筛选。中试生产申报药品临床试验(investigational new drug,IND)时,一般会选定2~3个来自不同系列的克隆,其中1~2个克隆作为备选。
培养工艺对最终生物制品的产量、质量和安全有巨大影响,其中以细胞培养基的选择最为重要[7]。在筛选培养基和补料培养基时,初期流加培养时候基础培养基和同品牌的补料培养基应该配对进行筛选。初步筛选之后,将基础培养基和补料培养基进行分类,如促进生长类型、维持活率类型、促进表达类型等。将培养基进行混合优化时,尽量将不同类型的培养进行组合,并且应用实验设计(design of experiment,DOE)优化。
在补料策略方面,普遍将基础培养进行浓缩后添加到补料培养基中,因为基础培养基一般营养比较全面,但也有可能导致渗透压偏高。一般来讲,补料体积应该在终体积的40%以内。有的策略会按照天数和一定的补料体积来补加,有的会按照细胞密度来补加,也有按照葡萄糖浓度来补加,或者按照一定代谢状态补加等。

6 展望
目前中国抗体药物产业正进入关键的发展时期,在细胞株开发方面需要不断坚持自主创新,吸取国外先进的技术,结合自身发展需要,选择CHO K1或者CHO-S为宿主细胞、谷氨酰胺合成酶表达体系,结合Clone Pix System半固体培养基方式挑选克隆,利用商业培养基快速推进IND申报,同时开发自己的培养基和细胞培养工艺平台模式,选择合适的产业化方式,促使整个抗体药物产业健康发展。
[1]Deschênes I,Finkle C D,Winocour P D.Effective use of BCH-2763, a new potent injectable direct thrombin inhibitor, in combination with tissue plasminogen activator (tPA) in a rat arterial thrombolysis model[J]. Thromb. Haemost.,1998,80(1):186-191.
[2]Biot J,Fasano C,Dos Santos C. From orthoclone to denosumab,the fast growing market of monoclonal antibodies[J].Med. Sci. (Paris),2009,25(12):1177-1182.
[3]Lai T,Yang Y,Ng S K. Advances in mammalian cell line development technologies for recombinant protein production[J].Pharmaceuticals (Basel),2013,6(5):579-603.
[4]Bandaranayake A D,Almo S C. Recent advances in mammalian protein production[J].FEBS Lett.,2014, 588(2):253-260.
[5]Butler M,Meneses-Acosta A. Recent advances in technology supporting biopharmaceutical production from mammalian cells[J]. Appl. Microbiol. Biotechnol.,2012,96(4):885-894.
[6]李浩强,蔡洁行,张玉彬.治疗性抗体高表达CHO细胞株构建策略[J]. 中国医药生物技术,2013,8(3):66-70.
[7]陈 飞.DHFR-CHO细胞无血清培养基及其关键组分的研究和应用[D].上海:华东理工大学,博士学位论文,2012.
[8]Jayapal K R,Wlaschin K F,Hu W S,etal.. Recombinant protein therapeutics from CHO cells—20 years and counting[J]. Chem. Eng. Prog.,2007,103(10):40-47.
[9]Boeger H,Bushnell D A,Davis R,etal.. Structural basis of eukaryotic gene transcription[J]. FEBS Lett., 2005,579(4):899-903.
[10]Kim J Y,Kim Y G,Lee G M. CHO cells in biotechnology for production of recombinant proteins: Current state and further potential[J]. Appl. Microbiol. Biotechnol.,2012,93(3):917-930.
[11]Kaufman R J,Sharp P A. Amplification and expression of sequences cotransfected with a modular dihydrofolate reductase complementary dna gene[J]. J. Mol. Biol.,1982,159(4):601-621.
[12]Wigler M,Perucho M,Kurtz D,etal.. Transformation of mammalian cells with an amplifiable dominant-acting gene[J]. Proc. Natl. Acad. Sci. USA,1980,77(6):3567-3570.
[13]Urlaub G,Chasin L A. Isolation of Chinese hamster cell mutants deficient in dihydrofolate reductase activity[J]. Proc. Natl. Acad. Sci. USA,1980,77(7):4216-4220.
[14]Schimke R T .Gene amplification in cultured animal cells[J]. Cell,1984,37(3):705-713.
[15]Liu P Q,Chan E M,Cost G J,etal.. Generation of a triple-gene knockout mammalian cell line using engineered zinc-finger nucleases[J]. Biotechnol. Bioeng.,2010,106(1):97-105.
[16]Lonza Group Ltd. Lonza launches next generation GS gene expression systemTM[EB/OL]. http://www.lonza.com/about-lonza/media-center/news/2012/120710-GS-System-e.aspx,2013-02-15.
[17]刘彦君,赵 阳,王 征.我国抗体药物产业化发展的策略探讨[J].中国生物工程杂志,2006,(10):93-97.
[18]Li F,Vijayasankaran N,Shen A Y,etal.. Cell culture processes for monoclonal antibody production[J].Mabs,2010,2(5):466-479.
[19]Ng S K,Wang D I,Yap M G. Application of destabilizing sequences on selection marker for improved recombinant protein productivity in CHO-DG44[J]. Metab. Eng.,2007,9(3):304-316.
[20]Lietzke R,Unsicker K. A statistical approach to determine monoclonality after limiting cell plating of a hybridoma clone[J]. J. Immunol. Methods.,1985,76(2):223-228.
[21]DeMaria C T,Cairns V,Schwarz C,etal.. Accelerated clone selection for recombinant CHO cells using a FACS-based high-throughput screen[J]. Biotechnol. Prog.,2007,23(2):465-472.
[22]Dharshanan S,Chong H,Hung C S,etal.. Rapid automated selection of mammalian cell line secreting high level of humanized monoclonal antibody using Clone Pix FL system and the correlation between exterior median intensity and antibody productivity[J]. Electron. J. Biotechnol.,2011,14(2):1-9.
[23]Haupt S,Grützner J,Rath B H,etal.. Automated selection and collection of pluripotent stem cell colonies using the Cell CelectorTM[J].Nat. Methods,2009,(6):Ⅲ-Ⅳ.
[24]Degorce F,Card A,Soh S,etal.. HTRF: A technology tailored for drug discovery-a review of theoretical aspects and recent applications[J].Curr. Chem. Genomics,2009,(3):22-32.
[25]Li J,Schantz A,Schwegler M,etal.. Detection of low-affinity anti-drug antibodies and improved drug tolerance in immunogenicity testing by Octet(®) biolayer interferometry[J].J. Pharm. Biomed. Anal.,2011,54(2):286-294.
