水淹胁迫下三峡库区野生狗牙根根系酶活性变化
2014-09-14李彦杰刘仁华杨俊年周大祥秦洪文
李彦杰,刘仁华,杨俊年,周大祥,秦洪文
(1.重庆三峡学院 生命科学与工程学院,重庆404000;2.三峡库区可持续发展研究中心,重庆404000)
三峡水库完成175 m蓄水后,自宜昌三峡大坝到其上游的重庆江津形成长度超过660 k m,最宽2 k m,面积约1万k m2的峡谷型人工水库[1]。在三峡水库的反季节周期性蓄水过程中,可在水库沿岸形成最高水位达175 m,最低水位为145 m,落差达30 m的消落带,使得库区沿岸生态结构由陆生生态系统演变为周期性的冬水夏陆消落带湿地系统[2]。消落带环境的剧烈改变,打破了原有生态平衡,使得大部分植物因不适应而死亡。消落带植被消亡加剧引发了众多环境问题,如污染、水土流失等[3]。消落带治理目前一致的看法是恢复或者重建消落带的植被,其中筛选消落带适生植物是一个重要的方向。目前国内学者在三峡库区消落带的适生植物筛选方面做了大量研究,如利用模拟水淹和实际水淹筛选到了数种适生植物[4-6],其中刘云峰等[7]通过在三峡库区万州段的自然消落带通过实际水淹实验,提出了消落带乡土植物狗牙根可作为三峡库区消落带治理适生植物。后续的研究表明[8],在长时间(大于180 d)不同深度水淹生境下,狗牙根具有接近100%的高存活率,故被认为是三峡库区消落带治理的适生植物之一。
水淹胁迫生境下,因光和氧的强度下降会影响植物的物质代谢及诱发缺氧胁迫等。狗牙根作为耐水淹植物之一,有较强的水淹抗性和水淹结束后能适应复氧胁迫并尽快的恢复至未胁迫状态。到目前为止,适生狗牙根的长期深度水淹胁迫的生理机制研究国内外尚未见报道。本研究以三峡库区自然消落带狗牙根(XC)和非消落带狗牙根(FC)为研究材料,通过实际水淹,对XC组狗牙根在不同水淹深度下的抗氧化酶活性和碳水化合物含量等变化趋势与FC组作对比,以期从生理角度为狗牙根作为三峡库区消落带治理的适生植物作一解释。
1 材料与方法
1.1 试验材料与地点
狗牙根(Cynodon dactylon L.Pers)属禾本科多年生草本植物,根系发达,具根状茎及匍匐枝,可做牧草、园艺植物及水土保持植物等;主要分布于黄河流域以南地区和新疆等地,其中在长江流域广泛存在。
实验用野生狗牙根分为非消落带野生狗牙根(FC)和自然消落带野生狗牙根(XC),非消落带野生狗牙根(FC)选自实验基地附近非消落带野生狗牙根,并集中栽培;自然消落带野生狗牙根(XC)由重庆三峡学院三峡库区消落带适生植物筛选示范基地提供,该基地位于重庆市万州区新田镇谭绍村,属于蓄水水位在145~175 m间的三峡库区自然消落带区域。
实验地点位于重庆市万州区新田镇谭绍村的三峡库区自然消落带(107°87′E,30°35′N),属亚热带暖湿东南季风气候,冬暖夏热,雨量充足、日照时间长、四季分明;多年年平均气温17.7℃、降雨量1 293 mm、日照1 205 h、无霜期302 d。
1.2 试验设计
2011年9月16—18日,选取生长一致的三峡库区自然消落带野生狗牙根(XC)(重庆三峡学院三峡库区消落带适生植物筛选示范基地)和非消落带野生狗牙根(FC)(175 m以上的实验基地)当年生分蘖苗分别移入塑料桶中;桶内径42 c m、高18 c m,桶底打孔,并垫上窗纱后填谭绍村自然消落带湿润沙土,桶内土层厚度为14 c m。
2011年10月30日三峡水库完成蓄水,于次日开始水淹实验;具体为:XC组随机分为0,4,8,12,16,20 m水淹组,每组含6个平行样做不同水淹下沉处理;FC组在175 m之上做对照。取样时间为2012年4月28日,水淹时间181 d。
1.3 取样及指标测定
2012年4月28日开始取样。取样时,小心掰开桶中的土,取出完整的植株,冲洗干净根部泥土,剪下根系,用蒸馏水冲洗三遍后用吸水纸吸干,称取约1.0 g放入冰盒立即带回实验室,液氮速冻后放入-70℃备用;取洗净后剩余的根系带回实验室烘至恒重。
丙二醛(MDA)含量测定采用硫代巴比妥酸法[9],含量单位为 mg/(g·min)F W;乙醇脱氢酶(ADH)测定试剂盒购自南京建成生物工程研究所,酶活性单位为U/g F W;过氧化物酶(POD)酶活性测定采用愈创木酚法[9],酶活性单位为 ΔOD470/(g F W·min);谷光甘肽还原酶(GR)酶活性测定试剂盒购自南京建成生物工程研究所,含量单位为单位为n mol/g F W。超氧化物歧化酶(SOD)酶活性测定采用氮蓝四唑比色法[9],酶活性单位为 U/g F W;游离的脯氨酸测定采用茚三酮法[9],含量单位为 μg/g FW;可溶性糖和淀粉参照张志良[9]等测定方法并略作修改,含量单位为mg/g。
1.4 分析方法及作图
SPSS 19.0(IBM,USA)作不同对照组t检验;Origin 8.5(Origin Lab,USA)作图。
2 结果与分析
2.1 不同水淹深度对MDA含量的影响
不同水淹深度对MDA含量影响(图1)结果显示:随着水淹深度的增加,XC组狗牙根根系的MDA含量呈递增趋势;从水淹4 m处起XC组根系MDA含量显著高于未淹没的FC组(P<0.05);未淹没FC组狗牙根根系MDA含量基本处于同一水平。
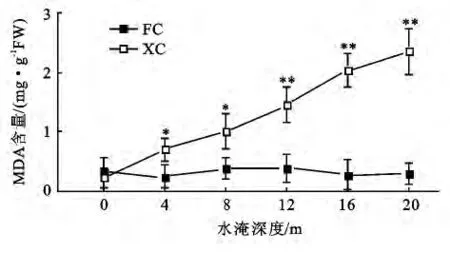
图1 水淹深度对MDA含量的影响
2.2 不同水淹深度对ADH酶与抗氧化酶酶活性及游离脯氨酸含量的影响
不同水淹深度对酶活性的影响(图2)结果显示:随着水淹深度的增加,XC组狗牙根根系ADH、GR、POD、SOD酶活性均呈现先增加后降低的趋势;在不同水淹深度生境下,XC组狗牙根根系ADH、POD、SOD酶活性均高于未淹没FC对照组水平,而GR酶活性在水淹深度为20 m时降至FC对照组水平。
在水淹深度为8 m时,XC组狗牙根根系ADH、POD和SOD酶活性出现最高值且显著高于FC组对照水平(P<0.01),此时分别约为FC对照组水平的2.1,2.4,5.2倍;而 GR酶活性的最高值出现在水淹深度为4 m时且显著高于FC对照组水平,约为FC对照组水平的3.6倍。此外,在整个水淹期间,XC组狗牙根根系POD和SOD酶活性均显著高于FC对照组水平(P<0.05)。

图2 水淹深度对酶活性影响
随着水淹深度的增加,XC组狗牙根根系游离脯氨酸的含量呈递增趋势(图3),且从4 m水淹深度起,均显著高于FC对照组水平(P<0.01)。

图3 水淹深度对游离脯氨酸含量的影响
2.3 不同水淹深度对碳水化合物含量的影响
不同水淹深度下,XC组狗牙根根系可溶性糖含量呈先递减后上升的趋势,其中在水淹深度为8 m时,可溶性糖含量降至最低,约为FC对照组水平的40%(图4);在整个水淹期间,XC组狗牙根根系可溶性糖含量均显著低于FC对照组水平(P<0.01)。XC组狗牙根根系淀粉含量在水淹深度为4 m时出现最低值,且约为FC对照组水平的60%(图4);在8 m深度处恢复至对照水平,且此后基本和FC对照组处于同一水平。
3 结论与讨论
水淹胁迫对植物细胞生理的影响主要表现为缺氧和光合作用下降。尤其在长期水淹生境下,长期性的缺氧使得植物细胞呼吸链的电子不能传递给其受体氧(O2),这会使得三磷腺苷(ATP)的合成受阻;此外,植物根系组织在水淹生境下,也会诱发膜脂发生过氧化作用,生成氧化应激的标志物MDA,MDA含量高低反映了植物细胞膜过氧化作用的强弱与质膜的破坏程度,且其可影响线粒体呼吸链复合物及线粒体内关键酶的活性[10];作为植物抗逆性的一项生化指标,游离脯氨酸随水淹胁迫增加而呈增加趋势,且其含量与植物耐涝性之间存在相关性[11]。本实验中,随着水淹深度的增加,XC组狗牙根根系MDA的含量呈递增趋势,反映了胁迫程度的加重,与文献[12]报道一致;XC组狗牙根根系游离脯氨酸随着水淹深度增加也呈现增加趋势,这与已有的相关报道[11]一致。
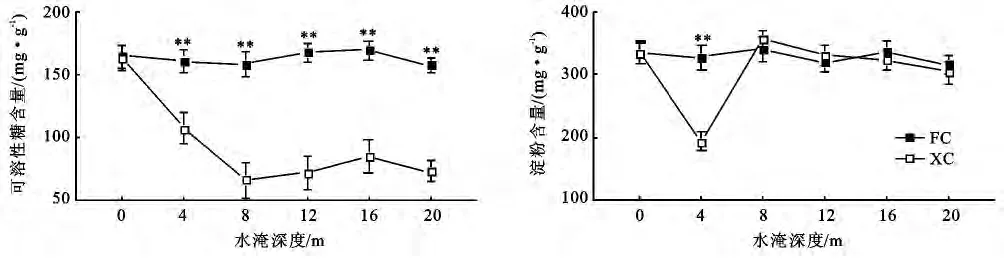
图4 水淹深度对碳水化合物含量的影响
长期水淹生境下,因为缺氧使得狗牙根体内活性氧产生和清除的平衡受到破坏,导致根系内活性氧自由基大量累积,进而对根系细胞产生毒害作用。植物体内的抗氧化防御系统,如酶类抗氧化剂(POD、SOD、GR等)和非酶抗氧化剂(抗坏血酸、还原型谷胱甘肽、维生素E、还原性酚类和酮类等)等,通过还原累积的氧自由基从而有效降低水淹胁迫对植物的伤害。GR可维持植物体内的还原型谷胱甘肽与氧化型谷胱甘肽比例处于较高水平,这不仅与直接抗氧化有关(清除H2O2等),而且能促进抗坏血酸的再生;POD是以过氧化氢为电子受体,催化过氧化氢氧化某些酚类和胺类化合物。SOD可将植物体内的超氧阴离子自由基(O-.2)转化成H2O2和O2,H2O2可进一步被过氧化氢酶(CAT)催化产生水及分子氧。研究发现,大麦[13]、小麦[14]、玉米[15]等植物体内 GR、POD和SOD酶活性会在水淹胁迫下增高,以移除或降低水淹胁迫的伤害,从而保护植物能在水淹下存活。本实验中XC组狗牙根根系GR、POD和SOD酶活性在水淹条件下均高于FC对照组(除GR在20 m水淹处),显示GR、POD和SOD酶活性与抗水淹胁迫有关;随着水淹深度增加,植物缺氧和光合作用下降加剧,植物的代谢水平降低以利于存活,表现为合成和代谢均处于较低水平,故GR、POD和SOD酶活性出现下降,其中GR酶活性在20 m水淹深处降至FC对照组水平;不同抗氧化酶对不同水淹深度的响应基本相同,但XC组狗牙根根系POD和SOD酶活性在水淹深度为8 m时处于最高水平,而GR酶活性的最高水平出现在水淹深度为4 m时。
长期水淹生境下,因供氧不足或缺氧也会诱发植株体内酒精发酵产生乙醇,过量乙醇的累积会对植物细胞和组织产生毒害作用,进而引发酸毒症[16]。ADH是无氧呼吸的关键酶,它能有效地降低植物体乙醇的大量累积从而降低对植物细胞的伤害[17-18]。本实验中,XC组狗牙根根系ADH酶活性均高于FC对照组水平,并随着水淹深度的增加而升高,与大豆根系[17]和春油菜[19]等在水淹条件下 ADH 酶活性升高一致。ADH酶活性最高水平出现在水淹8 m处,此后出现下降趋势,这可能与水淹深度增加胁迫进一步加大,而此时细胞合成代谢又处于较低水平有关。
植物碳水化合物包括可溶性糖和淀粉,其中可溶性糖通常是植物体内碳水化合物运输和利用的主要形式,淀粉是植物的主要储存物质。有文献[20]显示植物碳水化合物含量与植物的水淹抗性呈正相关。本实验中,XC组狗牙根根系可溶性糖含量随着水淹深度的增加而降低,其含量较低可能与狗牙根代谢处于较低水平以对抗逆境有关;淀粉含量在4 m水淹深度出现最低值而此后与对照同水平,可能与加大储能有关;可溶性糖含量和淀粉含量的变化趋势显示狗牙根能在长期深度水淹生境下,在减低代谢水平的同时能增加储能,说明狗牙根具有较强的耐淹能力。
水淹协迫下,植物的生理生化代谢会发生改变,一方面是适应所处的生境,另一方面是降低因为生境改变可能对植物造成的伤害。通过分析在不同水淹深度下狗牙根根系的酶活力变化和碳水化合物含量等变化,从生理角度解释了狗牙根在长期水淹生境下的存活机制。有关狗牙根在不同水淹深度下的酶活力动态响应信号途径,仍有待进一步研究。
[1] 杨乐,张烨,侯培强,等.三峡水库中下游水体氮磷时空变化与机制分析[J].长江流域资源与环境,2012,21(6):732-738.
[2] 苏维词,赵纯勇,杨华.三峡库区消落区自然条件及其开发利用评价[J].地理科学,2009,29(2):268-272.
[3] 钟冰,唐治诚.三峡库区水土流失及其防治[J].水土保持研究,2001,8(2):147-149.
[4] 王海锋,曾波,李娅,等.长期完全水淹对4种三峡库区岸生植物存活及恢复生长的影响[J].植物生态学报,2008,32(5):977-984.
[5] 王海锋,曾波,乔普,等.长期水淹条件下香根草(Vetiveria zizanioides),菖蒲(Acorus calamus)和空心莲子草(Alter nanther a philoxeroides)的存活及生长响应[J].生态学报,2008,28(6):2571-2580.
[6] 谭淑端,张守君,张克荣,等.长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响[J].植物科学学报,2009,27(4):391-396.
[7] 刘云峰,刘正学.三峡水库消落区极限条件下狗牙根适生性试验[J].西南农业大学学报,2005,27(5):661-663.
[8] 马利民,唐燕萍,张明,等.三峡库区消落区几种两栖植物的适生性评价[J].生态学报,2009,29(4):1885-1892.
[9] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003.
[10] Cardoso S M,Pereira C,Oliveira C R.Mitochondrial f unction is differentially affected upon oxidative stress[J].Free Radical Biology and Medicine,1999,26(1):3-13.
[11] 罗祺,张纪林,郝日明,等.水淹胁迫下10个树种某些生理指标的变化及其耐水淹能力的比较[J].植物资源与环境学报,2007,16(1):69-73.
[12] 谭淑端,朱明勇,党海山,等.三峡库区狗牙根对深淹胁迫的生理响应[J].生态学报,2009,29(7):3685-3691.
[13] Zhang G,Tanakamar u K,Abe J,et al.Influence of waterlogging on so me anti-oxidative enzy matic activities of t wo barley genotypes differing in anoxia tolerance[J].Acta Physiologiae Plantar u m,2007,29(2):171-176.
[14] Biemelt S,Keet man U,Albrecht G.Re-aeration f ollowing hypoxia or anoxia leads to activation of the antioxidative defense system in roots of wheat seedlings[J].Plant Physiology,1998,116(2):651-658.
[15] Yan B,Dai Q,Liu X,et al.Flooding-induced membrane damage,lipid oxidation and activated oxygen generation in corn leaves[J].Plant and Soil,1996,179(2):261-268.
[16] Crawford R,Braendle R.Oxygen deprivation stress in a changing environ ment[J].Jour nal of Experi mental Botany,1996,47(2):145-159.
[17] Ko matsu S,Thibaut D,Hiraga S,et al.Characterization of a novel flooding stress-responsive alcohol dehydrogenase expressed in soybean roots[J].Plant Molecular Biology,2011,77(3):309-322.
[18] Strommer J.The plant ADH gene family[J].The Plant Jour nal,2011,66(1):128-142.
[19] Balakhnina T,Bennicelli R,Stêpniewska Z,et al.Stress responses of spring rape plants to soil flooding[J].Inter national Agr ophysics,2012,26:347-353.
[20] 施美芬,曾波,申建红,等.植物水淹适应与碳水化合物的相关性[J].植物生态学报,2010,34(7):855-866.
