不同载体蛋白偶联制备促红细胞生成素二聚体单克隆抗体的选择优化
2014-09-14邱贞琴邰秀珍
邱贞琴,邰秀珍
(1.中国人民解放军第89医院统供中心,山东潍坊261021;2.内蒙古医科大学临床医学系,内蒙古呼和浩特010110)
不同载体蛋白偶联制备促红细胞生成素二聚体单克隆抗体的选择优化
邱贞琴1,邰秀珍2
(1.中国人民解放军第89医院统供中心,山东潍坊261021;2.内蒙古医科大学临床医学系,内蒙古呼和浩特010110)
目的将EPO dimer分别连接牛血清蛋白(bovine serum alumin,BSA)、匙孔血蓝蛋白(keyhole limpet hemocyanin,KLH)、卵清白蛋白(ovalbumin,OVA)几个不同的载体蛋白构成抗原,免疫BALB/c小鼠,并结合特定的ELISA检测系统,来优化选择抗EPO dimer单克隆抗体。方法采用单克隆抗体制备技术筛选获得杂交瘤细胞;ELISA法鉴定杂交瘤细胞的特性;分析比较不同载体蛋白构建单克隆抗体的差异与效果。结果共筛选获得了5株杂交瘤细胞,5株杂交瘤细胞均能分泌EPO dimer抗体。经过进一步的特异性鉴定、亚型鉴定以及效价鉴定后,有4株杂交瘤细胞被挑选进行大量抗体制备,为后期临床基础实验提供材料。4株杂交瘤分别为克隆S-18-2,其亚型为IgG2b,κ;克隆S-369-7,其亚型为IgG1,κ;克隆S-410-3,其亚型为IgG1,κ;克隆S-514-7,其亚型为IgG2b,κ;其中克隆S-18-2、S-514-7分泌抗体EPO dimer的能力稳定,其抗体对载体蛋白OVA、KLH、BSA均无效价,且它们抗原抗体反应只针对EPO dimer;克隆S-369-7、S-410-3分泌抗体EPO dimer的能力也很稳定,对载体蛋白OVA、KLH、BSA也均无效价,尤其其抗原抗体反应可以同时针对EPO dimer以及EPO dimer-PEG,即本实验获得的这2株杂交瘤细胞分泌的抗体既可检测EPO dimer又可检测EPO dimer-PEG。比较连接BSA、OVA、KLH这几个不同载体蛋白构建单克隆抗体的差异与效果,发现以EPO dimer连接载体蛋白OVA获得的单克隆抗体效果最佳。结论本实验用偶联载体的方法增强了小分子EPO dimer的免疫原性,得到了稳定分泌EPO dimer抗体的杂交瘤细胞。
促红细胞生成素;单克隆抗体;酶联免疫吸附测定;杂交瘤技术
促红细胞生成素(erythropoietin,EPO)是一种肽类激素[1-2]。人体中的EPO能够促进红细胞生成、刺激幼稚红细胞的增生以及红细胞蛋白化和红细胞的成熟[3-4]。抗EPO的各类抗体可以用于多种疾病的诊断,同时重组人促红细胞生成素(recombinan thuman erythropoietin,rhEPO)注射液等已经成为治疗贫血的相关药物,被广泛用于临床[5-7]。目前国内外有较多的多克隆单抗用于检测促红细胞生成素二聚体(EPO dimer)或者聚乙二醇化促红细胞生成素二聚体(EPO dimer-PEG),但是同一杂交瘤克隆分泌的抗体既可检测EPO dimer又可检测EPO dimer-PEG,尚未见文献报道[8-9]。本实验旨在将EPO dimer分别与BSA、OVA、KLH几个不同的载体蛋白连接构成抗原,免疫BALB/c小鼠,结合ELISA检测系统,优化选择获得抗EPO dimer单克隆抗体。
1 材料与方法
1.1 材料
1.1.1 实验动物:纯系6~8周龄雌性BALB/c小鼠15只,体质量(22.0±0.9)g,购于中国科学院上海实验动物中心,动物合格证号:2011A032。动物饲养在中科院聚科生物园区清洁级动物房,按照中科院有关规定精心照料、饲养和使用,本研究严格遵循《实验动物保护条例》。
1.1.2 主要试剂:EPO dimer粉末购自Merck公司。牛血清蛋白(bovine serum alumin,BSA)和匙孔血蓝蛋白(keyhole limpet hemocyanin,KLH)购自美国Sigma公司;卵清白蛋白(ovalbumin,OVA)购自上海伯奥生物科技有限公司,DMEM培养液、8-氮鸟嘌呤、HAT培养基、胎牛血清、聚乙二醇(PEG1450)均购自Sigma公司、胎牛血清(FCS)购自Hyclone公司、HT培养液购自Gibco公司,二甲基亚砜(DMSO)购自Merck公司,mouse sub-isotype panel试剂盒购自Bio-red公司,其它试剂均为国产分析纯。
1.1.3 主要仪器:96孔培养板购自北京六一仪器厂;ELISA板为NUNC公司产品;AL104电子天平均购自天津市天马仪器厂;磁力搅拌器购自天津市华北实验仪器有限公司;HD-A显微镜购自上海沪西分析仪器有限公司。
1.2 实验方法
1.2.1 细胞培养:骨髓瘤细胞的准备:收集经8-氮鸟嘌呤筛选过的骨髓瘤SP2/0,显微镜下观察细胞活性,将活性良好的对数增值期的细胞洗涤后计数,细胞半悬浮在DMEM培养液中备用。饲养层细胞的准备。融合前1天,将5mL DMEM培养液注入小鼠腹腔,轻轻晃动后抽出腹腔液,离心,计数,调整细胞浓度为1×105个/mL,接种到96孔培养板内,50μL/well。脾脏细胞的准备:解剖加强免疫后小鼠,取脾脏,用机械法分散脾细胞,经滤网过滤得脾细胞悬液,DMEM培养液洗涤后计数。
1.2.2 细胞融合:融合过程中小鼠的脾脏细胞与小鼠骨髓瘤细胞比为5∶1。其他均按实验室常规方法进行[10]。将2种细胞混合于离心管中,加入无血清培养液,1500 r/min离心3 min,弃上清。打散沉淀细胞,逐滴加入1mL的50%PEG,边加边摇晃,1min内加完;静止90 s,让PEG继续作用;然后在150 s内逐滴加入37℃预温的无血清培养液10 mL,静置5 min,终止PEG作用;融合后细胞悬液进行1000 r/min离心3min;弃上清,将沉淀细胞轻轻打匀,加入25mL完全培养液,接种于饲养层细胞铺板的96孔板内,50μL/well,最后置于37℃,5%CO2培养箱内培养。第2天,加入2×HAT的完全培养液,100μL/well,使孔内终浓度为1×HAT,进行杂交瘤细胞的筛选。
1.2.3 杂交瘤细胞的建立:EPO dimer-BSA(EPODi-BSA):称取10mg BSA用2mL双蒸水溶解,得溶液1。1 mLEPO dimer与1m L溶液1混合,将2 m L 0.2%戊二醛溶液加入溶液1中。加完后,将反应液于室温下避光搅拌2 h,再加入1 mL 1 M glycine继续于室温下避光搅拌2 h,得到反应物EPOdimer-BSA溶液。PBS透析48 h,-20℃保存备用。紫外分光光度计测量蛋白浓度为3.2mg/mL。EPO dimer-OVA(EPODi-OVA):方法同上。紫外分光光度计测量蛋白浓度为4.6 mg/mL。EPO dimer-KLH(EPODi-KLH):方法同上。紫外分光光度计测量蛋白浓度为3.7mg/mL。
以制备的EPO Di-BSA、EPO Di-OVA、EPO Di-KLH为免疫原,100μg/只皮下多点免疫注射BALB/c小鼠共15只,每种抗原5只,免疫4次[11]。具体步骤:同一批次制备的EPO Di-BSA、EPO Di-OVA、EPO Di-KLH以相同剂量加等体积的弗氏佐剂混合,完全乳化后,对BALB/c小鼠背部皮下及足部进行多点注射免疫。接着再连续免疫3次,每次间隔3周。第1次免疫用完全弗式佐剂,第2次和第3次用不完全弗氏佐剂。第3次免疫后1周眼眶取血,分离血清,间接ELISA法检测血清抗体的滴度。融合前3d腹腔注射同样剂量EPO Di-BSA、EPO Di-OVA、EPO Di-KLH进行回忆刺激。
1.2.4 杂交瘤细胞效价及其亚型的鉴定:每株杂交瘤细胞以1×106个细胞加入9mL完全培养液,转入24.8 cm2培养瓶内,置于37℃,5%CO2培养箱内,培养3 d收集细胞培养物上清液[12],检测抗体效价及其亚型。按mouse sub-isotype panel试剂盒说明书的要求,取杂交瘤细胞的培养上清进行ELISA检测。
1.2.5 间接ELISA法检测:分别用EPO dimer以及EPO dimer-PEG以10μg/mL浓度100μL/well包被96孔ELISA板,3%gelatin封闭2 h,弃去封闭液拍干后依次加入待测上清、同时加入阳性、阴性对照,阳性对照为稀释过小鼠抗血清,阴性对照为未用过的干净培养液。随后加入HRP-羊抗鼠IgG(酶标二抗),孵育及洗涤后,以TMB显色及2mol/L H2SO4终止反应,于450nm处测定OD值。挑选对EPO dimer有抗体反应的培养物分别进行克隆化。
1.2.6 细胞克隆化过程:挑选单个集落培养物上清ELISA检测OD450值最高的孔进行再克隆,克隆化一般稀释到10个/mL,接种至饲养层铺板的96孔培养板上,100μL/well。待细胞培养至适当大小(一般为20%底板面积),吸取细胞培养上清用间接ELISA方法再次筛选抗体阳性孔。连续3次克隆后所有检测孔均3次达100%阳性,克隆化过程结束,进行细胞扩增。其他均按实验室常规方法进行[13-14]。
2 结果
2.1 载体蛋白的偶联 双紫外法检测偶联后的蛋白浓度,结果显示:EPO dimer蛋白浓度为5.0mg/mL,EPO dimer-BSA蛋白浓度为3.2mg/mL,EPO dimer-OVA蛋白浓度为4.6 mg/mL,EPO dimer-KLH蛋白浓度为3.7mg/mL,EPO dimer-PEG蛋白浓度为3.6 mg/mL。5个样品的蛋白浓度均达到免疫用蛋白的理想浓度。
2.2 抗体效价检测 免疫小鼠眼眶取血抗血清对EPO dimer抗体效价测定结果如表1。抗血清从1∶2000开始倍比稀释。表中以EPO Di-KLH#4小鼠抗体效价为64000,EPO Di-OVA#1小鼠抗体效价为64000,EPO Di-OVA#5小鼠抗体效价为32000。这3只小鼠为构建杂交瘤时脾细胞供体的首选,其他小鼠免疫效果均不理想,不适合构建杂交瘤。
2.3 细胞融合与克隆化 细胞融合小鼠脾细胞与小鼠骨髓瘤细胞融合后抗体检测的阳性结果见表2。EPODi-OVA为免疫原的#1小鼠脾脏与骨髓瘤融合率为89.5%,抗EPO dimer抗体的阳性率为8.10%。EPO Di-KLH为免疫原的#4小鼠脾脏与骨髓瘤融合率为91.4%,抗EPO dimer抗体的阳性率为3.64%。2次融合的融合率都符合此骨髓瘤的特性,EPO Di-OVA#1小鼠的阳性率高于EPO Di-KLH#4小鼠,即检测所得的阳性孔数量多,克隆后获得的克隆数量也会相应增多。
由EPO Di-OVA免疫的mouse#1脾脏细胞进行融合获得的5株杂交瘤克隆细胞(见表3)。S-18-2在克隆化过程中的克隆率都小于2/3,阳性率达到3次100%,说明它能稳定分泌抗EPO dimer抗体。S-87-8在克隆化过程中的克隆率都小于2/3,阳性率达到3次100%,说明它能稳定分泌抗EPO dimer抗体。S-233-11在克隆化过程中的克隆率都小于2/3,阳性率达到3次100%,说明它能稳定分泌抗EPO dimer抗体。S-306-13在克隆化过程中的克隆率都小于2/3,阳性率达到3次100%,说明它能稳定分泌抗EPO dimer抗体。S-369-7在克隆化过程中的克隆率都小于2/3,阳性率达到3次100%,说明它能稳定分泌抗EPO dimer抗体。
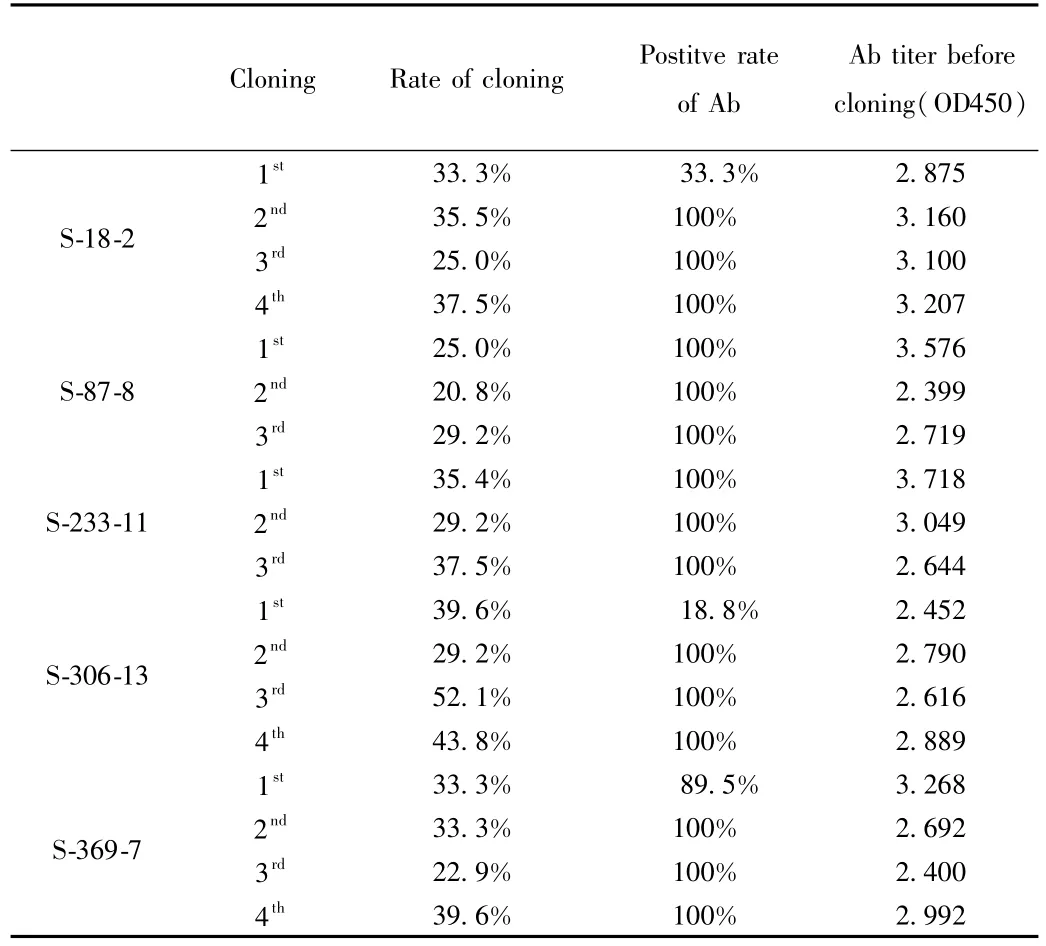
表3 5株杂交瘤克隆细胞的克隆化结果Tab.3 Cloning results 5 strains hybridoma clones of cells
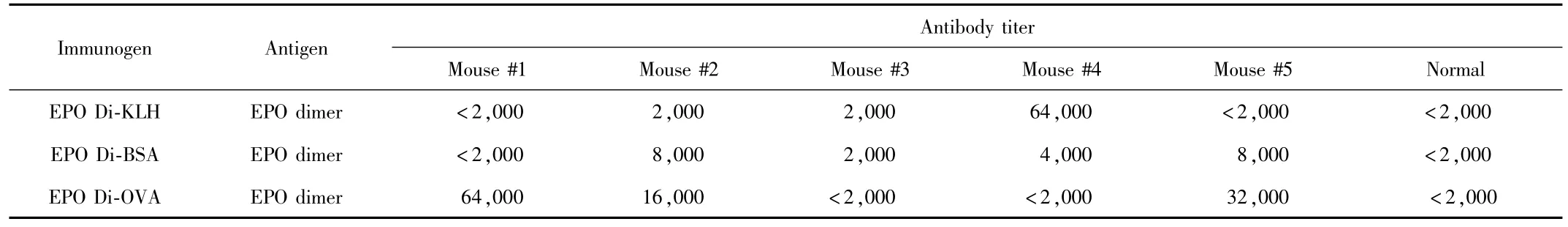
表1 免疫小鼠眼眶取血抗血清对EPO dimer抗体效价测定Tab.1 Determination of EPO dimer antibody titer of immunized mice with orbital blood antiserum
2.4 杂交瘤细胞的特性鉴定 5株杂交瘤克隆扩增冻存,并以1×106细胞加入9mL培液,培养3 d,收集细胞培养物上清液,检测抗体效价及其亚型(见表4)。由于杂交瘤是通过偶联载体进行免疫制备的,在特性鉴定的时候需要检测其对载体蛋白的抗体效价。克隆S-18-2,克隆S-18-2分泌的抗体只针对EPO dimer有抗原抗体反应。克隆S-87-8,克隆S-233-11,克隆S-306-13分泌的抗体分泌的抗体针对EPO dimer、EPO dimer-PEG均有抗原抗体反应。
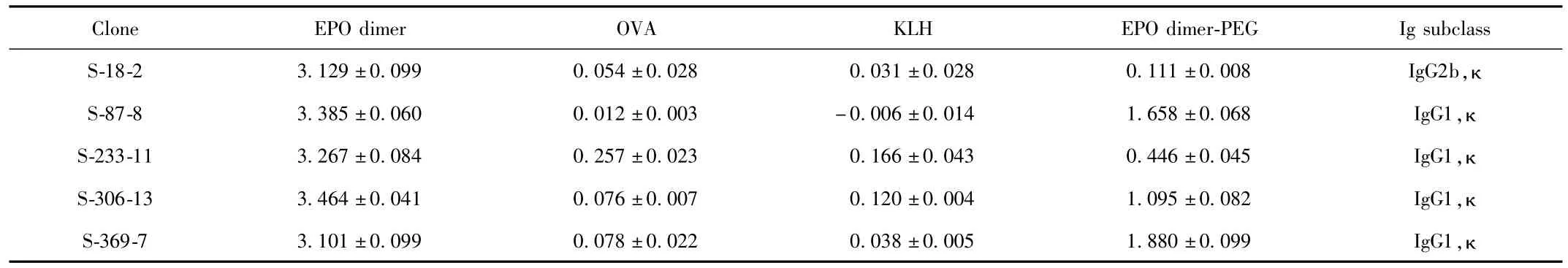
表4 5杂交瘤细胞的特性鉴定结果Tab.4 Characterization results of 5 hybridoma cells
3 讨论
本实验用偶联载体的方法增强了小分子EPO dimer的免疫原性,得到了稳定分泌EPO dimer抗体的杂交瘤,取得了良好的效果。由此总结:第一,选择正确的载体才能成功免疫和制备分泌小分子抗体的杂交瘤。本实验分别用BSA、OVA、KLH 3种载体蛋白偶联EPO dimer作为免疫原,最后优化选择偶联OVA与KLH的免疫小鼠作为脾细胞供体进行杂交瘤构建,比对后发现偶联载体蛋白OVA的构建效果最佳。对于其他的小分子如需构建杂交瘤,可以借鉴文献报道,也可以同本实验一样进行优化选择。第二,构建此类小分子抗体杂交瘤需要建立稳定可靠的ELISA检测系统,整个系统需确定有效的阴性对照以及阳性对照值,这在杂交瘤的筛选过程中起着重要作用。第三,用载体蛋白偶联小分子为免疫原比单纯将小分子聚合作为免疫原所获得的杂交瘤特性更丰富多变,这可能与分子量的增加,分子结构变化所致的结合位点的变化有关[15]。
[1]Gearing DP,King JA,Gough NM.Expression cloning of a receptor for human granulocyte-macrophage colony-stimulating factor[J].The EMBO J,1989,8(12):3667-3676.
[2]Burgeon E,Chapleur M,Schenen J,et al.Monoclonal antibodies tooxytocin:production and characterization[J].J Neuroimm unol,1991,31(4):235-236.
[3]Feldmann M,Maini R.Anti-TNF alpha therapy of rheumatoid arthritis:what have we learned.Annu Rev Immunol.2001,19(1):163-196.
[4]Sperb F,Werlang ICR,Margis-Pinheiro M,et al.Molecular cloning and transgenic expression of a synthetic human erythropoietin gene in tobacco[J].Applied biochemistry and biotechnology.Part A,enzyme engineering and biotechnology,2011,165(2):652-665.
[5]Jozsef Szeberenyi.Problem-solving Test:Expression Cloning of the Erythropoietin Receptor[J].Biochemistry and Molecular Biology Education,2008,36(3):236-238.
[6]Su L,Chen SS,Yang KG,et al.Cloning and expression of human stem cell factor fused with thrombopoietin mimetic peptide in Escherichia coli[J].Biotechnology Letters,2006,28(12):857-862.
[7]Christensen S,Egebjerg J.Cloning,expression and characterization of a sialidase gene from Arthrobacter ureafaciens[J].Biotechnology and Applied Biochemistry,2005,41(3):225-231.
[8]Yergeau DA,Schmerer M,Kuliyev E,et al.Cloning and expression pattern of the Xenopus erythropoietin receptor[J].Gene Expression Patterns,2006,6(4):420-425.
[10]Kwon DN,Choi YJ,Park JY,et al.Cloning and molecular dissection of the 8.8 kb pig uroplakin II promoter using transgenic mice and RT4 cells[J].Journal of Cellular Biochemistry,2006,99(2):462-477.
[11]Pandey A,Blagoev B,Kratchmarova I,et al.Cloning of a novel phosphotyrosine binding domain containingmolecule,Odin,involved in signaling by receptor tyrosine kinases.[J].Oncogene,2002,21(52):8029-8036.
[12]Pu JJ,Li C,Rodriguez M,et al.Cloning and structural characterization of ECTACC,a new member of the transforming acidic coiled coil(TACC)gene family:cDNA sequence and expression analysis in human microvascular endothelial cells.[J].Cytokine,2001,13(3):129-137.
[13]Lin FK,Suggs S,Lin CH.Cloning and expression of the human erythropoietin gene[J].Proceedings of the National Academy of Sciences of the United States of America,1985,82:7580-7584.
[14]Gregory RC,Lord KA,Panek LB,et al.Subtraction cloning and initial characterization of novel epo-immediate response genes.[J].Cytokine,2000,12(7):845-857.
[15]Bittorf T,Wright M,Jaster R,et al.cDNA cloning and functional analysis of a truncated STAT5a protein from autonomously growing FDCP-1 cells[J].Cellular Signalling,2000,12(11-12):721-730.
(编校:吴茜,王俨俨)
Preparation ofmonoclonal antibodies EPO dimer by hybridoma technique coup ling w ith different carrier
QIU Zhen-qin1,TAIXiu-zhen2
(1.Department of System for Center,People's Liberation Army of Eighty-ninth Hospital,Weifang 261021,China;2.Department of Clinical Medicine,Inner Mongolia Medical University,Huhehaote 010110,China)
ObjectiveTo connect EPO dimer with several different carrier protein antigen,BSA,OVA,and KLH,respectively,immune BALB/c mice,combined with the specific ELISA detection system,and optimize selection for resistance to EPO dimer monoclonal antibodies.MethodsHybridoma cells selected by an antibodies response against EPO dimer were cloned;hybridoma cell properties were identified by ELISA method,and the difference and effect of monoclonal antibodies constructed with different carrier were compared.ResultsBy monoclonal antibodies preparation technology,5 strains hybridoma were screened,5 hybridoma cells could secrete the EPO dimer antibodies.5 strains hybridomacells after further specific subtype identification,identification and titer evaluation,there were 4 strains hybridoma cells selected to prepare a large number ofantibodies,and provide clinicalbasic experimentmaterials.Four strains hybridoma cells:cloning S-18-2,the subtype of IgG2b,kappa;cloning S-369-7,the subtype of IgG1,kappa;cloning S-410-3,the subtype of IgG1,kappa;cloning S-514-7,the subtype of IgG2b,kapp.The cloneing S-18-2,S-514-7 secreted antibodies EPO dimer and the ability were stable,the antibodies to carrier protein OVA,KLH,BSA were void,and their antigen antibodies responsed only for EPO dimer;cloning S-369-7,S-410-3 secreted antibodies EPO dimer and the ability were also very stable,the carrier protein OVA,KLH and BSA were also invalid titer,the most important thing was:the antigen-antibodies reaction could simultaneously aim at EPO dimer and EPO dimer-PEG,that the secreting antibodies of2 strains hybridoma cells could detect EPO dimer and EPO dimer-PEG.Comparation results of the difference and effectofmonoclonal antibodies constructed with different carrier showed that itwas optimum while EPO dimer was connected with carrier protein OVA.Conclusion The smallmolecule EPO dimer coupling vector could enhance immunogenicity,and obtain the hybridoma cellsthat stable secretes EPO dimer antibodies.
erythropoietin;monoclonal antibodies;ELISA;hybridoma technique
R446.61
A
1005-1678(2014)08-0088-04
2012年国家自然科学基金(81260414)
邱贞琴,女,本科,主任医师,研究方向:药学及药学管理,E-mail:qch1821460035@163.com。
