胃癌中 TGFβ1 ,Smad3,Smad7蛋白的表达及意义
2014-09-13张德利李春辉
张德利 马 艳 李春辉
(承德医学院附属医院,河北 承德 067000)
胃癌的发生是一个多因素、多步骤的过程,涉及多方面机制。研究表明转化生长因子(TGFβ)/Smads信号通路中任何一个环节出现异常都可能导致信号转导的紊乱,从而导致胃癌的发生与发展。本研究分析TGFβ1、Smad3、Smad7表达与胃癌分化程度、淋巴结转移的关系。
1 材料与方法
1.1研究对象 收集我院2011年12月至2012年9月手术治疗后经病理证实的组织标本60例,正常胃组织20例(距离肿瘤10 cm以上认为正常胃组织)。60例胃癌患者中,男38例,女22例,年龄43~77〔平均(54.8±9.7)〕岁;其中低分化32例,高中分化28例;有淋巴结转移35例,无淋巴结转移25例。
1.2TGFβ1、Smad3、Smad7蛋白检测 兔抗人TGFβ1、Smad3和Smad7 多克隆抗体购自武汉博士德公司,即用型快捷免疫组化MaxVision试剂盒羊抗鼠/兔购自福州迈新生物技术开发有限公司(KIT-5010),免疫组化操作步骤严格按照试剂盒说明书进行以磷酸盐缓冲液(PBS)代替一抗作阴性对照,已知阳性切片作阳性对照。
1.3判定方法 光镜下观察切片中TGFβ1、Smad3和Smad7的表达和分布情况,每张切片选取5个高倍视野。TGFβ1 蛋白主要分布于细胞的胞质、呈棕黄色。Smad3和Smad7蛋白分布于细胞的胞质,胞核, 呈棕黄色颗粒。采用二级计分法判定结果:按染色强度分级,淡黄为1 分,黄或深黄2 分,褐或棕黄3分;阳性细胞计数<10%为0分,10%~25%为1分,25%~50%为2分,50%~75 %为3分,> 75 %为4分; 两者相加<2分为阴性(-);2~3分阳性(+);4~5分中等阳性();6~7分强阳性()。结果判定由两名病理医师经双盲法独立评分。
1.4统计学方法 应用SPSS11.5软件进行分析,等级资料采用秩和检验。
2 结 果
见图1,表1。在胃癌组织中,TGFβ1、Smad7的表达明显高于正常胃组织对照组(P<0.05),Smad3的表达明显低于正常胃组织对照组(P<0.05)。TGFβ1、Smad3、Smad7的表达与胃癌的分化程度、有无淋巴结转移有关。

TGFβ1,正常胃组织

TGFβ1,低分化胃癌组织
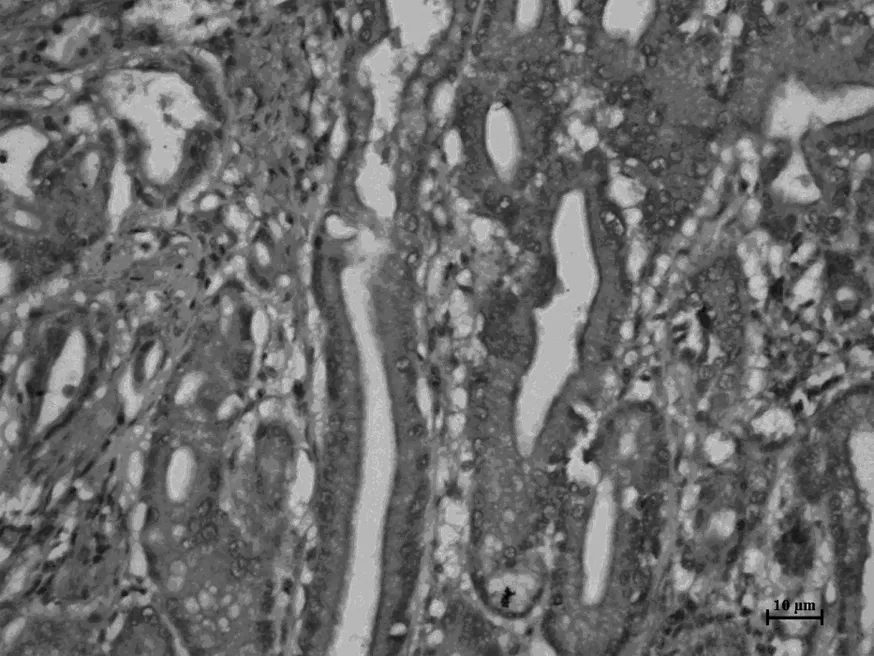
Smad3,正常胃组织

Smad3,高中分化胃癌组织

Smad3,低分化胃癌组织
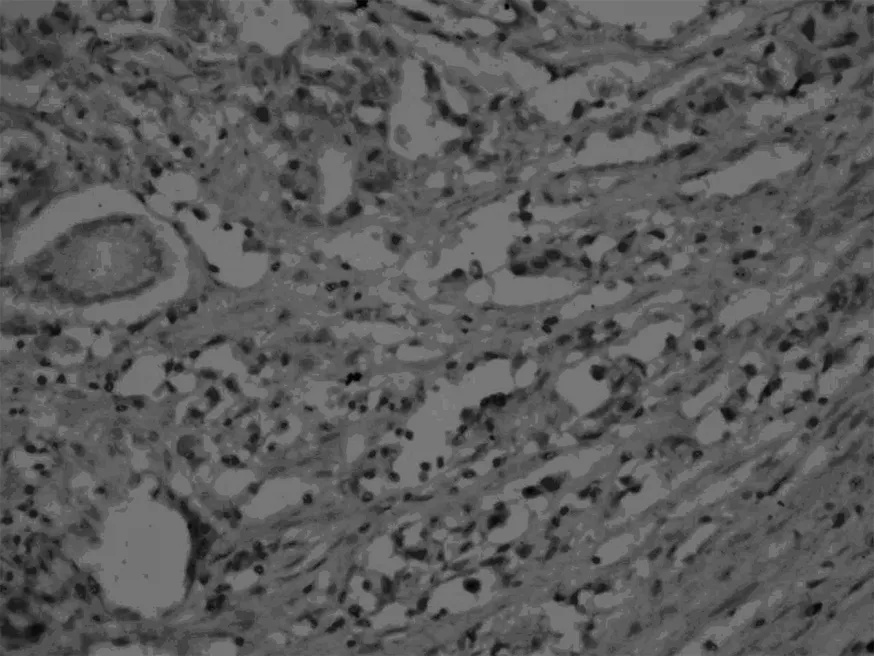
Smad7,正常胃组织
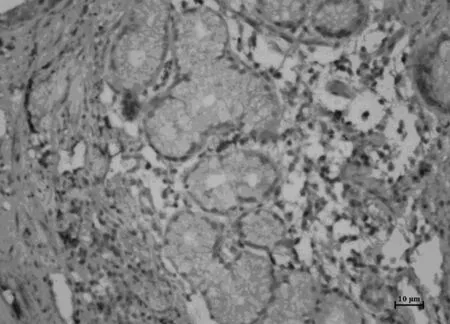
Smad7,高中分化胃癌组织
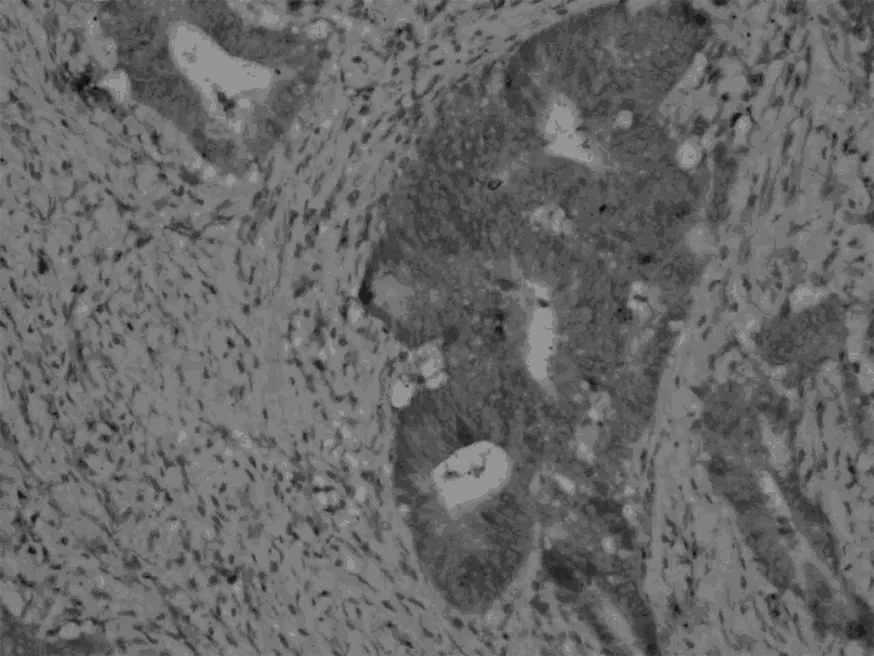
Smad7,低分化胃癌组织
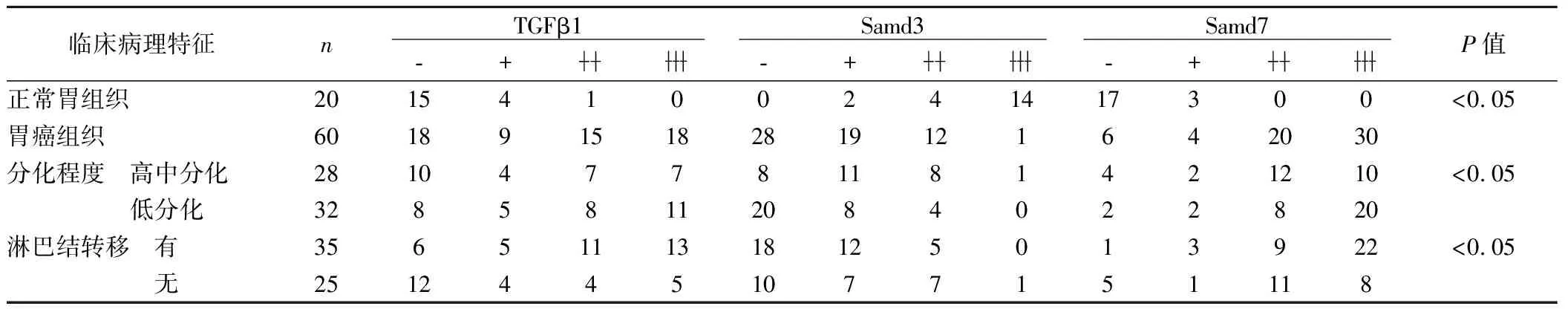
表1 TGFβ1、Smad3、Smad7的阳性表达在不同临床病理特征中的关系
3 讨 论
TGFβ是细胞生长的有效调节因子。在肿瘤发生的早期阶段,转化的细胞部分甚至完全抵抗TGFβ的生长抑制作用,导致肿瘤的发生。在肿瘤发展的晚期阶段,TGFβ促进肿瘤细胞生长、浸润、转移。有研究报道,在乳腺癌的发展进程中, TGFβ可从抑癌因子转变为促进癌转移的因子;Smad2/3表达降低,虽然促进了肿瘤的形成,同时也抑制了肿瘤的转移,提示Smads信号在肿瘤转移中的作用〔1,2〕。
TGFβ1是TGFβ家族的主要成员,是调节正常细胞生长以及各种生物学功能的主要细胞因子,文献报道 TGFβ1在乳腺癌、结肠癌、前列腺癌等恶性肿瘤中呈过度表达,其过度表达在肿瘤转化、进展中起重要作用,与预后相关〔3,4〕。
本实验研究发现胃癌组织TGFβ1呈过表达状态,随着胃癌临床病理分期的进展以及淋巴结转移,TGFβ1表达逐渐加强,提示TGFβ1有可能促进胃癌的进展。这与Naef等〔5〕的研究结果一致。另外TGFβ1在肿瘤中高表达的原因还可能由于胃癌组织细胞失去了对TGFβ1的敏感性,导致TGFβ1的反馈性表达升高。
TGFβ/Smads信号传导途径调节细胞生长的基本过程: TGFβ配体→TGFβ受体→Smads 蛋白→转录因子→DNA 表达。传导途径中任一部分的变化都可能引起信号转导的紊乱,最终导致肿瘤发生。Smads蛋白是TGFβ/Smads信号途径的关键分子,Smads具有核转位功能和转录活性。Smad3是通路特异性Smad 蛋白,与Ⅰ型受体识别,使之磷酸化,能够被TGFβ1受体识别,生成复合物,由胞质转移至胞核,调节基因转录〔6〕。尽管在人类恶性疾病中未找到Smad3的突变,但Smad3抑制子对Smad3表达调节的紊乱将有助于Smad3的功能性灭活,一旦Smad3活性受到抑制,就为肿瘤细胞提供了一个选择性生长优势。因此,有人认为Smad3在TGFβ信号通路中有抑癌基因的作用。
Smad7是抑制性蛋白,与TGFβⅠ型受体结合,与通路特异性Smad3 蛋白竞争结合位点,从而对该通路进行负向调节,阻止受体Smads(R-smads)磷酸化,未磷酸化的R-smads不能同通用Smad(Smad4)结合形成异源复合物,进而不能转位到细胞核调控靶基因的转录。研究结果显示,Smad7也可通过抑制Smad3的活化、Smad3/Smad4异源复合物的形成及核转位,从而拮抗TGFβ对细胞的生长抑制效应。原因在于Smad3功能受高表达Smad7抑制,不能有效启动介导生长终止基因的转录,使细胞生长发生紊乱,从而有可能向恶性化发展〔7,8〕。
近来的报道显示,Smad7基因扩增与胃癌、结肠癌患者的预后不良有着密切的关系。表明TGFβ信号转导抑制因子Smad7过表达是肿瘤细胞抵抗TGFβ生长抑制作用的机制之一〔9,10〕,有研究〔11〕显示胰腺癌中Smad7表达上调,并且转染了Smad7基因的胰腺癌细胞恶性程度增高,裸鼠成瘤能力增强,提示Smad7表达上调有助于恶性肿瘤的发生。
综上所述,Smad7蛋白在胃癌组织中表达上调,Smad3蛋白在胃癌组织中表达下调,且与胃癌分化程度密切相关。同时也表明Smad3、Smad7对维护TGFβ1/Smads信号通路的平衡至关重要。
4 参考文献
1Tang B, Vu M, Booker T,etal.TGF-β switches from tumor suppressor to prometastatic factor in a model of breast cancer progression〔J〕.J Clin Invest,2003;112(7):1116-24.
2Tian F, DaCosta-Byfield S, Parks WT,etal.Reduction in Smad2/3 signaling enhances tumorigenesis but suppresses metastasis of breast cancer cell lines〔J 〕 .Cancer Res,2003;63(23):8284-92.
3Wikstrom P,Damber J,Bergh A.Role of transforming growth factor-beta1 in prostate cancer〔J〕. Microsc Res Tech,2001;52(4):411-9.
4Ghellal A,Li C,Hayes M,etal. Prognostic significance of TGF beta 1 and TGF beta 3 in human breast carcinoma〔J〕. Anticancer Res,2000;20(6B):4413-8.
5Naef M,Ishiwata T,Friess H,etal.Differential localization of TGF beta isoforms in human gastric mucosa and overexpression in gastric carcinoma〔J〕.Int J Cancer,1997;71(2):131-7.
6申漫里, 冯永东, 高 纯,等.细胞周期蛋白β1在肿瘤细胞中的非时相性表达〔J〕.中华肿瘤杂志,2002;24(2):215.
7Flanders KC.Smad3 as a mediator of the fibrotic response 〔J〕.Int J Exp Pathol,2004;85(2):47-64.
8Monteleone G,Kumberova A,Croft NM,etal.Blocking Smad7 restores TGF-beta1 signaling in chronic inflammatory bowel disease 〔J〕.J Clin Invest,2003;108(4):601-9.
9Kim YH,Lee HS,Lee HJ,etal.Prognostic significance of the expression of smad4 and smad7 in human gastric carcinomas〔J〕.Ann Oncol,2004;15(4):574-80.
10Boulay JL,Mild G,Lowy A,etal.Smad7 is a prognostic marker in patients with colorectal cancer〔J〕.Int J Cancer,203;104(4):446-9.
11Piek E,Westernmark U,Kastemar M,etal.Expression of TGF-beta recptors and Smad proteins in glioblastoma cell lines with distinct responses to TGF-beta1 〔J〕.Cancer,1999;80(5):756-63.
