Meso-四(对-羟基苯基)卟啉和溶菌酶的相互作用机理
2014-09-12赵婷婷毕淑云王天娇
赵婷婷,毕淑云,王 瑜,王天娇,庞 博
(1.长春师范大学化学学院,长春 130032;2.吉林出入境检验检疫局检疫检验技术中心,长春 130062)
Meso-四(对-羟基苯基)卟啉和溶菌酶的相互作用机理
赵婷婷1,毕淑云1,王 瑜1,王天娇1,庞 博2
(1.长春师范大学化学学院,长春 130032;2.吉林出入境检验检疫局检疫检验技术中心,长春 130062)
在模拟生理条件下,利用荧光光谱和同步荧光光谱法研究Meso-四(对-羟基苯基)卟啉(THPP)与溶菌酶的相互作用.结果表明:THPP对溶菌酶的猝灭过程为静态猝灭;291K时,THPP与溶菌酶的结合常数为5.97×104L/mol;疏水作用力为THPP与溶菌酶的主要作用力;金属离子Fe2+,Fe3+,Cu2+,Mg2+,Ca2+和Zn2+的存在不影响THPP与溶菌酶的结合常数;THPP与溶菌酶的结合距离为3.35nm;THPP可使色氨酸残基周围的极性减弱,疏水性增强.
meso-四(对-羟基苯基)卟啉;溶菌酶;荧光猝灭
溶菌酶是一种普遍存在于生物体内的小分子碱性蛋白,可与较多的内源和外源性物质结合,从而发挥其消炎、杀菌和抗病毒的作用[3].近年来,对小分子与蛋白质结合的研究已引起人们广泛关注[4-6].本文应用Adler法[7],即吡咯和取代苯甲醛在丙酸介质中回流,缩合得到THPP,选择溶菌酶作为模型蛋白,研究THPP与溶菌酶的相互作用及对溶菌酶构象的影响.
1 实 验
1.1 仪器与试剂
RF-5301PC型荧光分光光度计(日本岛津公司);恒温水浴锅(南京桑力电子设备厂);pH-3S数字酸度剂(南京桑力电子设备厂);TU-1901型紫外-可见分光光度计(北京普析通用仪器有限公司).溶菌酶(长春鼎国生物科技有限公司)储备液浓度为1.0×10-4mol/L,于4℃冰箱保存;THPP由长春师范大学无机实验室合成,由无水乙醇配置的储备液浓度为1.0×10-3mol/L;其他试剂为国产分析纯;实验用水为二次蒸馏水.
1.2 仪器工作条件
在荧光测定中,λex=280nm,激发和发射通带宽度均为3nm,扫描范围为290~450nm.紫外测定220~450nm的吸光度值.在同步荧光光谱扫描中,设定Δλ=60nm.
1.3 方 法
将125μL溶菌酶溶液和不同浓度的THPP溶液依次加入比色管中,用pH=7.4的Tris-HCl缓冲溶液定容至2.5mL.
2 结果与讨论
2.1 荧光猝灭机理
图1为291K时在pH=7.4的Tris-HCl缓冲溶液中5.0×10-6mol/L溶菌酶与THPP作用后的荧光光谱.在280nm激发溶菌酶时,其发射峰位于337nm处.由图1可见,随着THPP浓度的增大,溶菌酶的荧光强度不断降低并发生蓝移(从337nm移至333nm),即发生了猝灭作用,使得溶菌酶中色氨酸残基的疏水性增强[8].
荧光猝灭一般分为动态猝灭过程和静态猝灭过程:静态猝灭是指猝灭剂分子与荧光物质基态分子相互作用,生成非荧光复合物,导致荧光物质荧光强度降低;动态猝灭是指猝灭剂分子与荧光物质激发态分子相互碰撞,生成瞬时复合物而使其荧光猝灭.猝灭过程遵循Stern-Volmer方程[9]:
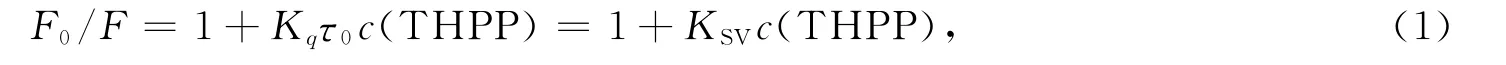
其中:F和F0分别为THPP存在和不存在时溶菌酶的荧光强度;c(THPP)为THPP的浓度;KSV为Stern-Volmer猝灭常数;τ0为溶菌酶的荧光寿命(生物大分子的τ0=10-8s[9]);Kq为猝灭速率常数,动态猝灭的猝灭常数与温度成正比.图2为不同温度下溶菌酶与THPP结合的Stern-Volmer曲线.将曲线上的值代入式(1)可得KSV和Kq值,结果列于表1.由表1可见,随着温度的升高,KSV逐渐减小,且Kq远大于各类猝灭剂对生物大分子的最大扩散猝灭常数(2×1010L/(mol·s))[10],表明THPP对溶菌酶的荧光猝灭过程为静态猝灭过程,THPP与溶菌酶形成复合物.

图1 291K时溶菌酶与THPP作用后的荧光光谱Fig.1 Fluorescence spectra of lysozyme in the presence of THPP at 291K

图2 不同温度下THPP与溶菌酶结合的Stern-Volmer曲线Fig.2 Stern-Volmer curves for THPP binding to lysozyme at various temperatures

表1 不同温度下Stern-Volmer的猝灭常数和猝灭速率常数Table 1 Stern-Volmer quenching constants and the quenching rate constants at various temperatures
2.2 结合常数与结合位点数及THPP与溶菌酶的结合作用力
THPP与溶菌酶相互作用的结合常数与结合位点数的计算公式[11]为


范德华力、氢键、静电引力和疏水作用力等是药物小分子与生物大分子间的主要作用力[12].由Vant Hoff方程:


图3 不同温度下lg((F0-F)/F)与lg(c(THPPt)-nc(溶菌酶t)(F0-F)/F0)的关系曲线Fig.3 Plots of lg((F0-F)/F)vs lg(c(THPPt)-nc(lysozymet)(F0-F)/F0)at various temperatures
可得不同温度下的ΔH,ΔG和ΔS值,结果列于表3.若ΔH<0,ΔS<0,则主要作用力为范德华力或氢键;若ΔH<0或ΔH≈0,ΔS>0,则主要作用力为静电引力;若ΔH>0,ΔS>0,则主要作用力为疏水作用力[13].由表3可见,ΔG<0,表明溶菌酶与THPP的结合为自发过程,由ΔH>0和ΔS>0表明,溶菌酶与THPP主要靠疏水作用结合.

表2 溶菌酶与THPP在不同温度下的结合常数KA和结合位点数nTable 2 Binding constants KAand binding sites nof THPP binding with lysozyme at various temperatures
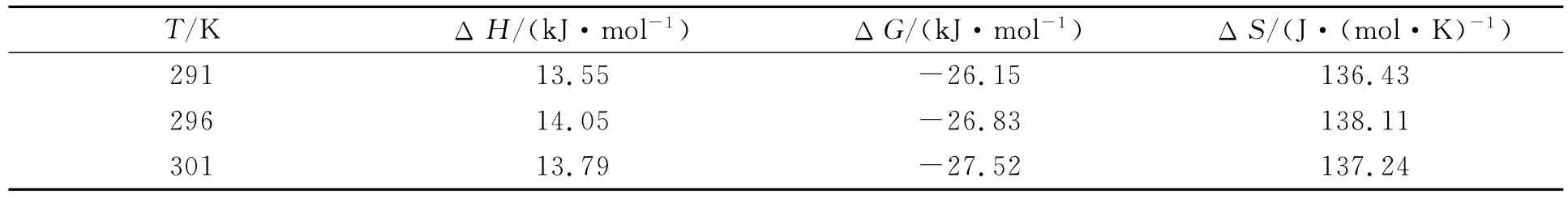
表3 不同温度下THPP与溶菌酶相互作用的热力学参数Table 3 Thermodynamic parameters for THPP binding to lysozyme at various temperatures
2.3 共存金属离子对THPP与溶菌酶作用结合常数的影响
测定291K时5.0×10-6mol/L的Fe2+,Fe3+,Cu2+,Mg2+,Ca2+和Zn2+对THPP与溶菌酶结合常数的影响,结果列于表4.由表4可见,金属离子的存在不影响THPP与溶菌酶的结合.

表4 291K时金属离子对THPP与溶菌酶相互作用的影响Table 4 Effects of metal ions on the binding of THPP to lysozyme at 291K
2.4 THPP对溶菌酶构象的影响
Δλ=60nm时浓度为5.0×10-6mol/L溶菌酶的同步荧光光谱如图4所示.由图4可见,随THPP浓度的增加,溶菌酶的荧光强度逐渐降低,在341nm处的发射峰发生了蓝移(从341nm移至336nm),进一步表明THPP使溶菌酶中色氨酸残基周围的极性减弱,疏水性增强[14],溶菌酶的构象发生改变.
2.5 结合距离
根据Förster非辐射能量转移理论[15],当溶菌酶的发射光谱与THPP的吸收光谱发生有效重叠时,溶菌酶与THPP间会发生非辐射能量转移,其能量转移效率E、给体-受体间的距离r0和临界能量转移距离R0的表达式分别为:

其中:R0是E为50%时的临界距离;K2为荧光给体与受体间偶极跃迁的空间取向因子,平均值为2/3;n=1.33[16]为介质折射常数;φ=0.13为不存在受体时给体的荧光量子产率;J为给体的荧光发射光谱和受体的吸收光谱间的重叠积分.溶菌酶的荧光光谱与THPP吸收光谱的重叠曲线如图5所示,其中溶菌酶和THPP的浓度均为5.0×10-6mol/L.计算结果列于表5.临界能量转移距离R0的理论值为5~10nm,给体和受体间结合距离r0的理论值为7~10nm[17].由表5可见,THPP与溶菌酶的R0和r0均在理论值范围内,因此,THPP与溶菌酶在相互作用过程中发生了非辐射能量转移.

图4 Δλ=60nm时溶菌酶与THPP相互作用的同步荧光光谱Fig.4 Synchronous fluorescence spectra of lysozyme in the presence of THPP atΔλ=60nm

图5 THPP的吸收光谱与溶菌酶荧光光谱的重叠曲线Fig.5 Overlaps of the absorption spectra of THPP with the fluorescence spectra of lysozyme

表5 Förster非辐射能量转移参数Table 5 Parameters of Förster non-radiation energy transfer
综上所述,本文研究了THPP与溶菌酶的相互作用.结果表明,二者结合时溶菌酶内源性荧光发生了有规律的动态猝灭;二者间的主要作用力为疏水作用力;Zn2+,Mg2+,Ca2+,Fe3+,Cu2+和Fe2+不影响THPP与溶菌酶的结合常数;相互作用时THPP使色氨酸残基周围的极性减弱,疏水性增强;THPP与溶菌酶间的结合距离为3.35nm;溶菌酶可携带THPP在体内进行运转、贮存和分配.
[1] 雷亚春,张勇,刘滇生,等.卟啉及其配合物在分析化学中应用进展[J].光谱实验室,2003,20(4):479-485.(LEI Yachun,ZHANG Yong,LIU Diansheng,et al.Progress of Porphyrin and Its Comlexes in Analytical Chemistry Application[J].Chinese Journal of Spectroscopy Laboratory,2003,20(4):479-485.)
[2] 张丽娜,陈欣,夏阳,等.荧光光谱法研究四苯基-锌金属卟啉与蛋白质的相互作用机理 [J].光谱学与光谱分析,2009,29(3):773-776.(ZHANG Lina,CHEN Xin,XIA Yang,et al.Study on Interaction Mechanism between Meso-tetra-(4-hydroxyphenyl)-Zn Porphyrin and Bovine Serum Albumin by Fluorescence Method[J].Spectroscopy and Spectral Analysis,2009,29(3):773-776.)
[3] 张海容,刘晓燕,李慧卿,等.药物青蒿素与溶菌酶相互作用研究[J].分析科学学报,2013,29(4):539-542.(ZHANG Hairong,LIU Xiaoyan,LI Huiqing,et al.Studies on the Interaction of Artemisinin with Lysozyme[J].Journal of Analytical Science,2013,29(4):539-542.)
[4] 宋志英,韩冬,王娟,等.四种呋喃香豆素类药物与溶菌酶的作用机制及构效关系研究 [J].分析测试学报,2013,32(1):23-31.(SONG Zhiying,HAN Dong,WANG Juan,et al.Study on Reaction Mechanisms and Their Structurectivity Relationship between Each of Four Furanocoumarin Drugs and Lysozyme[J].Journal of Instrumental Analysis,2013,32(1):23-31.)
[5] 周秀清,程建华,孙磊,等.用光谱法研究异鼠李素与牛血清白蛋白的相互作用及几种金属离子对反应的影响[J].吉林大学学报:理学版,2008,46(5):983-987.(ZHOU Xiuqing,CHENG Jianhua,SUN Lei,et al.Studies on Interaction between Isorhamnetin and Bovine Serum Albumin and Effects of Several Metal Ions on Interaction by Spectrometry[J].Journal of Jilin University:Science Edition,2008,46(5):983-987.)
[6] 毕淑云,宋大千,魏世刚,等.用荧光猝灭法研究人血清白蛋白与吲哚美辛的结合反应 [J].吉林大学学报:理学版,2006,44(3):493-496.(BI Shuyun,SONG Daqian,WEI Shigang,et al.Interaction between Indomethacin and Human Serum Albumin by Fluorescence Quenching Method[J].Journal of Jilin University:Science Edition,2006,44(3):493-496.)
[7] Adler A D,Longo F R,Finarelli J D,et al.A Simplified Synthesis for Meso-tetraphenylporphine[J].Journal of Organic Chemistry,1967,32(2):476.
[8] Yuan T,Weljie A M,Vogel H J.Tryptophan Fluorescence Quenching by Methionine and Selenomethionine Residues of Calmodulin:Orientation of Peptide and Protein Binding[J].Biochemistry,1998,37(9):3187-3195.
[9] Lakowicz J R.Principles of Fluorescence Spectroscopy[M].New York:Plenum Press,1999:237.
[10] Ware W R.Oxygen Quenching of Fluorescence in Solution:An Experimental Study of the Diffusion Process[J].Journal of Physical Chemistry,1962,66(3):455-458.
[11] BI Shuyun,SONG Daqian,KAN Yuhe,et al.Spectroscopic Characterization of Effective Components Anthraquinones in Chinese Medicinal Herbs Binding with Serum Albumins[J].Spectrochimica Acta:A Mol Biomol Spectrosc,2005,62(1/2/3):203-212.
[12] Leckband D.Measuring the Forces That Control Protein Interactions[J].Annual Review of Biophysics and Biomolecular Structure,2000,29:1-26.
[13] Ross P D,Sabramanian S.Thermodynamics of Protein Association Reactions Forces Contributing to Stabiliby[J].Biochemistry,1981,20(11):3096-3102.
[14] Miller J N.Recent Advances in Molecular Luminescence Analysis[J].Proceedings of the Analytical Division of the Chemical Society,1979,16:203-208.
[15] Förster T.Intermolecular Energy Migration and Fluorescence[J].Annals of Physics,1948,2:55-57.
[16] Suzukida M,Le H P,Shahid F,et al.Resonance Energy Transfer between Cysteine-34and Tryptophan-214in Human Serum Albumin.Distance Measurements as a Function of pH[J].Biochemistry,1983,22(10):2415-2420.
[17] 陈国珍,黄贤智,许金钩,等.荧光分析法[M].2版.北京:科学出版社,1990:123.(CHEN Guozhen,HUANG Xianzhi,XU Jingou,et al.The Method of Fluorescence Analysis[M].2nd ed.Beijing:Science Press,1990:123.)
(责任编辑:单 凝)
Interaction Mechanism of Meso-tetra(4-hydroxyphenyl)porphyrin and Lysozyme
ZHAO Tingting1,BI Shuyun1,WANG Yu1,WANG Tianjiao1,PANG Bo2
(1.College of Chemistry,Changchun Normal University,Changchun130032,China;2.Technology Center of Inspection and Quarantine,Jilin Entry-Exit Inspection and Quarantine Bureau,Changchun130062,China)
Meso-tetra(4-hydroxyphenyl)porphyrin(THPP)interacting with lysozyme was investigated by the fluorescence spectroscopy under simulated physiological conditions.The results indicate that THPP quenched the intrinsic fluorescence of lysozyme via a static quenching procedure.The binding constant KAbetween THPP and lysozyme was 5.97×104L/mol at 291K.According to the thermodynamic parameters,it was obtained that hydrophobic was a main acting force between THPP and lysozyme.The presence of Fe2+,Fe3+,Cu2+,Mg2+,Ca2+and Zn2+did not affect the binding constant of THPP and lysozyme.According to Förster’s non-radiative energy transfer theory,the distance between THPP and lysozyme was 3.35nm.The synchronous fluorescence spectra reveal that the vicinity of tryptophan becomes more hydrophobicity with the increase of THPP.
meso-tetra(4-hydroxyphenyl)porphyrin(THPP);lysozyme;fluorescence quenching
O657.3
A
1671-5489(2014)04-0820-05
卟啉是卟吩环上连有取代基的一类大环化合物总称,在自然界和生命体中(如血红素和叶绿素等)广泛存在,在生命的新陈代谢过程中发挥重要作用[1].Meso-四(对-羟基苯基)卟啉(THPP)是一种具有亲水羟基的非水溶性卟啉,在生物学和医学领域应用前景广阔[2].
10.13413/j.cnki.jdxblxb.2014.04.37
2013-12-09.
赵婷婷(1990—),女,汉族,硕士研究生,从事光谱分析化学的研究,E-mail:949427203@qq.com.通信作者:毕淑云(1970—),女,汉族,博士,教授,从事光谱分析化学的研究,E-mail:sy_bi@sina.com.
吉林省自然科学基金(批准号:20140101023JC)、吉林省教育厅“十二五”科技项目(批准号:20140257)和长春师范大学研究生创新基金(批准号:CSCXY2013008).
