盐胁迫下吡虫啉对棉田土壤微生物数量及酶活性的影响
2014-09-06张清明冯瑞芝张保华刘鑫刚
张清明,冯瑞芝,2,张保华,刘鑫刚,王 智
(1.青岛农业大学 化学与药学院,山东 青岛266109;2.西北农林科技大学 理学院,陕西 杨凌712100)
棉花是我国重要的经济作物之一,由于其具有耐盐特性,从而适宜在相对盐碱土地上种植。黄河三角洲地区土壤在不同程度上有一定的盐碱特征,在农业生产中更适合于一些耐盐植物的种植。因此,目前棉花已成为黄河三角洲地区的主要农作物之一[1]。由于该地区土壤特征有其特殊性,农药等外源污染物的引入势必会对该地区土壤生态产生一定程度的影响。土壤微生物是维持土壤生态功能的重要组成部分,与土壤肥力和土壤健康有着密切联系,其数量多少与酶活性的高低在很大程度上能反映出土壤物质循环和转化的强度,因此土壤微生物数量和土壤酶经常被用来作为评价土壤生态系统变化的重要指标。土壤微生物活性与土壤类型[2]、土地利用方式[3]、施肥[4]、农药[5]等外源污染物影响关系密切。农药作为农田环境中主要的外源污染物之一,其对土壤生态环境的影响已引起越来越多的环境和土壤学领域相关学者的关注。吡虫啉作为烟碱类超高效杀虫剂,主要用于防治蚜虫、飞虱、叶蝉等刺吸式害虫,在棉花、小麦、水稻等作物中广泛应用。因此吡虫啉对土壤环境的影响也有一些相关报道,例如刘慧君等[6]研究表明土壤呼吸强度对吡虫啉较为敏感,使用初期会对土壤呼吸有强烈的抑制作用,但随着培养时间的延长,抑制作用逐渐消失。郑巍等[7]发现低浓度吡虫啉对土壤过氧化氢酶有抑制作用,而高浓度有激活作用。Singh等[8]研究了吡虫啉对花生田土壤中脱氢酶和碱性磷酸酶的影响,结果表明吡虫啉处理种子播种15~60d内能显著提高土壤中这两种酶的活性。而吡虫啉对于黄河三角洲地区相对盐碱类型土壤的影响尚未见报道,因此本文以黄河三角洲棉田土壤为研究对象,排除天气、植物根系及其他因素,利用室内培养试验测定盐胁迫下不同浓度吡虫啉对土壤微生物数量和几种酶活性的影响,探明其中的规律,以期为吡虫啉对盐碱土壤环境的安全评价及合理使用提供科学依据。
1 材料与方法
1.1 材料与仪器
吡虫啉标准品(98.5%),由德国 Dr.Ehrenstorfer公司生产;其他化学试剂均为分析纯。SHP-250型智能生化培养箱,上海三发科学仪器有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;JA5003N电子分析天平,上海精密科学仪器有限公司。
1.2 土壤样品
供试土壤采集于黄河三角洲地区山东省滨州市滨城区梁才街道滩部村棉田。取样方法采用五点法,采集过程中除去土壤表面的杂草、枯叶和1cm左右的表层土后,采集耕作层约为20cm厚度的土壤。采集回来的土壤样品先剔除石块和植物体等杂物,再经自然风化,过1mm筛。完全混合后放置4℃备用。土壤为沙壤土,pH 值为7.65,有机质14.2g/kg,有机氮97.6mg/kg,速效磷13.6mg/kg,速效钾112.7 mg/kg,含盐量0.09%。
1.3 试验方法
1.3.1 土壤的预处理与试验设计 向过筛后的土壤样品中加入蒸馏水,使其含水量达到最大持水量的60%。完全混匀后置于25℃的恒温培养箱中黑暗培养14d,恢复其生物学特性。文献检索表明吡虫啉在土壤中的初始残留量一般在10μg/g以下,因此本试验中吡虫啉共设 4 个施药剂量 (0,0.4,2.0,10 μg/g),添加盐的浓度设置为0,0.3%两个处理。每个处理均设置三次重复,其处理如表1所示。
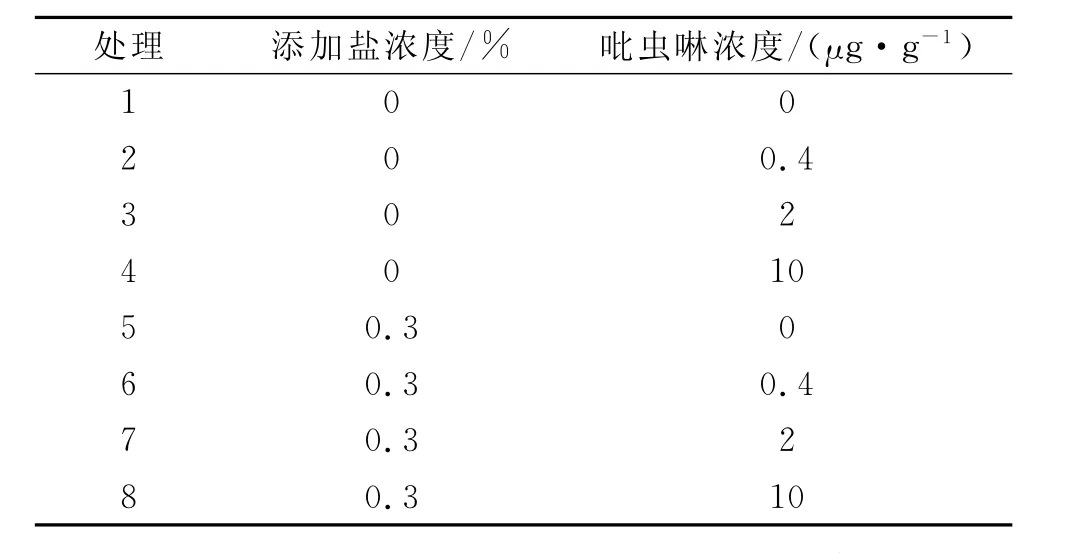
表1 供试土壤的处理
1.3.2 土壤染毒 称取约1 000g预培养的土壤,分出约100g土壤,按表1所示的处理浓度分别加入不同浓度的以乙腈为溶剂的吡虫啉工作溶液和氯化钠固体,混合均匀后,再将这100g土壤混入剩余的土壤中,使土壤混合均匀,调节其含水量为最大持水量的60%,分装250ml棕色试剂瓶中(每瓶装约100 g土壤),放于25℃恒温培养箱中黑暗培养,每隔2d调节一次水含量,使之保持恒定。药剂处理后分别于7,14,21,28d测定土壤微生物的数量和土壤酶的活性。
1.3.3 土壤微生物数量的测定 微生物数量测定采用平板计数法[9]。细菌采用牛肉膏蛋白胨培养基;放线菌采用改良高氏一号培养基,真菌采用PDA培养基,选取每皿30~300个菌落的平板进行计数,计数结果以每克干土中的菌落平均数表示。
1.3.4 土壤酶活性的测定 土壤碱性磷酸酶的活性采用磷酸苯二钠比色法,酶活性单位用PNP(对硝基苯)μg/g干土表示;土壤脲酶活性测定采用靛酚蓝比色法测定,酶活性单位以NH4-Nμg/g干土表示;土壤中的β-葡萄糖苷酶活性采用对硝基酚-β-D-吡喃葡糖苷比色法测定,具体操作方法参照文献[10-12]。
1.4 数据的统计分析
利用Excel 2007和SPSS 19.0对所得数据进行处理,数据结果表示为平均值±标准差,同一时间不同处理之间的差异采用Duncan′s新复极差法进行分析。
2 结果与分析
2.1 盐胁迫下吡虫啉对棉田土壤微生物数量的影响
2.1.1 吡虫啉对土壤细菌数量的影响 盐胁迫下吡虫啉对土壤细菌数量的影响如表2所示,土壤中细菌的数量与吡虫啉的处理浓度、处理时间有关。低盐土壤中,和对照相比,施0.4,2,10μg/g吡虫啉7d后,细菌数量显著增加,这可能与培养初期吡虫啉为细菌提供了刺激其生长的碳源和能源有关。而14d后中浓度(2μg/g)和高浓度(10μg/g)吡虫啉处理的土壤中细菌数量明显减少,在21d时达到最小,细菌数量分别比对照减少了32.3%和35.6%,出现这种情况可能是吡虫啉降解产物抑制了土壤中细菌的生长。在添加0.3%盐时,整个实验周期内吡虫啉对土壤中细菌数量表现出一定的刺激作用,特别是在7d时,0.4,2.0,10μg/g吡虫啉处理的土壤中细菌数量和对照相比分别增加了13.8%,44.3%,79.9%。随着培养时间的延长,在28d时除10μg/g吡虫啉处理组外,其他浓度吡虫啉处理组中细菌数量均恢复到对照水平。这可能是盐能钝化吡虫啉的降解从而降低了吡虫啉降解产物对土壤细菌生长的抑制作用,此推测还需进一步研究。从两种盐处理土壤细菌数量上进行比较,在添加0.3%盐的土壤中细菌数量明显少于不加盐的土壤,这说明盐的存在对细菌有毒性作用,本文发现也证实了周玲玲等[13]的观点。
2.1.2 吡虫啉对土壤放线菌数量的影响 盐胁迫下吡虫啉对土壤放线菌数量的影响见表3。由表3可知,在28d的实验周期内,不同浓度吡虫啉处理土壤中放线菌数量显著低于对照水平,且吡虫啉浓度越大,放线菌数量越少,这说明吡虫啉及其降解产物对放线菌有一定的毒性作用,从而产生了抑制作用。而在添加0.3%盐的土壤中,与对照相比,三个浓度的吡虫啉在7,14,21d对放线菌有显著的刺激作用(p<0.05),且吡虫啉的浓度越大刺激作用越强,特别是在14d时,这种刺激作用达到最大,和对照相比土壤中放线菌数量分别增加了26.5%,65.6%,135.1%。这可能与盐胁迫下钝化了吡虫啉对放线菌的毒性,反而为其提供了生长的营养源有关。28d时,0.4,2 μg/g吡虫啉处理组土壤中放线菌数量逐渐恢复到对照水平,10μg/g吡虫啉依然对供试土壤中放线菌有显著的刺激作用(p<0.05)。这说明随着培养时间的延长和吡虫啉的降解,土壤中可供利用的碳源和能源逐渐减少,从而较低浓度吡虫啉处理土壤中放线菌数量逐渐和对照趋于一致。
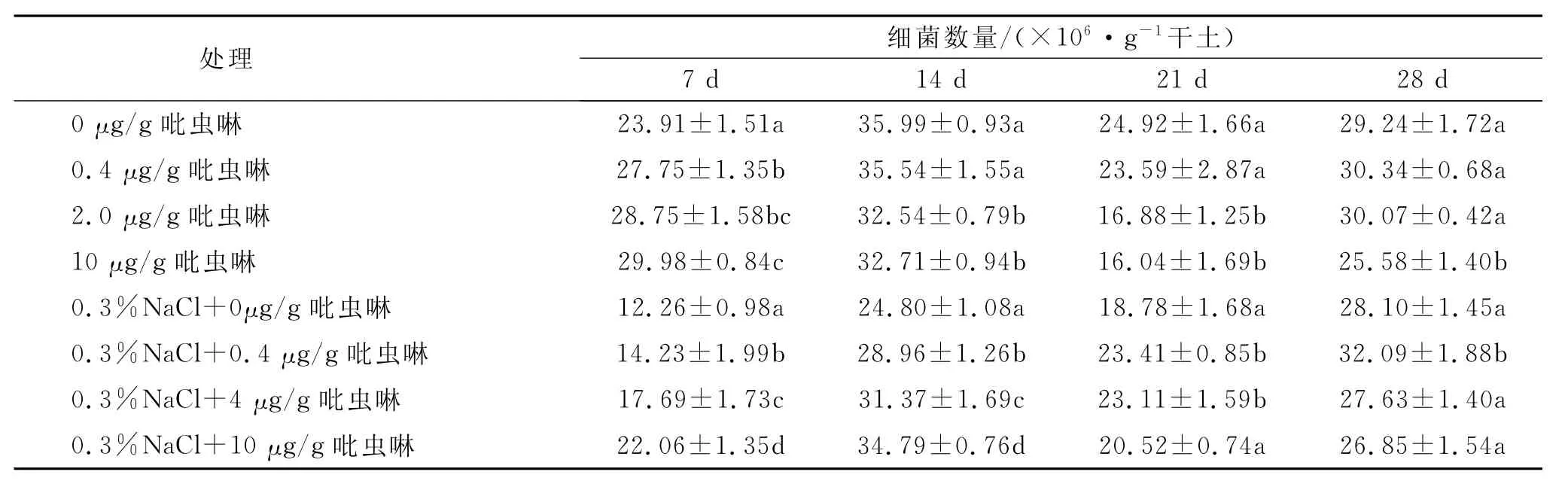
表2 盐胁迫下吡虫啉对土壤细菌数量的影响
2.1.3 吡虫啉对土壤真菌数量的影响 由表4可知,本实验所供试的棉田土壤中真菌数量明显偏少,这可能与所采集土壤的理化性质有关,经测定本实验供试土壤的pH为7.65,呈弱碱性,从而导致真菌数量少于中性和弱酸性土壤中真菌数量[14]。吡虫啉对供试土壤中真菌数量影响不大,仅在7d和14d时,10μg/g吡虫啉对土壤中真菌表现出一定的刺激作用,14d后各浓度吡虫啉处理土壤中真菌数量和对照无显著差异(p<0.05)。在添加0.3%盐土壤下,吡虫啉对真菌的影响和不加盐土壤真菌数量变化基本一致,这说明吡虫啉对土壤中真菌数量的影响和土壤中盐浓度关系较小。
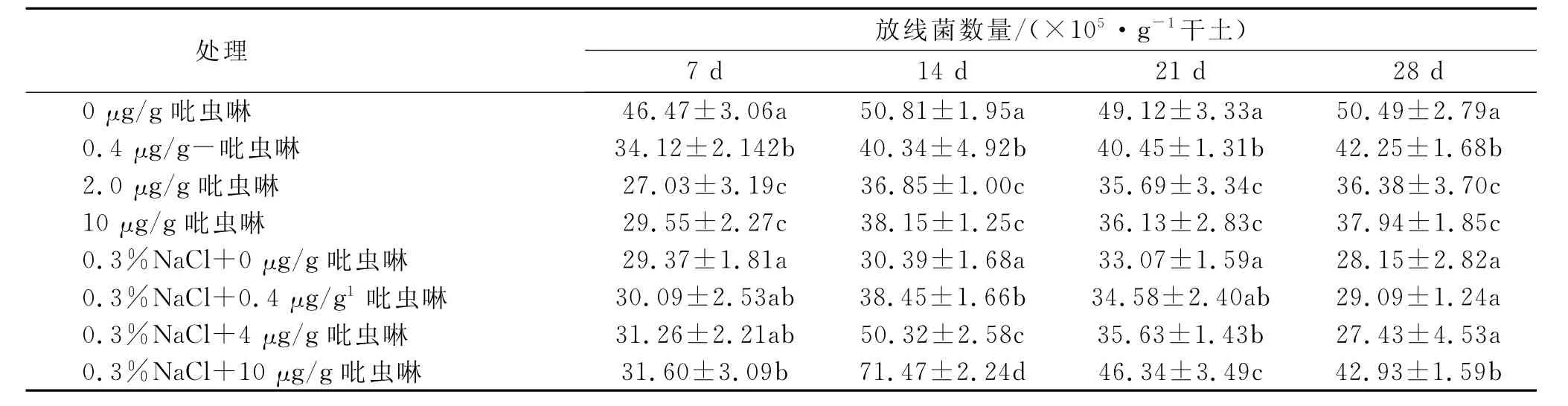
表3 盐胁迫下吡虫啉对土壤放线菌数量的影响
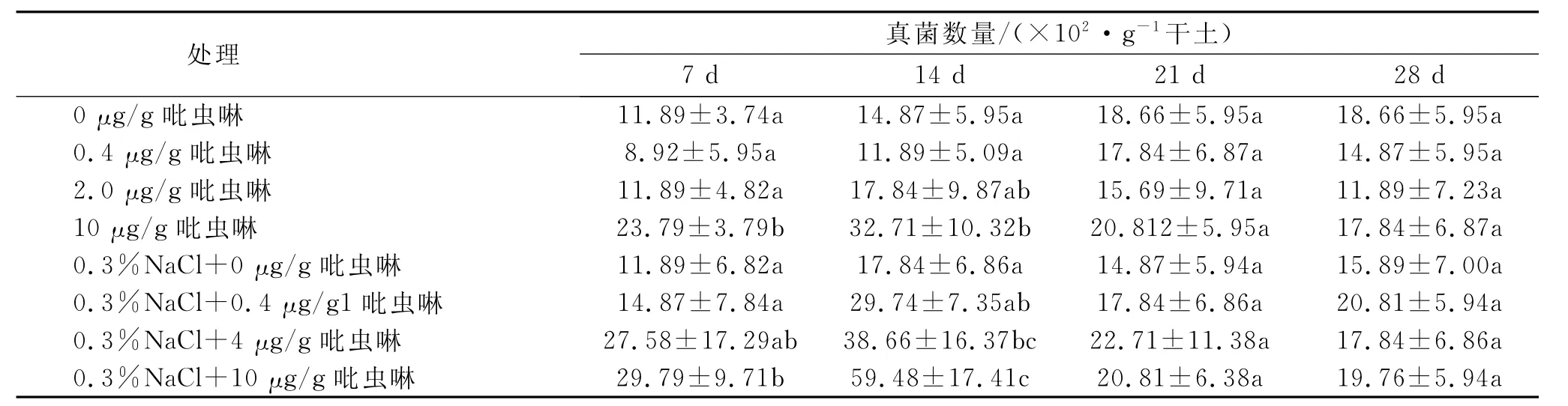
表4 盐胁迫下吡虫啉对土壤真菌数量的影响
2.2 盐胁迫下吡虫啉对棉田土壤酶活性的影响
2.2.1 吡虫啉对土壤碱性磷酸酶活性的影响 磷酸酶在土壤中以中性磷酸酶、酸性磷酸酶和碱性磷酸酶三种形式存在,所在环境不同,磷酸酶也表现出不同的活性[15]。因为本实验所用土壤为黄河三角洲棉田土壤,其盐含量相对较高,土壤呈弱碱性。因此本实验重点评价了吡虫啉对碱性磷酸酶活性的影响。由图1A可知,与对照相比,三个浓度的吡虫啉只在21 d时对碱性磷酸酶有激活作用,且吡虫啉的浓度越大,酶的活性越强,酶活性最大增加了14.9%;在7,14,28d时,吡虫啉对碱性磷酸酶的活性无显著性影响。这可能与供试土壤中P含量偏低有关[16],同时也说明吡虫啉在弱碱性环境下对碱性磷酸酶活性影响较小。当供试土壤中添加0.3%盐时,0.4,2μg/g的吡虫啉在整个试验周期内对碱性磷酸酶活性的影响与对照相比无显著性变化;但10μg/g吡虫啉处理组土壤中碱性磷酸酶活性在4个取样时间点均显著提高(p<0.05),酶活性增加了8.8%~12.9%(图1B)。可以推测相对高浓度盐的存在改变了土壤环境,从而使吡虫啉对碱性磷酸酶活性的影响发生改变,但是不会对其产生抑制作用。
2.2.2 吡虫啉对土壤脲酶活性的影响 脲酶作为唯一催化尿素在土壤中的转化和生化作用的酶,与土壤生物化学循环中的氮循环密切相关,氨作为植物氮素营养来源之一是脲酶水解尿素而成,如果土壤中脲酶活性过低,将会影响土壤中尿素的利用率,若活性过高,会造成植物的氨中毒,对土壤肥力和作物的生长也不利[17]。由图2A 可知,与对照相比,0.4,2μg/g的吡虫啉在7,14d时对脲酶活性无显著影响,在21,28d时有显著的激活作用(p<0.05),且浓度越大激活作用越强,脲酶活性最大分别提高了6.2%和9.7%;10μg/g吡虫啉处理组在7,14d时土壤中脲酶活性显著高于对照水平(p<0.05),酶活性增加了12.9%,10.4%,而在21,28d酶活性低于对照水平,酶活性分别降低了14.7%,4.5%。由于不同土壤肥力条件下,不同杀虫剂对土壤脲酶的影响效果不一样,从本实验结果来看,可以推测吡虫啉对脲酶活性有刺激作用,且浓度越大,尿素水解高峰期出现的越早,高浓度吡虫啉的降解产物可能对脲酶活性有抑制作用,从而在试验后期脲酶的活性有所降低,这与文献报道的吡虫啉对大棚土壤脲酶活性影响的结果相似[18]。当土壤中添加0.3%盐时,与对照相比,三个浓度的吡虫啉处理只在14d对脲酶活性有明显的抑制作用(p<0.05),且与农药的浓度呈正相关,酶活性分别降低了5.8%,21.4%,32.6%;其他时间脲酶活性无显著性变化(图2B)。可以看出在添加0.3%盐胁迫下,吡虫啉对脲酶活性的影响明显降低,这说明盐的存在钝化了吡虫啉对土壤中微生物的影响从而降低了对脲酶活性的影响。
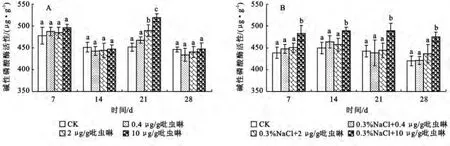
图1 盐胁迫下吡虫啉对土壤碱性磷酸酶活性的影响
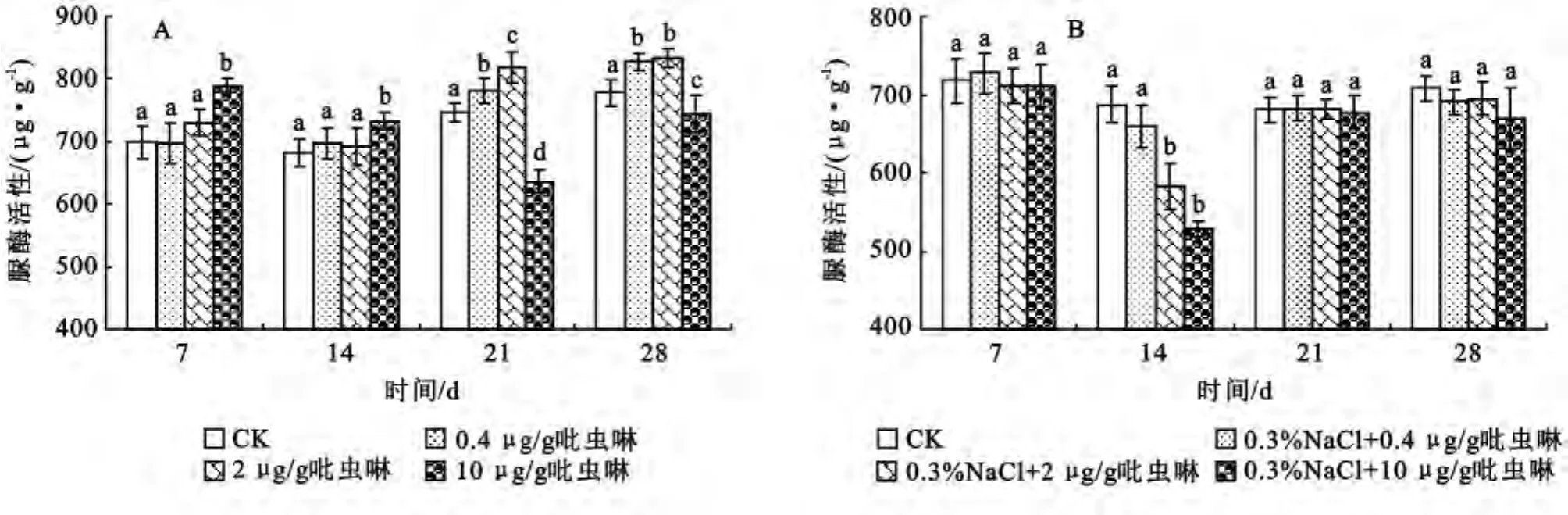
图2 盐胁迫下吡虫啉对土壤脲酶活性的影响
2.2.3 吡虫啉对土壤β-葡萄糖苷酶活性的影响 β-葡萄糖苷酶也是土壤中重要的酶之一,其被认为是纤维素降解中最重要的一种酶,与土壤碳代谢密切相关,它的酶促产物——葡萄糖是植物、微生物的营养源,因此β-葡糖苷酶活性可以表征土壤生物学活性强度[19]。本研究结果表明,在未加盐的土壤中,0.4μg/g的吡虫啉对β-葡萄糖苷酶活性没有影响,2,10μg/g吡虫啉对酶活性有显著的抑制作用(p<0.05),酶活性降低了9.2%~17.7%,表现出一定的毒性作用(图3A)。当土壤中添加0.3%盐时,三个浓度的吡虫啉只在14d对β-葡萄糖苷酶有显著的激活作用(p<0.05),酶活性分别增加了15.1%,19.6%,13.4%(图3B),整个试验周期内没有发现有抑制作用,这说明盐的存在能改变吡虫啉对土壤β-葡萄糖苷酶活性的影响,主要表现为可以减小其对β-葡萄糖苷酶的毒性。但该推测还需进一步验证。
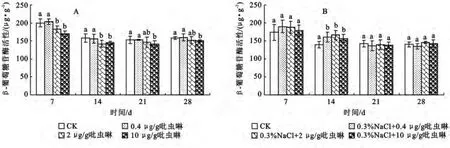
图3 盐胁迫下吡虫啉对土壤β-葡萄糖苷酶活性的影响
3 结论
根据以上实验结果可知,吡虫啉施用前期对细菌生长有促进作用,后期有抑制作用,农药的浓度越大,后期的抑制作用越强;添加盐时,后期的抑制作用消失,只表现出对细菌的促进作用。吡虫啉对放线菌有抑制作用,且浓度越大抑制作用越强,作用时间越长;添加盐时,吡虫啉在前期对放线菌有促进作用,后期低浓度处理的促进作用消除。吡虫啉在盐胁迫下对真菌影响不大;在添加盐和不添加盐的土壤中,吡虫啉对酶活性的影响也不相同。吡虫啉对碱性磷酸酶和脲酶有激活作用,添加盐时,高浓度的吡虫啉对碱性磷酸酶依然有激活作用,而吡虫啉对脲酶只有短暂的抑制作用;吡虫啉对β-葡萄糖苷酶有抑制作用,而添加盐时,吡虫啉对其则表现出激活作用;但实验后期两种条件下吡虫啉对土壤微生物和土壤酶的影响逐渐消失,说明0~10μg/g吡虫啉对黄河三角洲地区棉田土壤环境是安全的。
[1] 董合忠,辛承松,李维江,等.山东滨海盐渍棉田盐分和养分特征及对棉花出苗的影响[J].棉花学报,2009,21(4):290-295.
[2] 李媛媛,周运超,邹军,等.黔中石灰岩地区典型灌木林土壤酶活性与植物物种多样性研究[J].水土保持研究,2010,17(3):245-249.
[3] 左智天,田昆,向仕敏,等.澜沧江上游不同土地利用类型土壤氮含量与土壤酶活性研究[J].水土保持研究,2009,16(4):280-285.
[4] 解媛媛,谷洁,高华,等.微生物菌剂酶制剂化肥不同配比对秸秆还田后土壤酶活性的影响[J].水土保持研究,2010,17(2):233-238.
[5] 荆瑞勇,王丽艳.氯嘧磺隆对土壤微生物数量,酶活性及呼吸强度的影响[J].水土保持研究,2013,20(3):60-64.
[6] 刘惠君,郑巍,刘维屏.新农药吡虫啉及其代谢产物对土壤呼吸的影响[J].环境科学,2001,22(4):73-76.
[7] 郑巍,刘惠君,刘维屏.吡虫啉及代谢产物对土壤过氧化氢酶活性的影响[J].中国环境科学,2000,20(6):524-527.
[8] Singh J,Singh D K.Dehydrogenase and phosphomonoesterase activities in groundnut(Arachis hypogaea L.)field after diazinon,imidacloprid and lindane treatments[J].Chemosphere,2005,60(1):32-42.
[9] 赵斌,何绍江.微生物学试验[M].北京:科学出版社,2002.
[10] Tabatabai M A.Soil Enzyme[M]∥Weewer R M,Angle S,Bottomley P,et al.Methods of Soil Analysis,Part2.Microbiological and biochemical properties.Soil Science Society of American,Wisconsin WI,1994.
[11] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1983.
[12] Wang X C,Lu Q.Activity ofβ-glucosidase in paddy soils in the Taihu Lake Region[J].Pedosphere,2006,16(1):118-124.
[13] 周玲玲,孟亚利,王友华,等.盐胁迫对棉田土壤微生物数量与酶活性的影响[J].水土保持学报,2010,24(2):241-246.
[14] 陈为峰,史衍玺.黄河三角洲新生湿地不同植被类型土壤的微生物分布特征[J].草地学报,2010,18(6):859-864.
[15] 于群英.土壤磷酸酶活性及其影响因素研究[J].安徽技术师范学院学报,2001,15(4):5-8.
[16] 杨艳菊,王改兰,张海鹏,等.长期施肥条件下栗褐土碱性磷酸酶活性及其与磷形态的关系[J].土壤,2013,45(4):678-682.
[17] 谢勇波,周清明,龚道新.不同化学农药对土壤脲酶活性的影响[J].湖南农业科学,2010(2):63-65.
[18] 闫颖.五种农药对土壤酶活性影响的研究[D].长春:东北师范大学,2004.
[19] Bishnu A,Saha T,Mazumdar D,et al.Assessment of the impact of pesticide residues on microbiological and biochemical parameters of tea garden soils in India[J].Journal of Environmental Science and Health:Part B,2008,43(8):723-731.
