功能性氨基酸在动物机体内的代谢利用与生理功能
2014-09-04王蜀金陈惠娜方思敏郭春华
王蜀金,陈惠娜,方思敏,郭春华,王 永
(西南民族大学 生命科学与技术学院,四川 成都 610041)
功能性氨基酸在动物机体内的代谢利用与生理功能
王蜀金,陈惠娜,方思敏,郭春华*,王 永
(西南民族大学 生命科学与技术学院,四川 成都 610041)
氨基酸具有调节动物基因表达、促进小肠和骨骼肌的生长以及减少过多脂肪沉积等功能,而功能性氨基酸可在动物体中参与并调节动物健康水平与存活率、促进生长与发育、提高泌乳量与繁殖性能等关键代谢途径。论文对功能性氨基酸在动物机体中的代谢利用及生理功能进行了分析和综述,为进一步探索和解决功能性氨基酸“黑箱子”奥秘提供参考。
功能性氨基酸;代谢利用;生理功能
在人类和动物的营养研究中,一般根据生长和氮平衡需求,传统上将氨基酸分为必需氨基酸、条件性必需氨基酸和非必需氨基酸。必需氨基酸是指那些碳骨架自身不能合成或合成量不能满足机体需求而必需通过食物来满足的氨基酸;条件性必需氨基酸是指在正常情况下机体自身可以合成满足自身需求,但是当在某些情况下需求量超过合成速度时则需要从食物中获取以满足合适的氨基酸需求;非必需氨基酸是指机体可以通过自身合成或者其它氨基酸转化得到,而并不一定非从食物直接摄取的一类氨基酸。
在传统的氨基酸分类中存在着很多的缺陷和不足,具有重要生物功能的一类氨基酸却并未被完全纳入,世界卫生组织(WHO)的氨基酸评价体系中也只局限于必需氨基酸,而缺乏对具有重要生物能的氨基酸的客观评价。研究人员认为氨基酸功能(如繁殖、营养、疾病及预防等)应该作为必需氨基酸和条件氨基酸的分类标准之一[1-3],进而提出了功能性氨基酸的概念。功能性氨基酸是指在生物体中参与并调节那些能够提高健康水平和存活率、促进生长与发育、提高泌乳量和繁殖性能的关键代谢途径的氨基酸,包括谷氨酸、谷氨酰胺、半胱氨酸、亮氨酸、脯氨酸、色氨酸及精氨酸等[3-4]。本文对功能性氨基酸在动物的机体代谢以及调控功能等方面进行分析和综述,为未来功能性氨基酸在动物上的进一步深入研究提供参考。
2 功能性氨基酸的代谢途径及利用
2.1 功能性氨基酸在动物机体中的代谢途径
功能性氨基酸(如谷氨酸、谷氨酰胺、半胱氨酸、亮氨酸、脯氨酸、色氨酸及精氨酸)各自具有独特的生理功能,在动物机体中代谢极其复杂,对其归纳整理后主要包括:参与生物体内胞内蛋白质的周转(合成与降解)和相关途径[5];参与氨基酸代谢,如,氨基酸合成与分解[6-7];在机体内生成小肽、含氮代谢物和含硫物质[8];参与尿素循环并促进尿酸合成[9];参与和调控动物机体内三大营养物质代谢,尤其是脂类和葡萄糖代谢[10-11];参与一碳单位的代谢[12]和细胞氧化还原信号[13]。
2.1.1 精氨酸的代谢途径 精氨酸作为参与机体内重要生理代谢调控的一种半必需氨基酸,主要通过自身及其代谢产物参与生理代谢、提高免疫功能、促进激素分泌、维持大脑及骨骼肌功能等多方面均起着重要功能。可直接参与调控代谢:激活mTOR(哺乳动物雷帕霉素靶蛋白)信号、调节激素分泌、参与基因表达调控、促使蛋白质甲基化、调控细胞内蛋白质周转等;通过其代谢产物NO、胍丁胺及鸟氨酸等参与体内代谢调控:NO作为信号分子参与营养代谢、维持血管张力、调解底物代谢等,胍丁胺参与抑制一氧化氮合酶、鸟氨酸脱羧酶及单胺氧化酶的活性,鸟氨酸参与氨解毒、维持线粒体完整性、促进伤口愈合等[1-2,9,14]。
2.1.2 亮氨酸的代谢途径 亮氨酸在参与糖代谢、免疫功能调节、蛋白质合成和分解等多方面发挥重要调控作用[1]。可直接参与调控代谢:调控体内蛋白质周转、激活谷氨酸脱氢酶、参与支链氨基酸的平衡、促进机体骨骼肌及肠道粘膜的蛋白质合成且抑制其降解;通过其代谢产物α-酮异己酸和β-羟基-β-甲基丁酸等参与体内代谢调控:促进胰岛素和胰高血糖素样肽-1分泌以降低机体血糖浓度[2,38]。
2.1.3 半胱氨酸的代谢途径 半胱氨酸作为含硫氨基酸,在参与体内蛋白质合成、消除自由基等方面起着重要调控作用。可直接参与调控代谢:参与体内硫的转运、刺激免疫反应、清除自由基等;通过其代谢产物牛磺酸、H2S(硫化氢)、GSH(谷胱甘肽)等参与代谢调控:牛磺酸调控细胞氧化还原状态以及渗透平衡等,H2S作为信号分子参与体内代谢,GSH可清除自由基和其他活性氧分子[2-3]。
2.1.4 色氨酸的代谢途径 色氨酸是一种兼性生糖生酮氨基酸,也是单胃动物和幼龄反刍动物的必需氨基酸,主要通过自身及其代谢产物在繁殖、免疫、神经功能、抗氧化、营养代谢等方面起着重要调节功能。可直接参与调控代谢:调节免疫反应(T细胞受体、淋巴细胞增殖、细胞因子和抗体的产生)和预防疾病感染(包括病毒感染);通过其代谢产物5-HT(5-羟色胺)、NAS(N-乙酰-半胱氨酸)、N-乙酰-5-甲氧基色胺等参与体内代谢调控:5-HT作为神经递质参与神经调节以及抑制炎症因子产生和氧化,NAS参与抑制BH4及超氧化物产生,N-乙酰-5-甲氧基色胺作为抗氧化剂以抑制炎性细胞因子产生[1-3,9]。
2.1.5 脯氨酸的代谢途径
脯氨酸在精氨酸合成代谢及机体免疫反应等方面起着重要调控作用。可直接参与调控代谢:参与胶原蛋白的结构和功能、调控神经功能、维持渗透平衡等;通过其代谢产物过氧化氢、P5C(5-吡咯啉羧酸)、脯氨酸-羟基等参与代谢调控:过氧化氢在杀灭病原体、维持肠道完整性、参与免疫调节等方面起着重要调控作用,5-吡咯啉羧酸可调控细胞氧化还原状态、参与细胞增殖及DNA合成、促进多胺类合成等,脯氨酸-羟基参与胶原蛋白结构及功能[2-3,46,48]。
2.1.6 谷氨酸的代谢途径 谷氨酸在其他氨基酸代谢、应激反应、机体免疫反功能应等方面起着重要调控作用。可直接参与调控代谢:参与谷氨酰胺、瓜氨酸和精氨酸合成、在三羧酸循环中参与尿素循环,调控氨的消化吸收,作为小肠主要能源底物、激活NMDA(N-甲基-D-天冬氨酸)受体;通过其代谢产物GABA(氨基丁酸)等参与代谢调控:作为兴奋性神经递质、抑制T-细胞反应和炎症、调节肾脏中酸碱平衡、促进谷氨酸和蛋白质合成[2-3,55]。
2.1.7 谷氨酰胺的代谢途径 谷氨酰胺在营养代谢调控、氮平衡、蛋白质代谢、肠黏膜免疫等方面起着重要调控作用。可直接参与调控代谢:参与基因表达调控、提高免疫功能、作为小肠和免疫细胞的主要能源底物等;通过其代谢产物HMB(羟甲基丁酸钙)、核酸及尿酸等参与体内代谢调控:调控机体免疫反应、编码遗传信息、调控细胞周期及功能、促进蛋白质和尿酸合成、刺激淋巴细胞增殖、作为抗氧化剂等[1,55]。
2.2 动物对功能性氨基酸的利用率
动物对功能性氨基酸的利用率并不高,例如哺乳仔猪利用母乳中总功能性氨基酸合成蛋白质的比例仅为25.23%,而利用必需氨基酸和非必需氨基酸的比例分别为72.34%和49.29%。此外,断奶仔猪利用日粮中总功能性氨基酸的比例也仅为13.75%,而利用必需氨基酸和非必需氨基酸的比例分别为59.44%和43.38%(见表1)[14]。
日粮中40%精氨酸被小肠首过代谢分解[15],精氨酸缺乏是限制7~21 d 哺乳仔猪生长主要原因之一,这一阶段哺乳仔猪只能够利用不到40%精氨酸用于体内蛋白质合成,这显然不能满足其自身合成不少于0.68 g/kg BW d的精氨酸量[16]。与此同时,母乳中脯氨酸也是不能被仔猪完全消化吸收,这是因为母乳中脯氨酸能够进入仔猪门静脉的含量不足以合成所需蛋白质量,给哺乳仔猪静脉注射适量脯氨酸,其降解率仅为0.93 g/kg BW d,一旦降解率超过1.11 g/kg BW d或不低于60%脯氨酸能够用于体内蛋白质合成时,脯氨酸就会在动物体内从头合成[17]。动脉血液中的脯氨酸、谷氨酰胺及谷氨酸能够被仔猪的肠上皮细胞、淋巴细胞及肾脏广泛利用。有研究表明30%~40%脯氨酸、67%~70%谷氨酰胺以及几乎所有的谷氨酸可被哺乳仔猪、断奶仔猪及妊娠母猪小肠所降解[17],这就导致母乳和日粮中仅有5%谷氨酸、30%~33%谷氨酰胺及60%~65%脯氨酸能够进入门静脉循环中参与蛋白质合成代谢。进一步研究也发现母乳中谷氨酰胺-谷氨酸的含量占总非必需氨基酸的42%,但哺乳仔猪只能利用9%谷氨酸在体内合成蛋白质[18]。
动物在母乳和日粮中功能性氨基酸利用率如此低,研究功能性氨基酸在动物体内合成分解代谢途径且提高功能性氨基酸利用率是非常有意义的。
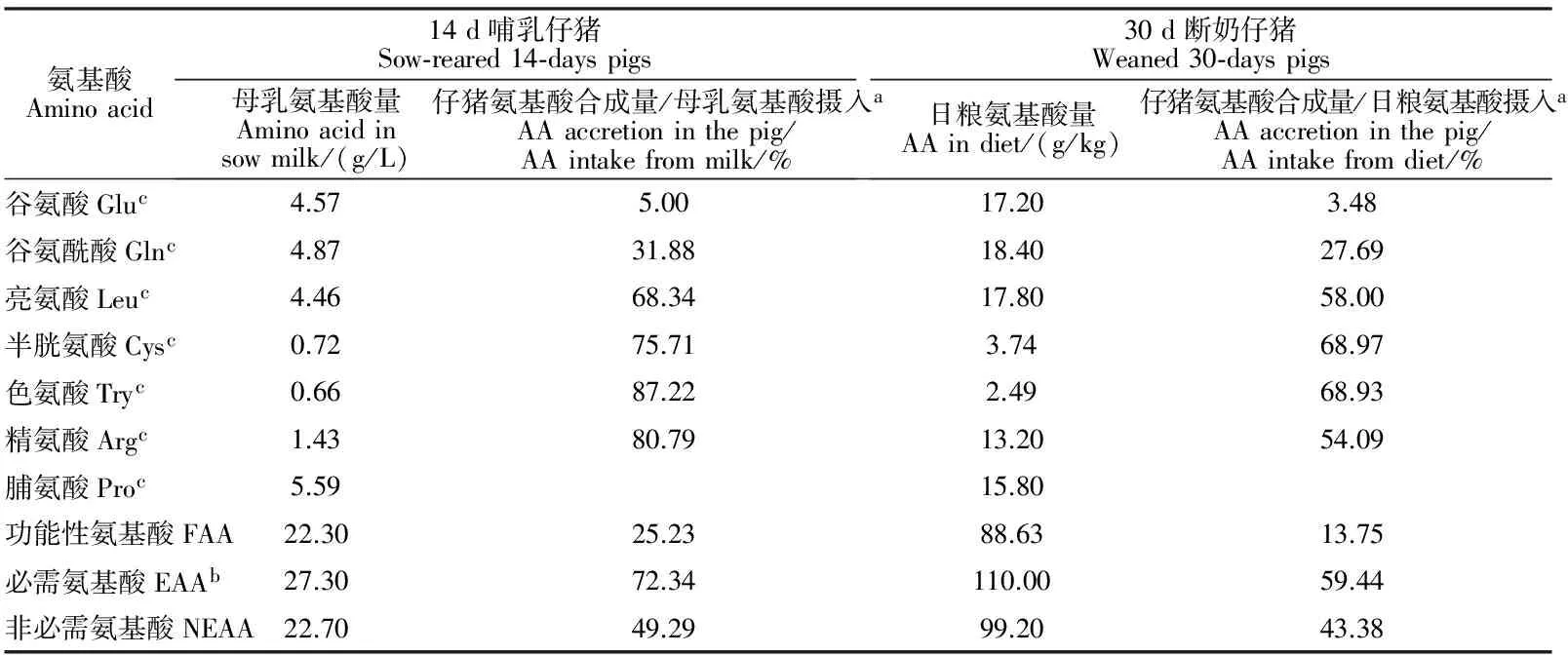
表1 14 d哺乳仔猪和30 d断奶仔猪(21 d断奶)母乳及日粮中氨基酸合成蛋白质的利用率[14]Table 1 Use ratio of dietary and sow-milk AA for protein accretion in sow-reared 14-day pigs and 30-day pigs weaned at 21 days of age
注:a.母乳和日粮中氨基酸摄入量是指从小肠进入门静脉的氨基酸含量;b.由于蛋白质合成量不足,精氨酸和脯氨酸是仔猪的必需氨基酸;c.功能性氨基酸。
Notes:a.Values in Table 2 are percentage of AA entering the portal vein from the small intestine;b.Arginine and proline are EAA for young pigs because of inadequate synthesis;c.Functional amino acids.
3 功能性氨基酸在机体中的生理功能
功能性氨基酸在机体很多生命活动中起着决定性的作用,如参与及调控机体的基因表达[19]、micro-RNA水平[20]、细胞信号通路[21]、内源和细胞介导的免疫反应[22]、动物细胞内的血流量[23]、褐色脂肪组织的发育[24]、抗氧化反应[25]、肠道微生物菌群的消长与代谢[26]及营养转运和代谢[27]。此外,这些功能性氨基酸还可参与动物的维持、生长、繁殖、免疫、调节一氧化氮、多胺和蛋白质的合成[1],同时,还可最大限度提高食物利用效率,从而利于蛋白质沉积,减少脂肪沉积,改善机体健康等。
3.1 精氨酸的生理功能
精氨酸可通过参与调控细胞内蛋白质周转和细胞增殖,促进动物的胚胎形成及着床、血管生成、胎盘及胎儿生长发育,从而提高动物产仔率[28]。有研究证实,补充1.0%精氨酸于妊娠14~28 d及30~114 d的怀孕母猪日粮中,可分别提高出生活仔数1头[29],进一步研究也发现添加1%的精氨酸可提高胚胎成活率,从而提高窝产仔数30%[30]。
精氨酸还可促进机体蛋白质合成及抑制其降解,其机理是通过激活动物肠上皮细胞及肌肉组织中雷帕霉素靶蛋白(mTOR)和其他相关激酶介导的信号通路,促进蛋白质合成和受损肠上皮细胞修复[16]。在7日龄断奶仔猪日粮中补充0.6%精氨酸,肌肉中mTOR磷酸化水平显著提高,从而通过调控蛋白起始翻译因子,提高动物机体的蛋白质合成[31]。Wu等[32]也报道,通过人工乳形式补充0.2%及0.4%精氨酸饲喂3~4日龄断奶仔猪1周后,体重可分别增加43%和93%。
精氨酸在动物机体的一些重要中间代谢也起着重要作用,如精氨酸可作为N-乙酰谷氨酸合成酶的变构激活因子,维持尿素循环在一个活跃状态,也可通过调节一些关键蛋白和酶的表达,减少动物体脂沉积。有研究发现精氨酸能够促进猪小肠分解代谢,有效抑制病毒感染和营养不良[33]。另外,精氨酸还可促进胰岛素、生长激素、泌乳素和胰岛素样生长因子的分泌,参与机体免疫功能调节[34]。
精氨酸协同其他氨基酸和其代谢产物在动物机体中也发挥着重要的生理功能,如精氨酸通过NO合成酶在许多重要细胞中合成NO来调控动物机体中葡萄糖、脂肪酸及氨基酸代谢。
3.2 亮氨酸的生理功能
亮氨酸是机体蛋白质周转的重要氨基酸,可参与骨骼肌蛋白质合成并抑制其降解,可提高蛋白质合成50%,抑制分解率仅为25%[35]。Escobar等[36-37]发现在正常生理状况下通过口服或者在日粮中补充亮氨酸有利于提高小鼠和刚出生小猪血液中亮氨酸水平,从而增加机体蛋白质合成。这是因为亮氨酸水平的提高使其mTOR磷酸化,促进p70S6激酶及起始因子4E-结合蛋白-1磷酸化,从而促进了多肽及蛋白质合成且抑制胞内蛋白水解[38]。
除骨骼肌外,亮氨酸也已被证明能减少肝脏蛋白质降解以及激活肠上皮细胞mTOR信号途径[39]。进一步研究发现,日粮中添加亮氨酸可显著提高28日龄断奶仔猪心脏、小肠后段、肾、肝脏、胰、脾和胃中的蛋白质合成速率。而在特殊生理时期(如饥饿、泌乳等),亮氨酸也可作为能量来源,有报道仔猪饥饿时其脑与肌肉中亮氨酸氧化量增加[40]。
亮氨酸协同其他氨基酸也发挥重要生理功能,如亮氨酸同异亮氨酸和缬氨酸作为动物机体组织(如骨骼肌)合成谷氨酰胺的底物参与机体重要代谢。另外,亮氨酸与谷氨酰胺和精氨酸参与胚胎、胎盘及胎儿生长发育等的调控。
3.3 半胱氨酸的生理功能
半胱氨酸作为一种含硫氨基酸参与体内蛋白质合成,且也是GSH(谷胱甘肽)及H2S的重要前体物,在动物机体内GSH与各种亲和电子和外源性化学物质形成共轭化合物可消除体内自由基和其他活性氧分子等,从而减少机体中有毒物质[1],因此,半胱氨酸是限制低分子含硫物质及关键抗氧化剂合成的主要氨基酸[41]。研究发现,一旦动物出现病毒感染,机体内半胱氨酸含代谢会发生显著变化,细胞外半胱氨酸的减少会降低CD4和γ-干扰素产生,通过抑制淋巴细胞增殖(由丝裂原刺激引起)且降低细胞毒T淋巴细胞活性,从而影响机体免疫功能。
半胱氨酸与其他氨基酸和其代谢产物在动物机体中也发挥着重要的生理功能,其代谢产物牛磺酸与甘氨酸能共同促进脂肪消化与吸收,而气体分子(如一氧化碳和硫化氢)发出细胞信号,参与信号转导[1]。半胱氨酸与谷氨酸及甘氨酸一起参与自由基清除、抗氧化、细胞氧化反应、免疫反应、细胞代谢、细胞凋亡、信号转导、基因表达等。
3.4 色氨酸的生理功能
色氨酸通过四氢生物喋呤依赖的色氨酸羟化酶途径分解产生5-羟色胺、N-乙酰血清素、褪黑色素和维生素L,这些物质可抑制超氧化物和肿瘤坏死因子α产生及清除自由基而增强机体免疫功能[1]。另外,这些物质通过调节诱导型NO合成,而N-乙酰血清素可影响免疫系统,尤其是巨噬细胞和淋巴细胞。
在炎性反应、存在内毒素及细胞因子刺激时,色氨酸在吲哚胺2,3-双加氧酶催化下能促进维生素L的分解代谢,且抑制自身免疫性神经炎症[42]。Esteban等[43]研究发现口服色氨酸可增强动物的先天性免疫反应。另外,色氨酸还协同烟酸一起参与体内重要生长代谢且还参与动物机体脂肪代谢[44]。
3.5 脯氨酸的生理功能
脯氨酸占胶原蛋白中氨基酸的1/3,除对免疫细胞参与创伤及外伤愈合具有关键作用外,还直接参与机体胶原蛋白结构功能、神经系统功能及体内渗透压。与此同时,脯氨酸-P5C循环功能也可调节细胞的氧化还原状态和淋巴细胞增殖活性,这可为脯氨酸阻止淋巴细胞凋亡、刺激细胞生长及促进抗体产生等作用提供一种细胞学机制[1]。
Ha等[45]发现脯氨酸氧化酶对机体免疫功能具有极其重要的作用,这是因为肠道中脯氨酸氧化酶不足导致脯氨酸分解代谢缺乏,从而降低肠道免疫功能。因此,在胚胎猪[46]和新生仔猪[47]生长发育关键时期,高活性的脯氨酸氧化酶在维持胎盘和仔猪肠道等器官的免疫功能中起着关键作用。研究发现,摄入非母乳日粮的仔猪比哺乳仔猪易发生肠道功能障碍,这也与母乳中存在脯氨酸氧化酶有关[48]。另外,脯氨酸与甘氨酸还能够参与合成胶原蛋白和改变胞外基质,从而参与蛋白结构功能及维持渗透平衡。
3.6 谷氨酸的生理功能
谷氨酸参与了机体内许多重要代谢,对动物最佳生长和健康来说是必需的。谷氨酸作为合成嘌呤和嘧啶核苷酸的能源底物,参与谷氨酰胺、瓜氨酸和精氨酸等的合成。其次,谷氨酸通过调控免疫细胞(如粒细胞及巨噬细胞)代谢,可参与机体免疫功能。除了在机体代谢中是底物能源物质外,谷氨酸也是一些神经系统(如中枢和外周神经系统)中的兴奋性神经递质,充当促代谢及离子移变的受体,也可调节机体免疫反应。另外,谷氨酸还是形成肉香味所必需的前体氨基酸,在肉鲜味及缓冲咸与酸中起到重要作用[49]。
谷氨酸与其他氨基酸和其代谢产物在动物机体中也发挥着重要的生理功能,如谷氨酸同谷氨酰胺刺激胎盘生长及转移母体营养物质到胚胎或胎儿中以促进妊娠阶段的生长发育[50]。另外,谷氨酸、谷氨酰胺和天冬氨酸是哺乳动物肠道细胞代谢的主要能源底物[51-52],参与小肠粘膜代谢。越来越多的证据也表明谷氨酸在胃肠道化学感应中扮演着重要角色的同时,在其他组织中也可能起到重要作用[53]。同时谷氨酸与谷氨酰胺、甘氨酸、色氨酸、酪氨酸、丙氨酸、天冬氨酸和丝氨酸一起调节神经系统的发育与功能[25,27,54]。
3.7 谷氨酰胺的生理功能
谷氨酰胺能够维护动物肠道屏障的完整性,在肠道粘膜代谢起着重要作用。Wu等[55]报道,补充1%谷氨酰胺于动物日粮中能够有效预防在断奶后7 d引起的空肠萎缩症,且增加料肉比25%。其次,谷氨酰胺还可通过促进骨骼肌及小肠粘膜蛋白质合成,来参与机体蛋白周转。
Rennie等[56]发现,灌注谷氨酰胺于老鼠骨骼肌中可促蛋白质合成且抑制其降解,其相关机理可能与mTOR信号通路有关。此外,亮氨酸、异亮氨酸以及缬氨酸是参与合成谷氨酰胺的底物,因此谷氨酰胺可调控动物机体支链氨基酸的合成效应,尤其是泌乳阶段的乳腺组织。
谷氨酰胺在机体免疫反应中也起到重要作用,这是因为谷氨酰胺作为淋巴细胞的主要底物能源物质参与淋巴细胞的增殖和功能[57],同时,谷氨酰胺还能增强巨噬细胞活性,促进细胞因子、T淋巴细胞、B淋巴细胞以及抗体产生[58]。在早期断奶仔猪日粮中补充谷氨酰胺,能够保持受内毒素感染仔猪的肌肉中谷氨酰胺浓度在一个正常生理水平,从而恢复淋巴细胞功能[59]。
谷氨酰胺同其他氨基酸在动物机体中也发挥着重要的生理功能,谷氨酰胺与亮氨酸调控胰腺β细胞分泌胰岛素[34]。谷氨酰胺还协同丙氨酸参与内脏器官氮源及碳源的代谢,并且产生HMB(羟甲基丁酸钙)来实现机体免疫反应。谷氨酰胺和天冬氨酸、甘氨酸及丝氨酸等氨基酸生产核酸,从而编码遗传信息、调控基因表达、细胞周期及功能、蛋白质和尿酸合成以及淋巴细胞增殖。
4 前 景
近年来,关于功能性氨基酸的研究扩展了人们对氨基酸和蛋白质相关代谢的认知,并且在生产实践中也得到了应用。随着营养学的深入研究和饲料业的快速发展,商业化的动物饲料配方中也应引入功能性氨基酸成分,从而达到能够提高动物健康水平和繁殖性能、预防疾病及降低养殖生产成本,提高养殖生产效益,促进养殖业健康发展的目的;另一方面,鉴于功能性氨基酸在人和动物体内具有如此巨大生物功能,如预防和治疗代谢疾病(如肥胖、糖尿病和心血管障碍)、无乳症、胎儿和后天生长迟缓、男女不孕不育、器官功能障碍和疾病感染(包括病毒感染)等,功能性氨基酸也将会被引入医疗保健领域,在提高人们的健康水平、生活质量和幸福指数等方面起着举足轻重的作用。
[1]Wu G.Amino acids:metabolism,functions,and nutrition[J].Amino Acids,2009,37:1-17.
[2]Wu G.Functional amino acids in nutrition and health[J].Amino Acids,2013,45:407-411.
[3]Kim S W,Mateo R D,Yin Y,et al.Functional amino acids and fatty acids for enhancing production performance of sows and piglets[J].Asian-Australasian Journal of Animal Sciences,2007,20:295.
[4]Wang S J,Li J Y,Guo C H,et al.A review on Tibetan swine (a)-Carcass,Meat quality,Internal organs,Basic nutrition component,Amino acids,Fatty acids,Inosine monophosphate and Muscle fiber[J].Agricultural Science & Technology,2013,14:1 369-1 374.
[5]Wauson E M,Zaganjor E,Cobb M H.Amino acid regulation of autophagy through the GPCR TAS1R1-TAS1R3[J].Autophagy,2013,9:418-419.
[6]Brosnan J T,Brosnan M E.Glutamate: a truly functional amino acid[J].Amino Acids,2012,45:413-418.
[7]Lei J,Feng D Y,Zhang Y L,et al.Nutritional and regulatory role of branched-chain amino acids in lactation[J].Front Biosci,2012,17:2 725-2 739.
[8]Mimoun S,Andriamihaja M,Chaumontet C,et al.Detoxification of H2S by differentiated colonic epithelial cells:implication of the sulfide oxidizing unit and of the cell respiratory capacity[J].Antioxid Redox Signal,2012,17:1-10.
[9]Wu G.Amino acids:biochemistry and nutrition[M].CRC Press Inc,2013.
[10]Dai Z L,Wu Z L,Yan Y,et al.Nitric oxide and energy metabolism in mammals[J].Biofactors,2013,39:383-391.
[11]Satterfield M C,Dunlap K A,Keisler D H,et al.Arginine nutrition and fetal brown adipose tissue development in nutrient-restricted sheep[J].Amino Acids,2011,45:489-499.
[12]Wang J J,Wu Z L,Li D F,et al.Nutrition,epigenetics,and metabolic syndrome[J].Antioxid Redox Signal,2012,17:282-301.
[13]Hou Y Q,Wang L,Zhang W,et al.Protective effects of N-acetylcysteine on intestinal functions of piglets challenged with lipopolysaccharide[J].Amino Acids,2012,43:1 233-1 242.
[14]Wu G.Functional amino acids in growth,reproduction and health[J].Advances in Nutrition,2010,1:31-37.
[15]Wu G,Bazer F W,Davis T A,et al.Arginine metabolism and nutrition in growth,health and disease[J].Amino acids,2009,37:153-168.
[16]Wu G,Knabe D A,Kim S W.Arginine nutrition in neonatal pigs[J].The Journal of Nutrition,2004,134:2 783-2 790.
[17]Wu G,Bazer F W,Burghardt R C,et al.Functional amino acids in swine nutrition and production.Dynamics in Animal Nutrition[M].Wageningen Academic Publishers,The Netherlands,2010:69-98.
[18]Kim S W,Mcpherson R L,Wu G.Dietary arginine supplementation enhances the growth of milk-fed young pigs[J].The Journal of Nutrition,2004,134:625-630.
[19]Kim J Y,Burghartdt R C,Wu G,et al.Select nutrients in the ovine uterine lumen:VII.Effects of arginine,leucine,glutamine,and glucose on trophectodem cell signaling,proliferation,and migration[J].Biology of Reproduction,2011,84:62-69.
[20]Liu X D,Wu X,Yin Y L,et al.Effects of dietary L-arginine or N-carbamylglutamate supplementation during late gestation of sows on the miR-15b/16,miR-221/222,VEGFA and eNOS expression in umbilical vein[J].Amino Acids,2012,42:2 111-2 119.
[21]Jewell J L,Russell R C,Guan K L,et al.Amino acid signaling upstream of m-TOR[J].Nature Reviews Molecular Cell Biology,2013,14:133-139.
[22]Ren W K,Zou L X,Ruan Z,et al.Dietary L-proline supplementation confers immuno-stimulatory effects on inactivated Pasteurella multocida vaccine immunized mice[J].Amino Acids,2013,45:555-561.
[23]Tan B E,Li X G,Wu G,et al.Dynamic changes in blood flow and oxygen consumption in the portal-drained viscera of growing pigs receiving acute administration of L-arginine[J].Amino Acids,2012,43:2 481-2 489.
[24]Wu Z L,Satterfield M C,Bazer F W,et al.Regulation of brown adipose tissue development and white fat reduction by L-arginine[J].Current Opinion in Clinical Nutrition & Metabolic Care,2012,15:529-538.
[25]Hou Y Q,Wang L,Yi D,et al.N-Acetylcysteine reduces inflammation in the small intestine by regulating redox,EGF and TLR4 signaling[J].Amino Acids,2012,45:513-522.
[26]Dai Z L,Li X L,Xi P B,et al.L-Glutamine regulates amino acid utilization by intestinal bacteria[J].Amino Acids,2012,45:501-512.
[27]Wang W W,Wu Z L,Dai Z L,et al.Glycine metabolism in animals and humans: implications for nutrition and health[J].Amino Acids,2013,45:463-477.
[28]Kim S W,Wu G,Baker D H.Amino acid nutrition of breeding sows during gestation and lactation[J].Pigs News Inform,2005,26:89-99.
[29]Wu G,Bazer F W,Burghartdt R C,et al.Impacts of amino acid nutrition on pregnancy outcome in swines: mechanisms and implications for swine production[J].Journal of Animal Science,2010,88:195-204.
[30]Zeng X,Wang F,Fan X,et al.Dietary arginine supplementation during early pregnancy enhances embryonic survival in rats[J].The Journal of Nutrition,2008,138:1 421-1 425.
[31]Yao K,Yin Y L,Chu W,et al.Dietary arginine supplementation increases m-TOR signaling activity in skeletal muscle of neonatal pigs[J].The Journal of Nutrition,2008,138:867-872.
[32]Wu G,Bazer F W,Davis T A,et al.Important roles for the arginine family of amino acids in swine nutrition and production[J].Livestock Science,2007,112:8-22.
[33]Cori B M,Rhoads R J,Harrell A T,et al.Rotaviral enteritis stimulates ribosomal p70 s6 kinase and increases intestinal protein synthesis in neonatal pigs[J].Faseb Journal,2005,19:A976.
[34]Newsholme P,Brennnan L,Rubi B,et al.New insights into amino acid metabolism,b-cell function and diabetes[J].Clinical Science,2005,108:185-194.
[35]Garlick P J.The role of leucine in the regulation of protein metabolism[J].The Journal of Nutrition,2005,135:1 553-1 556.
[36]Escobar J,Frank J W,Suryawan A,et al.Physiological rise in plasma leucine stimulates muscle protein synthesis in neonatal pigs by enhancing translation initiation factor activation[J].American Journal of Physiology-Endocrinology and Metabolism,2005,288:914-921.
[37]Escobar J,Frank J W,Suryawan A,et al.Regulation of cardiac and skeletal muscle protein synthesis by individual branched-chain amino acids in neonatal pigs[J].American Journal of Physiology-Endocrinology and Metabolism,2006,290:612-621.
[38]Li F N,Yin Y L,Tan B E,et al.Leucine nutrition in animals and humans:m-TOR signaling and beyond[J].Amino Acids,2011,41:1 185-1 193.
[39]Ban H,Shigemitsu K,Yamatsuji T,et al.Arginine and leucine regulate p70 S6 kinase and 4E-BP1 in intestinal epithelial cells[J].International journal of molecular medicine,2004,13:537-543.
[40]Snitinskii V V,Yanovich V G,Vovk S I,et al.Oxidation of [1-14C]leucine in the organs of young piglets during starvation and administration of adaptive hormones[J].Sel'skokhozyai?stvennaya Biologiya,1990,2:117-120.
[41]Wu G,Fang Y Z,Yang S,et al.Glutathione metabolism and its implications for health[J].The Journal of Nutrition,2004,134:489-492.
[42]Platten M,Ho P P,Youssef S,et al.Treatment of autoimmune neuroinflammation with a synthetic tryptophan metabolite[J].Science,2005,310:850-855.
[43]Esteban S C,Nicolaus A,Garmundi R E,et al.Effect of orally administered L-tryptophan on serotonin,melatonin,and the innate immune response in the rat[J].Molecular and Cellular Biochemistry,2004,267:39-46.
[44]Peters J C.Tryptophan nutrition and metabolism: an overview[M]//Springer,New York:Kynurenine and Serotonin Pathways,1991:345-358.
[45]Ha E M,Ch C T,Bae Y S,et al.A direct role for dual oxidase in drosophila gut immunity[J].Science,2005,310:847-850.
[46]Wu G,Bazer F W,HU J,et al.Polyamine synthesis from proline in the developing porcine placenta[J].Biology of Reproduction,2005,72:842-850.
[47]Wu G.Synthesis of citrulline and arginine from proline in enterocytes of postnatal pigs[J].American Journal of Physiology-Endocrinology and Metabolism,1997,272:1 382-1 390.
[48]Wu G,Bazer F W,Datta S,et al.Proline metabolism in the conceptus: implications for fetal growth and development[J].Amino Acids,2008,35:691-702.
[49]Spanier A M,Miller J A.Role of proteins and peptides in meat flavor[C]∥USA.ACS Symposium Series,1993:78-97.
[50]Vaughn P R,Lobo C,Battaglia F C,et al.Glutamine-glutamate exchange between placenta and fetal liver[J].American Journal of Physiology-Endocrinology and Metabolism,1995,268:705-711.
[51]Rezaei R,Wang W W,Wu Z L,et al.Biochemical and physiological bases for utilization of dietary amino acids by young pigs[J].Journal of Animal Science and Biotechnology,2013,4:7.
[52]Rezaei R,Knabe D A,Tekwe C D,et al.Dietary supplementation with monosodium glutamate is safe and improves growth performance in post weaning pigs[J].Amino Acids,2013,44:911-923.
[53]Gallinetti J,Harputlugil E,Mitchell J R.Amino acid sensing in dietary-restriction-mediated longevity:roles of signal-transducing kinases GCN2 and TOR[J].Biochemical Journal,2013,449:1-10.
[54]Fernstrom J D.Large neutral amino acids:dietary effects on brain neurochemistry and function[J].Amino Acids,2012,45:419-430.
[55]Wu G.Intestinal mucosal amino acid catabolism[J].The Journal of Nutrition,1998,128: 1 249-1 252.
[56]Fumarola C,Monica S L,Guidotti G G.Amino acid signaling through the mammalian target of rapamycin (mTOR) pathway: role of glutamine and of cell shrinkage[J].Journal of Cellular Physiology,2005,204:155-165.
[57]Field C J,Johnson I R,Schley P D.Nutrients and their role in host resistance to infection[J].Journal of Leukocyte Biology,2002,71: 16-32.
[58]Parrybillings M,Evans J,Calder P C,et al.Does glutamine contribute to immune suppression after major burns[J].The Lancet,1990,336:523-525.
[59]Yoo S S,Field C J,Mcburney M I.Glutamine supplementation maintains intramuscular glutamine concentrations and normalizes lymphocyte function in infected early weaned pigs[J].The Journal of Nutrition,1997,127:2253-2259.
MetabolismandPhysiologicalFunctionofFunctionalAminoAcidsinAnimals
WANG Shu-jin,CHEN Hui-na,FANG Si-min,GUO Chun-Hua*,WANG Yong
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu,Sichuan610041,China)
In the past decades,function study of amino acids concluded that several amino acids (AA) (e.g.,arginine,leucine,glutamic,proline,cysteine,and tryptophan) can modulate gene expression,enhance growth of the small intestine and skeletal muscle,or decrease excessive body fat.Thereby,some research put forward the concept on functional amino acids (FAA) including arginine,leucine,glutamine,glutamate,proline,cysteine,and tryptophan,which participate in and regulate some key metabolic pathways to improve health,survival,growth,development,lactation,and reproduction of the organisms.Herein,in this paper,the research status of the metabolism and physiological function of functional amino acids in animal were reviewed to study and discover “the black box” on functional amino acids.
functional amino acids; metabolism; physiological function
2014-05-26,
2014-07-01
国家科技支撑计划(2012BAD13B06)
王蜀金(1988-),男,重庆开县人,硕士,主要从事分子营养学与饲料资源开发利用研究。E-mail:137638758@qq.com
*[通讯作者]郭春华(1957-),男,四川内江人,博士,教授,研究方向:分子营养学。E-mail:531893818@qq.com
S811.6
A
1005-5228(2014)08-0006-07
