三种碳源对乌梁素海好氧不产氧光合细菌群落结构的影响*
2014-08-28赵吉睿巩瑞红勿力吉玛
赵吉睿,巩瑞红,,, ,勿力吉玛,,*
(1:内蒙古农业大学生命科学学院应用与环境微生物研究所,呼和浩特 010018) (2:内蒙古农业大学水利与土木建筑工程学院,呼和浩特 010018) (3:内蒙古自治区赤峰市喀喇沁旗锦山镇人民政府,赤峰 024400)
好氧不产氧光合细菌(Aerobic anoxygenic phototrophic bacteria, AAPB)是在有氧条件下以有机物、硫化物或氨等作为供氢体,通过细菌叶绿素捕获光能进行光合作用但并不释放氧气的一类原核生物[1]. AAPB广泛分布于海洋、热泉、河流、内陆湖泊等各种环境[2].其生物量占整个微生物群落的比例,在海洋中约为11%,在河口中最高可达34%,而在一些高山湖泊中的比例甚至超过了50%[3-4].
AAPB营光合异养的营养方式:溶解有机质(DOM)作为有机碳的来源维持生长代谢,同时它作为具有光合作用功能的细菌,以光合作用作为异养代谢的能量补充.因此,AAPB在水体碳循环中起着重要作用[3].AAPB可利用的碳源十分丰富,如有机酸、碳水化合物、乙醇和复杂的有机体等[5].葡萄糖、丙酮酸钠和酵母提取物常用作AAPB分离和培养的碳源,且培养效果较好[6].然而,这些碳源对AAPB群落结构的影响究竟如何尚不清楚.本研究通过对内蒙古高原湖泊乌梁素海水体分别添加葡萄糖、丙酮酸钠及酵母提取物进行室内诱导实验,以分析AAPB在经3种碳源诱导后群落结构的变化,为理解AAPB广泛的环境适应性、在碳循环中的作用及其菌种的分离和培养提供依据.
乌梁素海(40°47′~41°03′N,108°43′~108°57′E),位于内蒙古西部巴盟乌拉特前旗境内,属浅水湖泊(平均水深约1.0m,最深约2.5m),南北长约35~40km,东西宽约5~10km,湖面平均高程约为1018.5m,湖泊容量为2.5×108~3.3×108m3,湖面海拔1018.79m,现有水域面积约293km2,湖水最终由最南端汇入黄河,是黄河流域最大的湖泊,是地球上同纬度地区最大的自然湿地(已列入世界湿地公约).由于地处冬季寒冷干燥、夏季炎热少雨的全球半荒漠地区,乌梁素海成为了我国北方重要的生态屏障,在维持地区的生态平衡、保护物种的多样性方面起着举足轻重的作用[7].
1 材料和方法
1.1 样品采集、碳源添加和培养
于2010年8月内蒙古乌梁素海污染较严重的红圪卜湖区(HGB)(图1)采集表层(0~20cm)水样[8].样品置于低温(4℃)迅速运回实验室,分别在500ml三角瓶中分装入300ml水样.之后,分别添加葡萄糖、丙酮酸钠、酵母提取物3种碳源,至其在分装水样中总浓度分别均达到0.5g/L.每种碳源添加处理分别设置6个平行进行培养.样品编号如下:对照组(N0、N7、N14、N21),加葡萄糖组(G7、G14、G21),丙酮酸钠组(B7、B14、B21),酵母提取物组(Y7、Y14、Y21),编号中的数字代表取样时的培养天数.培养条件为:28℃恒温,光暗周期为14h∶10h.

图1 乌梁素海采样点分布Fig.1 Distribution of sampling site in Lake Ulansuhai
1.2 细菌过滤收集
分别在培养0、7、14和21d后于超净台中从各平行样中取出50ml水样,添加同种碳源的水样混合后过滤.样品过滤时先用10μm孔径的滤膜(所有滤膜均为美国Millipore公司生产,直径45mm)过滤以去除颗粒杂质以及真核生物,随后用0.22μm滤膜过滤,每张膜过滤100ml水样.将过滤好的滤膜用铝箔纸包好,经液氮速冻后放入-70℃保存备用.而取样后将剩余培养液置于1.1节中所述培养条件下继续培养.
1.3 样品总DNA的提取及PCR扩增
在超净台中用经灼烧灭菌的剪刀将上述冻存的滤膜剪成小碎片(大小约1mm×1mm),装入10ml离心管之后参考Boström等[11]的方法,采用酶解和反复冻融结合法提取DNA.以提取的总DNA为模版,用F341-GC(5′-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGCCTAGGGAGGCAGCAG-3′)及R907(5′-CCGTCAATTCMTTTGAGTTT-3′)引物扩增16S rDNA V3~V5区片段.用特异性引物UNIF(5′-GGNAAYYTNTWYTAYAAYCCNTTYCA-3′)及GC-WAW(5′-CCGCCGCGCGGCGGGCGGGGGGGGGCACCGGGGAYNGCRA-ACCACCANGCCCA-3′)扩增pufM片段[12].2个片段的PCR反应体系为:2μl DNA模板(约50ng/μl),0.4μl Easy-Taq酶,5μl扩增Buffer,4μl dNTP(20mmol/L),引物(20μmol/L)各0.5μl,Mg2+终浓度为3mmol/L,补水使总体积至50μl.
使用梯度PCR仪(Veriti9026,ABI,Germany)进行目的基因扩增.16S rDNA片段扩增条件为:94℃预变性5min;每个循环为94℃下变性1min,55℃下退火1min,72℃延伸1min,共30个循环;最后,在72℃下延伸10min.pufM片段扩增条件为:94℃预变性3min;每个循环为94℃下变性30s,50℃下退火45s,72℃延伸45s,共35个循环;最后,在72℃下延伸10min.2个基因的扩增产物经1%的琼脂糖凝胶电泳进行检测.
1.4 变性梯度凝胶电泳(DGGE)分析
运用基因突变检测仪(Dcode,Bio-rad,US)对16SrDNA[10]及pufM基因[11]进行DGGE分析:聚丙烯酰胺凝胶浓度为6%(用于16S rDNA分析)或8%(用于pufM基因分析),电泳缓冲液为1×TAE,变性梯度为45%~60%;PCR产物上样量为300ng DNA;电压80V,60℃,电泳13h;用0.2%硝酸银溶液染色15min,后用Gel DocTM EQ imager (Bio-Rad)成像拍照.
1.5 DGGE条带的序列测定及系统发育树的构建
用无菌刀片切割DGGE凝胶中的DNA条带,将切下后的不同条带分别放入1.5ml EP管中,以无菌去离子水冲洗5遍后,在EP管中加入40μl无菌水、置于4℃过夜,以使胶中的DNA溶出.之后,轻微振荡混匀再在1000转/min低速离心,吸取1μl上清液作为模板,用不含GC夹的引物,以与1.2节中相同的扩增程序及体系进行扩增.将纯化后的PCR产物与pEASY-T1载体连接,并转化入大肠杆菌DH5α感受态细胞,将阳性克隆送北京华大生物技术有限公司用ABI 3730XL型测序仪进行测序.手动去除载体序列,将有效序列在NCBI上进行比对,以其中同源性最高的序列确定为参比菌株,并用Mega 5.1软件,基于Kimura-2参数模型计算进化距离;用邻接法(Neighbor Joining Method)构建系统进化树[13],重复验证数为1000.
1.6 细菌群落多样性的统计学分析
应用Quantity One 4.4.0(Bio-Rad)对DGGE电泳图谱进行聚类分析,比较不同样品中菌群的基因型差异;香农-威纳多样性指数(Shannon-Wiener指数,H′)、丰富度(R)和均匀度指数(EH)被用来比较各个样品的细菌多样性[14],计算公式分别为:
(1)
R=S
(2)
EH=H′/Hmax=H′/lnS
(3)
式中,Pi是某个样品中i条带的强度占所有条带总强度的比率,S是某个样品中所有条带数目总和.
2 结果
2.1 DGGE图谱和群落多样性指数分析
16S rDNA的DGGE图谱分析表明,所有样品可分离到15~25条条带(图2a).葡萄糖诱导21d的样品条带数最少,为15条;丙酮酸钠诱导7d的样品条带数最多,为25条,各样品条带丰富度差异较大(表1).碳源诱导后乌梁素海水样菌群多样性变化趋势与丰富度的变化趋势类似,其中7~14d诱导过程中,丙酮酸钠诱导后水体总细菌Shannon-Wiener指数从3.037升至3.324,提高了约10%,在3种碳源中提高幅度最大;其次为葡萄糖,从3.160升至3.359,提高约8%.不同时期对照样品的均匀度指数(EH)均较高,在添加碳源后各样品均匀度指数相比对照均略有下降,但在21d时恢复至0.91~0.96(表1).
a b

图2 水体样品中细菌16S rDNA基因(a)和pufM基因(b)DGGE图谱(图谱上端字母和数字为样品编号:N代表未添加任何碳源;B、G和Y分别代表添加丙酮酸钠、葡萄糖和酵母提取物;数字代表相应取样时的培养天数;条带1~12为切胶回收条带)Fig.2 DGGE profile of bacterial 16S rDNA(a) and pufM(b) in water samples(The symbols on the top: N represents nothing added; B, G and Y indicate the addition of sodium pyruvate, glucose and yeast extracts, respectively; the numbers show the culture days when sampling; Bands 1-12 indicate the excised bands)
表1 细菌16S rDNA基因和pufM基因丰富度、多样性指数及均匀度指数分析
Tab.1 Diversity analysis of samples estimated by 16S rDNA-DGGE and pufM-DGGE bands patterns

样品16S rDNApufMRH'EHRH'EHN0213.0630.99182.1830.893N7193.0300.99582.0540.879B7253.0370.99771.8430.883G7223.1600.99861.8780.865Y7213.0870.997102.1720.875N14183.3220.99792.1160.866B14183.3240.998152.6150.903G14163.3590.99892.2870.880Y14193.4590.99851.8750.863N21193.4820.99672.1160.864B21203.1180.99882.0150.887G21153.0160.99762.0870.875Y21183.1480.99881.9870.856
pufM基因的DGGE图谱(图2b)表明,各样品条带数从5到15条不等,丰富度变化较大. 其中丙酮酸钠诱导14 d后样品条带数最多,与16S rDNA-DGGE的分析结果相似. 各样品细菌多样性指数及均匀度指数均发生不同程度的变化(表1). 对照样品的好氧不产氧光合细菌(aerobic anoxygenic phototrophic bacteria, AAPB)群落的Shannon-Wiener指数在0~21d培养过程中变化不大,而添加丙酮酸钠及葡萄糖诱导样品在培养7~21d过程中均呈现先升后降的趋势,但酵母提取物诱导样品则表现出先降后升的趋势. AAPB群落丰富度指数与Shannon-Wiener指数变化规律一致.各样品的均匀度指数差别均不大,丙酮酸钠诱导14d的样品群落均匀度指数达0.903,为各样品中的最高值.
2.2 条带测序及系统发育分析
分别选取16S rDNA和pufM的PCR-DGGE指纹图谱中差异条带进行切胶回收、测序,最后共得到12条16S rDNA和13条pufM序列.系统发育分析结果(图3A)表明,16S-band 1出现在N、Y7、G7、N14、N21、B21、Y21等样品中,与Paracoccusmarinus相近,该菌是一类分离自海洋环境,具有产糖能力的好氧细菌[15].在诱导过程中,该条带在G7、Y7时变弱,而后在G14、Y14时消失,但至21d时,该条带又再度出现,且亮度较原始对照样品有所提升.16S-band 4从原始样品至7d诱导过程中始终存在,与耐盐菌Halobacillustrueperi相近,推测与乌梁素海水体的轻微盐碱性有关.16S-band 6序列与从石油污染海区分离到的Thalassospiraxianhensis相似,据报道该菌属有着降解多环芳烃的能力[6].16S-band 9、10是在诱导至14d时亮度提升的条带,并在各种碳源诱导的样品中均有所出现,经比对发现16S-band 9与Geobacillusstearothermophilus有着99%的同源性,该菌有着降解污染物,利用糖类的能力,推测该条带的变化与相关碳源处理有着密切关系.16S-band 11在N、N7、B14、G14、Y14、B21、Y21这7个样品中均有出现,条带亮度在处理过程中其丰富度随诱导时间的延长略有提升. 比对后发现该条带与Pseudoalteromonassp.有99%的相似性,该菌分离自海洋环境,具有产胞内抗菌素的能力.16S-band 5除G7和Y14外的其他样品中均存在,与UnculturedFlavobacterialesbacterium的相似性为99%,该菌为常见的水生类群.其余的4条带(16S-band 2、3、9、12)与不可培养菌序列相似,比对发现均来自湖泊湾口等水体环境.系统发育树(图3A)显示16S rDNA序列在系统发育树上全部属于蛋白菌门(Proteobacteria).分属于其下所包含的4个亚类群,分别是Alphaproteobacteria、Betaproteobacteria、Gammaproteobacteria、Deltaproteobacteria. 可知Proteobacteria始终为乌梁素海水体中的优势类群.
pufM基因系统发育分析结果(图3B和C)表明,13条pufM序列分属于Alphaproteobacteria及Gammaproteobacteria两大类群. 条带puf-band 1在Y7、G14、G21、Y21均有出现,与Porphyrobactertepidarius有93%的相似性,据报道该菌属从热泉及海洋中均曾分离得到,具有耐热性,能够以葡萄糖和酵母提取物作为能量来源[16].puf-band 2在G7、G14、N21中均有所发现,其序列与自波罗的海分离得到,具有较强产叶绿素能力的Erythromicrobiumsp.的相似性为91%[9].puf-band 8从原始样品至7 d诱导过程中始终存在且条带亮度基本不变,至14 d诱导时仅在对照及丙酮酸钠诱导样品中出现,之后至21 d时则完全消失;puf-band 10作为原始至7 d诱导样品的优势条带,至14 d时仅Y14样品条带亮度较弱,其余变化不大,至21 d时则仅在对照样品中发现;puf-band 8、10序列均归属于Rhodobacter,分别与Rhodobactermegalophilus(96%)和Rhodobacterazotoformans(83%)相似.puf-band 12仅在N、N7、B14中出现,与Allochromatiumsp.相近(92%).puf-band 4、7均与海洋中的不可培养种最相似,puf-band 5与Uncultured WHP231 bacterium clone序列最相似.
相比其他淡水湖的研究[17],本研究中发现乌梁素海水体AAPB中Alphaproteobacteria所占比例较高,特别是在丙酮酸钠及葡萄糖诱导处理后,出现的puf-band 1、2、8、10等条带均归类于Alphaproteobacteria. 而在丙酮酸钠诱导处理14 d后出现的puf-band 12,则归类于淡水中罕见的Gammaproteobacteria.值得注意的是,puf-band 3、4、6、9在进化树上不能与其它序列聚在一起(图3C),且均与海洋中不可培养菌的序列相近,推测可能是乌梁素海水体中特有的AAPB菌种.
3 讨论
3.1 碳源诱导后细菌群落结构变化
Baines等[18]曾提出水体环境中的可溶碳在与环境中的微生物作用后将会对水生生态系统及菌群结构造成影响.本研究发现,在提升可溶碳浓度后细菌多样性和丰富度能够有所提升,这与Tranvik[19]对不同可溶碳浓度的淡水湖泊内细菌丰富度的比较研究相一致.葡萄糖诱导后水体菌群丰富度提升幅度很小,可能是由于相对3碳分子化合物丙酮酸钠而言,等重量6碳分子化合物葡萄糖的碳含量更高,可能并不能对整个细菌群落丰富度起到预期的提升效果.Imazaki等[20]曾提出,运用以丙酮酸钠为主碳源的培养基能够提高淡水湖中细菌的可培养效率,这与本研究结果相一致.16S rDNA系统进化分析表明,在碳源诱导后出现了Thalassospiraxianhensis、Geobacillusstearothermophilus、Pseudoalteromonassp.等类群,其中Pseudoalteromonassp.仅在丙酮酸钠诱导样品中出现,而归属于Alphaproteobacteria类群包括Thalassospiraxianhensis和Paracoccusmarinus等菌属则仅在酵母提取物诱导样品中出现,推测酵母提取物能够提升乌梁素海水体中的Alphaproteobacteria类群的丰富度.
3.2 碳源诱导对AAPB群落的影响
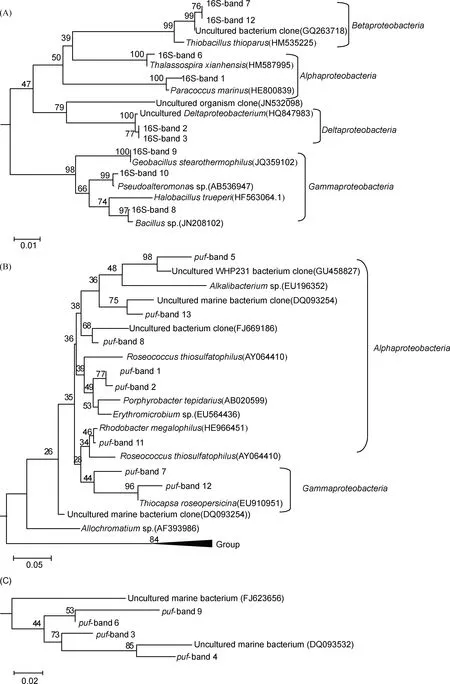
图3 16S rDNA基因(A)和pufM基因(B)序列系统发育树,pufM基因簇Group(C)Fig.3 Phylogenetic tree based on 16S rDNA gene(A) and pufM sequences(B) from DGGE bands, and the special group of pufM sequences(C)
基于pufM-DGGE图谱分析后发现,丙酮酸钠和葡萄糖2种碳源诱导后AAPB菌群的丰富度及多样性指数均呈现了先升后降的趋势.丙酮酸钠诱导后AAPB群落变化与细菌群落相似,丰富度提升了近1倍,多样性指数也提高了约15%.葡萄糖添加诱导后丰富度提升50%,多样性指数提升约8%.酵母提取物添加后样品的群落多样性变化趋势则有所不同,丰富度下降约40%,体现了与另外2种碳源诱导后样品相反的变化趋势.究其原因,可能是其中复杂的组分所致.相比丙酮酸钠及葡萄糖这2种碳源,酵母提取物含有氨基酸、肽、核苷酸、维生素等物质,其所包含营养成分更为复杂.然而好氧不产氧光合细菌通常难以适应高营养的培养条件,它们更偏好于在低营养条件下进行有效的复制[5],例如最早分离的SAR11等类群.因此酵母提取物可能对于偏好寡营养环境的AAPB而言促生作用并不显著.21 d时各样品的丰富度差别很小,可能水体菌群结构已经初步达到了稳态.pufM基因的系统进化树(图3B)显示,得到的优势条带序列分属Alphaproteobacteria及Gammaproteobacteria.据报道Alphaproteobacteria及Gammaproteobacteria在海区水体中所占比例较高,淡水环境中很少能检测到[21-22];但本研究中,在碳源诱导后出现了Porphyrobactertepidarius和Rhodobactermegalophilus等菌属,使Alphaproteobacteria的比例非常高(约65%);此外,有2条序列(puf-band 7、12)与Thiocapsaroseopersicina相近,其中puf-band 12仅在丙酮酸钠诱导样品中检测到,并且成为了优势类群,因此使得Gammaproteobacteria的比例达到30%.比较3种碳源诱导样品,发现Porphyrobactertepidarius,Uncultured WHP231 bacterium clone等为丙酮酸钠诱导样品中独有的类群;Rhodobactermegalophilus和从西藏盐湖中所得的Uncultured bacterium clone(FJ669186)仅在酵母提取物诱导后样品中发现;来自海洋的Unculturedmarine bacterium(FJ623656)则仅在葡萄糖诱导后样品中发现.究其原因,一方面可能是由于乌梁素海地处河套土壤盐碱化严重的地区,并且该湖水循环少、蒸发量大,使得湖水盐碱性增加,从而出现了部分仅在高盐环境中发现的类群;另一方面,则推测是碳源诱导后水体可溶碳与AAPB发生了互作,水环境中的可溶碳能够作为光能源外的营养来源去满足其生存需求,因此当可溶性碳的电子供体进行呼吸作用时,部分类群AAPB的活性可能会有所变化[5],致使参与碳循环的AAPB各类群比重发生了变化.与之前针对乌梁素海水体AAPB的研究相比[2],本实验并未发现此前比例较高的Betaproteobacteria.一方面可能是由于DGGE技术仍具有一定局限性,不能完全检测到环境中的细菌类群;另一方面,推测是水体环境中可溶碳浓度的突然升高使得Betaproteobacteria难以耐受,从而导致丰富度下降.
总之,3种碳源能够使得淡水环境中细菌群落结构发生较大变化,特别是能使一些AAPB的功能类群丰度增加,表明碳源种类及环境中碳素水平与AAPB直接相关,而丙酮酸钠作为本研究证实的具有良好诱导效果的碳源,其与AAPB互作机理等尚待进一步研究.
[1] Waidner LA, Kirchman DL. Aerobic anoxygenic phototrophic bacteria attached to particles in turbid maters of the Delaware and Chesapeake estuaries.ApplEnvironMicrobiol, 2007,73(12): 3936-3944.
[2] 何一平, 曾永辉, 袁 博等. 基于pufM基因的乌梁素海富营养化湖区好氧不产氧光合细菌系统发育多样性分析. 微生物学通报, 2010,37(8): 1138-1145.
[3] Yurkov VV, Cstonyi JT. New light on aerobic anoxygenic phototrophs. In: Hunter N ed. The purple phototrophic bacteria. New York: Springer, 2009,28: 31-55.
[4] Shi LM, Cai YF, Chen ZTetal. Diversity and abundance of aerobic anoxygenic phototrophic bacteria in two cyanobacterial bloom-forming lakes in China.IntJLim, 2010,46: 233-239.
[5] 张 瑶.海洋典型功能细菌群的生态过程研究[学位论文].厦门:厦门大学,2006.
[6] Zhao BS, Wang H, Li RRetal.Thalassospiraxianhensissp. nov., a polycyclic aromatic hydrocarbon-degradingmarine bacterium.IntJSystEvolMicrobiol, 2010,60(5): 1125-1129.
[7] 李畅游,刘廷玺,高瑞忠等.乌梁素海富营养化主控因子年季节变化分析及综合评价.水文,2004,24(3):14-17.
[8] 孙鑫鑫,刘惠荣,冯福应等.乌梁素海富营养化湖区浮游细菌多样性及系统发育分析.生物多样性,2009,17(5):490-498.
[9] Yurkov VV, Stackbrandet E, Holmes Aetal. Phylogenetic positions of novel aerobic, bacteriochlorophylla-containing bacteria and description ofRoseococcusthiosulfatophilusgen. nov., sp. nov.,Erythromicrobiumramosumgen. nov., sp. nov., andErythrobacterlitoralissp. nov.IntJSystEvolMicrobiol, 1994,44(3): 427-434.
[10] Zeng YH, Feng FY, Liu YPetal. Genome sequences and photosynthesis gene cluster composition of a freshwater aerobic anoxygenic phototroph,Sandarakinorhabdussp. strain AAP62, isolated from the Shahu Lake in Ningxia, China.GenomeAnnounc, 2013,1(1): e00034-13.
[11] Boström KH, Simu K, Hagström Aetal. Optimization of DNA extraction for quantitativemarine bacterioplankton community analysis.Limnol&Oceanogr:Methods, 1998,2: 365-373.
[12] Yutin N, Béjà O, Suzuki MTetal. The use of denaturing gradient gel electrophoresis with fully degeneratepufMprimers tomonitor aerobic anoxygenic phototrophic assemblages.Limnol&Oceanogr, 2008,6: 427-440.
[13] Tamura K, Dudley J, Nei Metal. MEGA5: Molecular evolutionary genetics analysis usingmaximum likelihood, evolutionary distance, and maximum parsimony methods.MolecularBiologyandEvolution, 2011,28(10): 2731-2739.
[14] 刘慧杰,杨彩云,田 蕴等.基于PCR-DGGE技术的红树区微生物群落结构.微生物学报,2010,50(7):923-930.
[15] Khan ST, Takaichi S, Harayama S.Paracoccusmarinussp. nov., an adonixanthin diglucoside-producing bacterium isolated from coastal seawater in Tokyo Bay.IntJSystEvolMicrobiol, 2008,58(2): 383-386.
[17] 张晓晶,李畅游,贾克力等.乌梁素海水体透明度分布及影响因子相关分析.湖泊科学,2009,21(6):879-884.
[18] Baines BS, Pace LB. The production of dissolved organic matter by phytoplankton and its importance to bacteria: patterns acrossmarine and freshwater systems.Limnol&Oceanogr, 1991,36(6): 1078-1090.
[19] Tranvik JL. Availability of dissolved organic carbon for planktonic bacteria in oligotrophic lakes of differinghumic content.Limnol&Oceanogr, 1988,16: 311-322.
[20] Imazaki I, Kobori Y. Improving the culturability of freshwater bacteria using FW70, a low-nutrient solidmedium amended with sodium pyruvate.CanJMicrobio, 2010,56: 333-341.
[21] Hanada S, Kawase Y, Hiraishi Aetal. Abundance, depth distribution, and composition of aerobic bacterio chlorophyll a-producing bacteria in four basins of the central Baltic Sea.ApplEnvironMicrobiol, 2008,74(14): 4398-4404.
[22] Jiang HC, Dong HL, Yu BSetal. Abundance and diversity of aerobic anoxygenic phototrophic bacteria in saline lakes on the Tibetan plateau.FEMSMicrobiolEcol, 2009,67(2): 268-278.
