光照对海菜花(Ottelia acuminata)种子萌发、幼苗生长及生理的影响*
2014-08-28赵素婷厉恩华学雷
赵素婷,厉恩华, , ,学雷,
(1:中国科学院测量与地球物理研究所环境与灾害监测评估湖北省重点实验室,武汉 430077) (2:中国科学院大学,北京 100049)
光照是影响种子萌发和幼苗生长发育与存活的重要生态因子,不同植物的种子在不同光照下的萌发行为和幼苗生长状况存在较大差异[1].沉水植物繁殖体的萌发过程是在水中完成的,因此湖泊水体中的光照等条件直接影响它们的萌发过程.沉水植物适应水体的弱光环境,光补偿点很低,但当光照低于其补偿点时,将影响沉水植物的生长发育和生理生态特性[2].在湖泊富营养化过程中,浮游植物引起水体透明度下降,导致水下光照不足,是限制沉水植物生存的主要因素之一.有研究表明,湖泊富营养化导致的水下光照不足可能是沉水植物退化、消亡的重要原因[3].
海菜花(Otteliaacuminata)为水鳖科(Hydrocharitaceae)多年生沉水植物,是中国特有种,国家二级保护植物,主要分布于云贵高原、两广和海南等地,生长在海拔2700m以下的湖泊、池塘、沟渠和深水田中,可分泌化感物质抑制藻类生长,对水体有很强的净化作用,有积极的环境保护功能[4].1960s,滇池的海菜花还非常繁盛,但到1980s,海菜花几乎完全消失,关于滇池海菜花灭绝的原因说法不一[5],对于光照是否为滇池海菜花消失的关键因素尚待研究.国内外对海菜花的研究较少,且主要集中在海菜花分类学研究上[6-8],目前尚无关于海菜花生理特性的研究.本文通过光照对海菜花种子萌发和幼苗生长发育的影响研究,揭示不同光照条件下海菜花的生理特点,探讨滇池海菜花退化消失的原因,以期为海菜花恢复提供理论指导和数据支撑.
1 材料与方法
1.1 实验材料
供试基质为滇池外海底泥,其有机质含量为8.5%(550℃烧失量法)[9],全氮为1.1g/kg,全磷为0.6g/kg(过硫酸盐消化法)[10].海菜花种子来源于武汉植物园水生植物生物学实验室,海菜花幼苗采自云南省晋宁县昆阳镇北山湾的人工池塘.
1.2 研究方法
表1 光照对海菜花种子萌发的影响*
Tab.1 The effect of light intensity on seeds germination of O. acuminata

实验组处理光照/lx遮光率/%种子萌发率/%CK不遮光1500015.6±2.3L1一层纱布105029.810.4±2.6L2一层遮阳网45068.615.6±1.3L3两层遮阳网15090.817.6±3.2L4铝箔纸010017.6±2.6
* 实验结果为平均值±标准误(下同).1.2.1 种子萌发 在25个直径为7.5cm的培养皿中加入5mm深的蒸馏水及海菜花种子(50粒/培养皿).实验共设置4个遮光处理组(L1~L4),一个对照组(CK)(表1),每组设置5个重复.光照培养箱中培养条件设定为白天温度:25±1℃,夜晚温度:20±1℃,光暗周期为12h∶12h,平均光照为1500 lx[11].实验过程中及时补充蒸馏水,保持培养皿内的水深为5mm.每天观察1次种子发芽情况,统计种子发芽数,计算萌发率.连续5d没有种子萌发为发芽结束标志[12].实验于2012年3月26日开始,为期29d.
1.2.2 幼苗生长 分别在12个约160L的大塑料桶(高80cm,上口直径60cm,下底直径40cm)中加入30kg(在塑料桶中高大约为15cm)风干磨碎的底泥,编号后随机摆放在中国科学院水生生物研究所滇池野外工作站的院子里.先往大塑料桶中加入30cm深的自来水,静置3d后,种植长势基本一致、生长旺盛、修剪至1~2个叶片的海菜花幼苗(3株/桶),种植深度大约为5cm.恢复生长7d后,再往大塑料桶中加入30cm深的自来水.实验设置3个遮光处理组(SH1~SH3),一个对照组(CK)(表2),每组设置3个重复,用ZDS-10W-2D型照度计测定水下离泥面5cm处的光照强度.每隔25d,每桶随机选择5个发育成熟的叶片测定长和宽,1个发育成熟的叶片测定生理指标:叶绿素a(Chl.a)含量(95%乙醇-丙酮提取法)[13]和过氧化物酶(POD)活性(愈创木酚法)[14],实验结束时测定其株高和总生物量(鲜重).实验于2012年4月25日开始,为期136d.
表2 光照对海菜花幼苗生长及生理影响研究实验设计
Tab.2 Design of the studies on the influence of light intensity on the seedlings growth and physiology of O. acuminata

实验组处理表层光照/lx遮光率/%CK不遮光718140SH1一层遮阳网2020571.8SH2两层遮阳网609191.5SH3三层遮阳网171697.6
1.3 数据处理方法
采用单因素方差分析(One-way ANOVA)检验海菜花种子萌发率、株高和生物量的差异显著性,采用重复测量方差分析(Repeated Measures ANOVA)检验海菜花叶片长与宽、Chl.a含量及POD活性的差异显著性,采用Pearson相关分析方法检验光照和海菜花种子萌发率之间的关系,采用最小显著差异法(LSD)进行样本的均数比较,显著性水平设为0.05.统计检验通过SPSS 18.0实现.
2 结果与分析
2.1 光照对海菜花种子萌发的影响
光照为1500、1050、450、150、0 lx条件下,海菜花种子萌发率分别为15.6%±2.3%、10.4%±2.6%、15.6%±1.3%、17.6%±3.2%和17.6%±2.6%(表1).不同光照条件下海菜花种子萌发率差异不显著(P=0.27, One-way ANOVA),海菜花种子萌发率与光照强度呈负相关(相关系数为-0.59),但相关性不显著(P=0.29,Pearson相关分析),可能因为其萌发过程对光强变化不敏感,从而说明富营养化导致的低光照度可能不会影响海菜花种子的萌发,因而滇池海菜花的消失可能不是由光照强度低影响了其种子萌发造成的.有研究表明,自然条件下很多沉水植物种子萌发率都较低[11,15],本实验海菜花种子最高萌发率也仅为17.6%,与已有研究结果一致.
2.2 光照对海菜花生长的影响
2.2.1 光照对海菜花叶片大小的影响 沉水植物在水体中获取光和营养的能力与叶片大小直接相关,所以叶片长和宽可以反映植物的营养和生长状况[16].海菜花幼苗初始叶片平均长为19.1±0.3cm,平均宽为10.7±0.3cm,实验过程中CK、SH1、SH2和SH3组海菜花平均叶长分别为18.8±0.4、22.4±0.7、22.0±0.7和16.9±0.5cm,平均叶宽分别为11.2±0.4、12.6±0.5、12.1±0.3和8.5±0.4cm,SH1和SH2组海菜花叶片较肥大,CK组次之,SH3组最小(图1).统计表明光照对海菜花叶片大小影响显著(P<0.05),其中SH1和SH2组海菜花叶片长和宽显著高于CK组,CK组显著高于SH3组,SH1组略高于SH2组,但差异不显著.CK组海菜花叶片在实验前期略有减小,说明海菜花受到了强光胁迫作用;后期变大可能是因为7、8月份昆明阴雨天较多,由于云的遮挡,光照适当降低,促进了海菜花叶片的生长;海菜花的花果期为5-10月,实验结束时海菜花已过了最旺生长期,所以叶片变小.实验前期SH1和SH2组海菜花叶片增大,长势良好,后期叶片略有减小,是因为海菜花已过了最旺生长期,有开始衰败的趋势.实验过程中SH3组海菜花受弱光影响,叶片短而窄.

图1 光照对海菜花叶片长和宽的影响(标注不同小写字母表示差异显著,P<0.05)Fig.1 The influence of light intensity on leaf blades length and width of O. acuminata
2.2.2 光照对海菜花株高的影响 株高是幼苗生长的重要形态学指标[17].海菜花幼苗初始平均株高为52.6±0.6cm,实验结束时CK、SH1、SH2和SH3组海菜花平均株高分别为93.1±4.6、125.6±5.1、124.7±3.7和109.3±4.6cm(表3),分别为初始株高的176.7%、238.4%、236.7%和207.5%.统计表明光照对海菜花株高影响显著(P<0.05),其中SH1和SH2组海菜花株高显著高于CK组和SH3组,SH3组显著高于CK组,SH1组略高于SH2组,但差异不显著(P>0.05).弱光条件下海菜花株高比强光下高,这是海菜花对弱光环境条件适应的结果.
表3 光照对海菜花的株高和生物量的影响*
Tab.3 The influence of light intensity on the plant height and fresh weight of O. acuminata

生长指标CKSH1SH2SH3株高/cm93.1±4.6a125.6±5.1b124.7±3.7b109.3±4.6c总生物量/g87.8±10.8a100.7±8.5a91.1±8.3a52.3±5.6b
*标注不同小写字母表示差异显著,P<0.05.
2.2.3 光照对海菜花生物量的影响 生物量是植物生长主要的参数之一,植物生长的好坏可以通过生物量的变化直接表现出来[18].海菜花的初始平均鲜重为18.2±0.7g,实验结束时CK、SH1、SH2和SH3组海菜花平均鲜重分别为87.8±10.8、100.7±8.5、91.1±8.3和52.3±5.6g(表3),分别为初始鲜重的482.4%、553.3%、500.5%和287.4%.统计表明不同处理间其生物量差异显著(P<0.05),其中SH1和SH2组海菜花平均鲜重均显著高于SH3组,虽然SH3组海菜花株高高于CK组,但其叶片短而窄,茎细而长,生物量显著低于CK组,表明此条件下海菜花生长受到了弱光胁迫.
2.3 光照对海菜花生理特性的影响
2.3.1 光照对海菜花叶片叶绿素a含量的影响 叶绿素含量与植物光合作用有关,是反映叶片光合能力的一个重要指标,叶片叶绿素含量的变化可以作为衡量植物遭受逆境胁迫伤害程度的指标[19].海菜花叶片初始Chl.a含量为0.51±0.01mg/g,实验过程中CK、SH1、SH2和SH3组海菜花叶片平均Chl.a含量分别为0.86±0.07、1.15±0.10、0.97±0.12和0.70±0.15mg/g(图2a).统计表明,实验第35~110d(5月29日-8月12日)光照对海菜花叶片Chl.a含量影响显著(P<0.05),其中SH1组海菜花叶片Chl.a含量显著高于CK组和SH3组,SH2组显著高于SH3组.不同处理组海菜花Chl.a含量高低表现为SH1>SH2>CK>SH3,说明适度的遮荫可以提高叶片叶绿素a含量,过强及过弱的光照均不利于叶绿素a的合成.实验后期SH1和SH2组海菜花叶片Chl.a含量下降,CK组上升,可能与昆明7、8月份多阴雨天气,自然光照强度变低有关.实验后期,SH3组海菜花叶片发黄,叶绿素a含量低.
2.3.2 光照对海菜花叶片过氧化物酶活性的影响 过氧化物酶(POD)是植物抗氧化防御系统的主要保护酶之一,植物在受到环境胁迫或衰老时,POD活性升高以去除膜系统活性氧,保护质膜免受破坏[20].统计表明光照对海菜花叶片POD活性影响不显著(P>0.05).海菜花幼苗叶片初始POD活性为613.45±48.24U,实验过程中CK、SH1、SH2和SH3组海菜花叶片平均POD活性分别为2697.67±396.39、4228.08±738.21、3954.57±703.32和3566.61±864.25U(图2b).植物体内POD活性升高可增加植物的抗逆性[21],实验前期SH1组和SH2组海菜花叶片POD活性升高以去除膜系统产生的活性氧,增加植物抗逆性;后期变化不大,可能是因为海菜花已经适应了这2种光照条件.CK组海菜花叶片POD活性先升高后降低,升高可能是由于受强光胁迫作用,降低可能与强光下海菜花叶片部分腐烂有关,分析认为此时海菜花保护酶系统已经被破坏,生理代谢紊乱.SH3组海菜花叶片POD活性持续升高,表明海菜花受到低光胁迫作用,这与海菜花生长指标的结果一致.
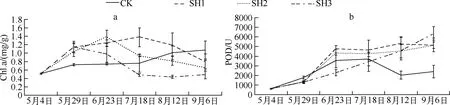
图2 光照对海菜花叶片叶绿素a含量(a)及POD活性(b)的影响Fig.2 The influence of light intensity on the concentration of Chl.a(a) and activity of POD(b) in leaves of O. acuminata
3 讨论
3.1 光照对海菜花种子萌发的影响
本研究表明,0~1500 lx范围内光照对海菜花种子萌发影响不显著,虽然种子萌发率与光照强度存在一定的负相关,但相关性不显著,说明其萌发过程对光强变化不敏感,那么富营养化导致的低光照可能不会影响海菜花种子萌发.有研究表明,苦草的种子在有光条件下萌发率较高[22],而光照对篦齿眼子菜种子萌发影响不显著[23],可见不同植物种子萌发对光照有不同需求.
3.2 光照对海菜花生长的影响
有研究表明,过低的光照条件导致苦草生长发育停滞[24-25],水体透明度过低导致滇池沉水植物多样性消失[26].本研究发现,海菜花在71.8%和91.5%遮光条件下生长状况良好,其平均叶片长度、叶片宽度和株高均显著高于无遮光和97.6%遮光条件下的平均叶片长度、叶片宽度和株高,平均生物量显著高于无遮光条件下的平均生物量.
1950s-1960s,滇池海菜花主要分布在东岸2m以上的深水处和水体透明度见底(2~4m)的草海西部和中部;1970s滇池的海菜花已经寥寥无几了;1980s,滇池草海水体透明度仅0.2~0.4m,海菜花几乎完全灭绝[5,27].滇池由于重度富营养化,浮游植物浓度高,透明度低,水下光照强度低,实验同期实测滇池草海西海岸湖滨湿地建设示范工程区平均水体透明度为0.4m,水体底层日平均光照强度为15 lx.本研究表明97.6%遮光(底层日平均光照强度为63 lx)条件下海菜花的生长已受到了显著的抑制,因此分析认为光照不足影响了海菜花的生长发育,进而可能导致了滇池海菜花的消失.只有当水体底层光照强度大于光补偿点时沉水植物才能生存[28],许多沉水植物的光补偿点范围约为表面光照的0.5%~3.0%[29],光补偿深度是恢复沉水植被的关键参数之一,与透明度呈显著正相关[26],要在滇池恢复海菜花,必须将水体透明度提高到一定程度,使光补偿深度增加.滇池草海西海岸湖滨湿地建设示范工程区平均水深为2m左右,为保证海菜花生长不受光照条件的限制,要在此区域恢复海菜花,水体透明度至少达0.6m.
3.3 海菜花对光照的生理响应
适度弱光下植物可通过合成较多的叶绿素等途径适应环境条件,但当弱光胁迫严重时,会损坏植物的PSⅠ和PSⅡ,甚至造成不可逆的伤害,叶绿素含量低[24].另外大多数沉水植物都表现出强光抑制现象,强光条件不利于叶绿素合成.本研究发现,实验中期71.8%遮光条件下海菜花叶片Chl.a含量显著高于无遮光和97.6%遮光条件下其含量,说明71.8%遮光条件下的海菜花通过增大叶绿素的含量适应该条件下相对的弱光环境[30],且此光照条件下海菜花成熟的叶片大而肥,并集中在水面表层以获得对光的生理需要.
光照对海菜花叶片POD活性影响不显著.在71.8%和91.5%遮光条件下POD酶被激活,活性升高以除去膜系统产生的活性氧,进而使海菜花适应这两种光照条件.在无遮光条件下海菜花叶片POD活性先升高后降低,是强光抑制海菜花生理特性的体现,这与苦草和黑藻对光照逆境胁迫的生理反应一致[31-32].在97.6%遮光条件下海菜花叶片POD活性一直处于上升状态,表明低光对海菜花生长造成了胁迫,与该光照条件下海菜花叶片窄而短、茎细而长、生物量低等生长特征的实验结果一致.
4 结论
1) 0~1500 lx范围内光照对海菜花种子萌发影响不显著,虽然种子萌发率与光照强度存在一定的负相关,但相关性不显著.
2) 海菜花在71.8%和91.5%遮光条件下生长状况良好,其平均叶片长度、叶片宽度和株高均显著高于无遮光和97.6%遮光条件下的平均叶片长度、叶片宽度和株高,平均生物量显著高于无遮光条件下的平均生物量.
3) 实验中期71.8%遮光条件下海菜花叶片叶绿素a含量显著高于无遮光和97.6%遮光条件下含量;光照对海菜花叶片过氧化物酶活性影响不显著.
致谢:中国科学院武汉植物园李伟老师和尹黎燕老师在实验设计中给予了指导,中国科学院水生生物研究所吴华东、杨凯、吴艳龙等同学在实验过程中提供了大量帮助,在此一并表示感谢.
[1] Poorter L. Light-dependent changes in biomass allocation and their importance for growth of rain forest tree species.FunctionalEcology, 2001,15(1):113-123.
[2] Kondo K, Kawabata H, Ueda Setal. Distribution of aquatic plants and absorption of radionuclides by plants through the leaf surface in brackish Lake Obuchi, Japan, bordered by nuclear fuel cycle facilities.JournalofRadioanalyticalandNuclearChemistry, 2003,257(2):305-312.
[3] 陈 灿.湖泊沉积物再悬浮对苦草光合机能的影响.环境科学与技术,2010,33(1):6-10.
[4] 王 斌.净化水质的优选物种——海菜花.园林,2011,(8):60-61.
[5] 李 恒.滇池海菜花的盛衰.云南大学学报:自然科学版,1985,7(S1):138-142.
[6] Cook CDK, Symoens JJ, Urmi-König K. A revision of the genusOttelia(Hydrocharicaea) I. Generic considerations.AquaticBotany, 1984,18(3):263-274.
[7] Forbes FB, Hemsley WB. An enumeration of all the plants known from China Proper, Formosa, Hainan, Corea, the Luchu Archipelago, and the island of Hongkong, together with their distribution and synonymy part-XIV.JournaloftheLinneanSocietyofLondon,Botany, 1886,23(151):81-162.
[8] Jiang Z, Li H, Dao Z.Otteliaacuminatavar.songmingensis, a new variety of the Hydrocharitaceae from Yunnan, China.Guihaia, 2005,25(5):424-425.
[9] 钱 宝,刘 凌,肖 潇.土壤有机质测定方法对比分析.河海大学学报:自然科学版,2011,39(1):34-38.
[10] 钱君龙,张连弟,乐美麟.过硫酸盐消化法测定土壤全氮全磷.土壤,1990,(5):258-262.
[11] 张 聪,贺 锋,高小辉等.3种种植方式下沉水植物恢复效果研究.植物研究,2012,32(5):603-608.
[12] 王 玄,袁思安,张建军等.金莲花种子萌发特性研究.中国农学通报,2012,28(7):185-189.
[13] 杨敏文.快速测定植物叶片叶绿素含量方法的探讨.光谱实验室,2002,19(4):478-481.
[14] 王伟玲,王 展,王晶英.植物过氧化物酶活性测定方法优化.实验室研究与探索,2008,5(3):54-57.
[15] Yin L, Wang C, Chen Yetal. Cold stratification, light and high seed density enhance the germination ofOtteliaalismoides.AquaticBotany, 2009,90(1):85-88.
[16] 陈 磊,叶其刚,潘丽珠等.长江中下游湖泊两种混生苦草属植物生活史特征与共存分布格局.植物生态学报,2008,32(1):106-113.
[17] 李 强,王国祥,潘国权等.水体浊度对菹草萌发及萌发苗光合荧光特性的影响.生态学报,2006,26(11):3594-3601.
[18] Génard M, Pagès L, Kervella J. A carbon balance model of peach tree growth and development for studying the pruning response.TreePhysiology, 1998,18(6):351-362.
[19] 高海荣,林 清,陆延婷.有机溶剂胁迫下苦草生理指标的变化.广西师范学院学报:自然科学版,2006,23(4):40-44.
[20] 刘爱荣,张远兵,陈登科.盐胁迫对盐芥(Thellungiellahalophila)生长和抗氧化酶活性的影响.植物研究,2006,26(2):216-221.
[21] Owens M, Learner M, Maris P. Determination of the biomass of aquatic plants using an optical method.TheJournalofEcology, 1967,55(3):671-676.
[22] 陈开宁,兰策介,史龙新等.苦草繁殖生态学研究.植物生态学报,2006,30(3):487-495.
[23] 高 健,熊 勤,李 祝等.溶氧、pH及其他理化因子对蓖齿眼子菜种子萌发的影响.水生生物学报,2006,30(5):524-529.
[24] 谢云成,李 强,王国祥.长期弱光对苦草幼苗生长发育的影响.生态学杂志,2012,31(8):1954-1960.
[25] 肖月娥,陈开宁,戴新宾等.太湖中2种大型沉水被子植物适应低光能力的比较.植物生理学通讯,2006,42(3):421-425.
[26] 任久长,周 红,孙亦彤.滇池光照的垂直分布与沉水植物的光补偿深度.北京大学学报:自然科学版,1997,33(2):76-79.
[27] 戴全裕.云南滇池水生植被的观察与分析.海洋湖沼通报,1986,(2):65-75.
[28] 王韶华,赵德锋,廖日红.关于北京后海水体光照及沉水植物光补偿深度的研究.水处理技术,2006,32(6):31-33.
[29] Van TK, Haller WT, Bowes G. Comparison of the photosynthetic characteristics of three submersed aquatic plants.PlantPhysiology, 1976,58(6):761-768.
[30] 吴振斌,陈德强,邱东茹等.武汉东湖水生植被现状调查及群落演替分析.重庆环境科学,2003,25(8):54-62.
[31] 王素梅.光照和氮、磷的复合作用对苦草生长和生理的影响[学位论文].广州:华南理工大学,2010.
[32] 朱光敏.水体浊度和低光条件对沉水植物生长的影响[学位论文].南京:南京林业大学,2009.
