胃癌相关mir-148a靶向调控胃泌素受体CCKBR
2014-08-14郭水龙朱圣韬王拥军郭庆东孙秀梅张澍田
郭水龙,朱圣韬,李 鹏,3,王拥军,3,王 民,邢 洁,郭庆东,孙秀梅,张澍田,3
(1.首都医科大学附属北京友谊医院,北京 100050;2. 消化疾病癌前病变北京市重点实验室,北京 100050;3.北京市消化疾病中心,北京 100050 )
胃癌是严重危害人类健康的常见恶性肿瘤,名列全球第二大癌症死亡原因[1]。我国是胃癌高发国,每年新发胃癌患者40万人,发病率在所有恶性肿瘤居首位,死亡人数达30万人,约占所有恶性肿瘤死亡人数的25%~30%[2]。胃泌素受体(也称胆囊收缩素B受体,CCKBR)是生长因子胃泌素(Gastrin)的重要受体, 主要分布于在胃体黏膜的壁细胞和ECL细胞。生理上,CCKBR主要通过与Gastrin结合,调节胃液、胃蛋白酶和胆汁的分泌[3]。近年来的研究发现,Gastrin及其受体CCKBR与胃肠道肿瘤尤其是胃癌的发生密切相关,可作为胃癌早期诊断的重要指标,并可能发展成为胃癌治疗的靶位点[4-5]。miR-148a是最早发现,同时也是最重要的胃癌相关microRNA之一,但目前对其在胃癌中的作用机制还不十分明确[6]。本研究从多个方面证实miR-148a可以靶向CCKBR,揭示了二者参与胃癌发生发展的新的功能机制。
1 材料和方法
1.1 材料
真核表达载体pIRES2-EGFP购自BD公司,miR-148a Luciferase报告载体pGL3-CM 由pGL3-control改构。BGC-823和293T细胞由本实验室保存。CCKBR抗体购自Abcom公司,
GAPDH抗体和二抗购自中杉金桥公司。各种限制性内切酶和T4多聚核苷酸激酶购自NEB公司。引物和探针合成自Invitrogen公司。质粒抽提及凝胶回收试剂盒购自QIAGEN公司,转染试剂购自Invitrogen公司,双荧光素酶检测试剂盒购自Promega公司,其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 miR-148a靶向CCKBR的生物信息学预测:使用microRNA在线靶点分析工具TargetScan(www.targetscan.org)分析人CCKBR基因3’UTR,发现3处miR-148a的潜在结合位点,分别位于第334、423和476碱基处(图1)。可以看出,miR-148a与CCKBR之间存在很好的靶向关系。
1.2.2 miR-148a真核表达载体的构建:合成miR-148a上下游引物,序列分别为5′- aaaagatctgaacacac ctgcaggaagaa-3′和5′- aaaaaagcttctggcgtctggagcactg-3′,PCR扩增出164 bp的产物序列。PCR产物经切胶回收和连接,插入pIRES2-EGFP真核表达质粒。挑阳性克隆进行测序鉴定。
1.2.3 miR-148a过表达的Northern Blot检测:miR-148a转染细胞后24 h提取细胞RNA,根据文献描述方法进行Northern Blot检测,上样量为20 μg[7]。 miR-148a探针序列为其完全互补序列,使用T4多聚核苷酸激酶将32P 标记5’末端。
1.2.4 荧光素酶活性检测miR-148a对CCKBR 3’UTR的靶向作用: 使用上下游引物5′-ccgctcgagg gttgaggcagggcaaatgac-3′和5′-ccgacgcgtttgggtaaggaagg agagggc-3′ 扩增人CCKBR的3′UTR,并克隆到 pGL3-CM质粒构建荧光素酶报告载体(野生型)。采用引物5′-ccggaattcattgttttaga gactatggagc-3′和5′-ccggaattccattaatctatgtgtgtgag agg-3′;5′-ccggaattcaaaa taccatcaggcctaatc-3′和5′-ccggaatt ctgattgggaagggtcactgt -3′;5′-ccggaattcaaaaggttcttcatccct ttcc-3′和5′-ccggaattcagaacagcctgttggtcaga-3′分别将CCKBR 3′UTR的 334、423和476三处miR-148a潜在结合位点进行突变,构建荧光素酶报告载体(突变型)。将报告载体与miR-148a过表达载体共转染细胞,48 h后裂解细胞,根据试剂说明书进行检测。检测仪器为LB 960 Centro XS3 luminometer。
1.2.5 Western Blot蛋白检测:使用RIPA裂解细胞提取蛋白并检测蛋白浓度。SDS-PAGE凝胶电泳,上样量为25 ~ 50 μg。半干法转膜,5%脱脂牛奶封闭,一抗(1∶1000)4℃孵育过夜,HRP偶联二抗室温孵育1 h,ECL发光显影。
1.2.6 统计学分析 采用 SPSS 10进行统计分析,数值采用均数±标准差表示,组间数据比较采用t检验,P< 0.05表示差异具有统计学意义。
2 结果
2.1 miR-148a真核表达载体的构建

图1 人CCKBR 3’UTR 上miR-148a结合位点预测
将构建的miR-148a表达载体(IE-148a)进行测序,结果显示 164 bp的扩增产物(miR-148a前体)正确插入载体中,序列与pubmed数据库完全一致。Northern Blot检测miR-148a载体在BGC-823细胞中的表达(图2),与空载体Vector相比,过表达组miR-148a的表达量明显增加,证实构建的载体能够在真核细胞中过表达miR-148a,适合下一步实验使用。
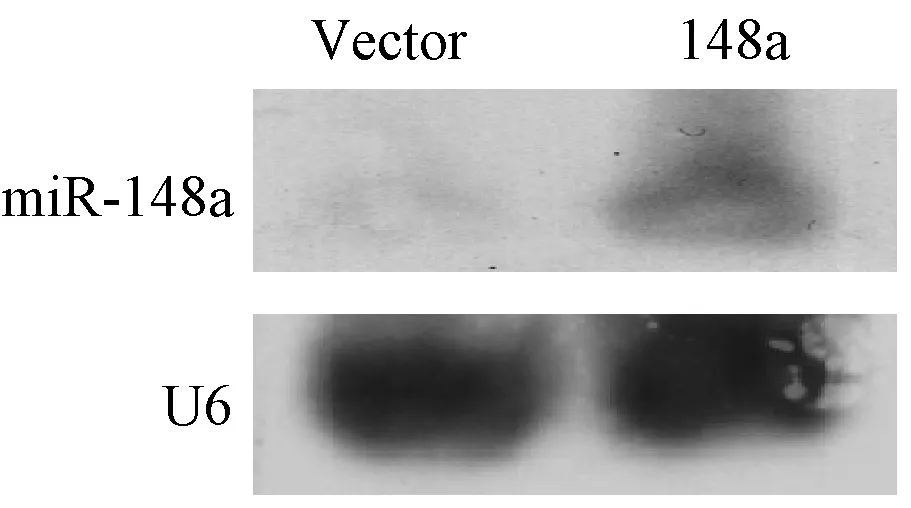
图2 Northern Blot 检测miR-148a真核载体表达
2.2 miR-148a通过与3’UTR 423 bp处的靶位点结合,抑制人CCKBR基因的表达
荧光素酶活性检测结果显示(图3),miR-148a过表达可以明显抑制含CCKBR 3’UTR报告载体的荧光素酶活性,大约为空载体对照组的64%(P< 0.05),表明miR-148a通过结合3’UTR区可抑制CCKBR基因的表达。当分别将三个预测的miR-148a结合位点突变后,3’UTR 423 bp处的突变可显著消除miR-148a过表达导致的荧光素酶活性降低(P> 0.05)。而3’UTR 334 bp和476 bp处的结合位点突变没有此效应(P< 0.05),与野生型报告载体的荧光素酶活性相同。结果表明,miR-148a通过与CCKBR 3’UTR 334 bp处结合,直接抑制该基因的表达。
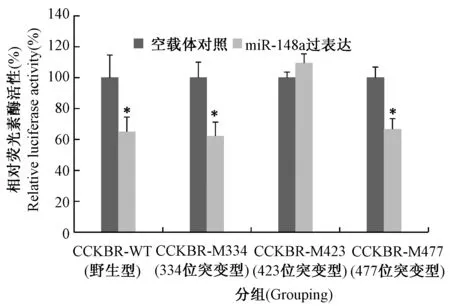
图3 荧光素酶活性分析检测各组报告载体表达(*P < 0.05)
2.3 miR-148a抑制CCKBR蛋白表达
Western Blot结果显示,如图4,与空白对照和空载体Vector相比,miR-148a过表达可显著抑制胃癌细胞BGC-823中CCKBR的蛋白表达。
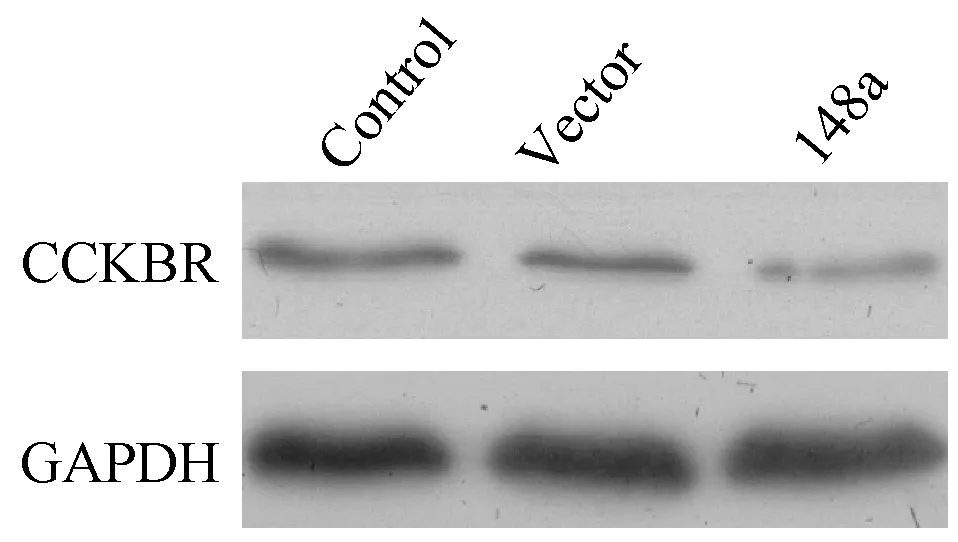
图4 Western Blot检测各组细胞CCKBR蛋白表达
3 讨论
胃泌素主要由分布于胃窦和十二指肠近端的G细胞分泌,通过与受体结合调节胃酸和组胺的分泌来发挥作用。胃泌素在胃中作用的主要靶点是胃体黏膜的壁细胞和肠嗜铬样细胞(ECL)细胞表面分布的受体CCKBR。小鼠胃CCKBR基因敲除导致ECL细胞减少,胃壁变薄[8]。近年来胃泌素及其受体CCKBR在消化道肿瘤及其癌前病变中的作用越来越引起人们重视。研究证实,胃癌患者胃癌组织中CCKBR的含量明显高于对照正常组织,胃泌素及CCKBR广泛参与胃癌发生发展[4,9-10]。Cui等[11]发现高胃泌素血症的日本绵鼠发生胃癌,该胃癌起源于ECL细胞,而CCKBR拮抗剂YF476可阻止高胃泌素引起的胃癌发生[12]。虽然CCKBR在胃癌发展过程中表达逐渐升高,但其异常表达的机制至今不是十分明确。
microRNA (miRNA)是一类22 bp左右的非编码小RNA,通过序列互补与特异mRNA结合,在转录后水平调控靶基因的表达。我们前期的工作和众多研究组研究结果表明,miR-148a在人胃癌组织中表达下调,并通过作用于不同的靶分子调控胃癌细胞的增殖、凋亡、侵袭和转移等[13-17],是重要的胃癌抑制miRNAs之一。我们前期对miR-148a在胃黏膜中的表达定位研究结果显示,miR-148a主要分布于小鼠胃黏膜底部,这一位置主要为壁细胞和ECL细胞等分泌细胞,提示miR-148a可能参与调控胃黏膜的分泌功能[14]。此外,我们前期研究还发现,miR-148a下调是胃癌发生的早期事件,胃癌小鼠模型胃组织中miR-148a在小鼠出生20 d后即观察到50%的下调,60 d后下调约80%[18],这与胃癌发展过程中CCKBR的逐渐上升是同步的,提示二者之间可能存在调控关系。本研究中,我们首先通过信息学预测,在CCKBR中发现了3个miR-148a的结合位点。然后,通过构建的miR-148a真核表达载体并在胃癌细胞中过表达,我们证明miR-148a可直接与CCKBR的3’UTR结合,抑制其基因表达和蛋白翻译。这一发现,为CCKBR表达调控机制和miR-148a在胃癌中的作用机制提供了新的解释。
目前,国内外研究者都在开发新的胃癌早期诊断标志物和药物作用靶点,而胃泌素及其受体和miRNA是其中的两大热点[9,19-21]。本研究的结果为胃癌早期筛查和治疗提供了新的潜在靶分子,并为下一步的临床研究奠定了基础。
参考文献:
[1] Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world[J]. J Clin Oncol, 2006, 24(14): 2137-2150.
[2] Yang L. Incidence and mortality of gastric cancer in China [J]. World J Gastroenterol, 2006, 12(1): 17-20.
[3] Han YM, Park JM, Park SH,etal. Gastrin promotes intestinal polyposis through cholecystokinin-B receptor-mediated proliferative signaling and fostering tumor microenvironment[J]. J Physiol Pharmacol, 2013, 64(4): 429-437.
[4] 黄亚娜,唐世孝. 胃泌素与胃癌关系的研究进展[J]. 西南军医, 2012, (05): 757-760.
[5] 赵蓓,吴岩. 胃泌素与肿瘤发生、发展的关系[J]. 内蒙古医学院学报, 2008, (01): 65-68+72.
[6] Xia J, Guo X, Yan J,etal. The role of miR-148a in gastric cancer[J]. J Cancer Res Clin Oncol, 2014, 1649-1656.
[7] Sun Q, Zhang Y, Yang G,etal. Transforming growth factor-beta-regulated miR-24 promotes skeletal muscle differentiation[J]. Nucleic Acids Res, 2008, 36(8): 2690-2699.
[8] Nagata A, Ito M, Iwata N,etal. G protein-coupled cholecystokinin-B/gastrin receptors are responsible for physiological cell growth of the stomach mucosa in vivo[J]. Proc Natl Acad Sci U S A, 1996, 93(21): 11825-11830.
[9] Dimaline R,Varro A. Novel roles of gastrin[J]. J Physiol, 2014, 592(Pt 14): 2951-2958.
[10]. Rai R, Chandra V, Tewari M,etal. Cholecystokinin and gastrin receptors targeting in gastrointestinal cancer[J]. Surg Oncol, 2012, 21(4): 281-292.
[11] Cui G, Qvigstad G, Falkmer S,etal. Spontaneous ECLomas in cotton rats (Sigmodon hispidus): tumours occurring in hypoacidic/hypergastrinaemic animals with normal parietal cells[J]. Carcinogenesis, 2000, 21(1): 23-27.
[12] Martinsen TC, Kawase S, Hakanson R,etal. Spontaneous ECL cell carcinomas in cotton rats: natural course and prevention by a gastrin receptor antagonist[J]. Carcinogenesis, 2003, 24(12): 1887-1896.
[13] Yan J, Guo X, Xia J,etal. MiR-148a regulates MEG3 in gastric cancer by targeting DNA methyltransferase 1 [J]. Med Oncol, 2014, 31(3): 879-884.
[14] Guo SL, Peng Z, Yang X,etal. miR-148a promoted cell proliferation by targeting p27 in gastric cancer cells [J]. Int J Biol Sci, 2011, 7(5): 567-574.
[15] Zheng B, Liang L, Wang C,etal. MicroRNA-148a suppresses tumor cell invasion and metastasis by downregulating ROCK1 in gastric cancer[J]. Clin Cancer Res, 2011, 17(24): 7574-7583.
[16] Wang SH, Li X, Zhou LS,etal. microRNA-148a suppresses human gastric cancer cell metastasis by reversing epithelial-to-mesenchymal transition[J]. Tumour Biol, 2013, 34(6): 3705-3712.
[17] Sakamoto N, Naito Y, Oue N,etal. MicroRNA-148a is downregulated in gastric cancer, targets MMP7, and indicates tumor invasiveness and poor prognosis[J]. Cancer Sci, 2013, 105(2): 236-243.
[18] Guo SL, Ye H, Teng Y,etal. Akt-p53-miR-365-cyclin D1/cdc25A axis contributes to gastric tumorigenesis induced by PTEN deficiency[J]. Nat Commun, 2013, 4: 2544-2554.
[19] 张玲霞, 庄坤, 张沥, 等. 血清胃泌素-17胃蛋白酶原及幽门螺杆菌Ig-G抗体与萎缩性胃炎及胃癌的关系研究[J]. 检验医学与临床, 2014(8): 1076-1078.
[20] 毛秋卉, 刘文佳, 张学俭, 等. 血清胃蛋白酶原和胃泌素-17在胃癌筛选中的作用[J]. 国际消化病杂志, 2012(2): 85-87.
[21] Tong F, Cao P, Yin Y,etal. MicroRNAs in gastric cancer: from benchtop to bedside[J]. Dig Dis Sci, 2014, 59(1): 24-30.
