乳腺癌根治术后放疗联合胸腺五肽预防放射性肺损伤的临床研究
2014-08-11李春璐杨月琴陈英海邹丽娟
李春璐,曲 怡,杨月琴,陈英海,邹丽娟
(大连医科大学附属第二医院,辽宁 大连 116023)
乳腺癌根治术后放疗联合胸腺五肽预防放射性肺损伤的临床研究
李春璐,曲 怡,杨月琴,陈英海,邹丽娟
(大连医科大学附属第二医院,辽宁 大连 116023)

目的 分析放射性肺损伤发生的相关因素,评价乳腺癌术后放疗联合胸腺五肽预防放射性肺损伤的临床疗效。方法 回顾分析97例乳腺癌根治术后辅助性放疗患者的临床资料,包括年龄、化疗周期数、化疗药物、是否合并糖尿病及慢性阻塞性肺疾病(COPD)等;按治疗方法将患者分为2组,单纯放疗(RT)组32例,放疗联合胸腺五肽(RT+TP-5)组65例,分析2组患者从放疗开始至放疗结束后4~16周的胸部CT影像学变化,比较2组放射性肺损伤的发病率以及相关的影响因素。结果 RT组放射性肺损伤发病率为44%,RT+TP-5组放射性肺损伤发病率为34%,2组比较无显著性差异(P>0.05)。2组各年龄层发病率比较均无显著性差异(P均>0.05)。行≤4周期化疗后放射性肺损伤发病率RT组为16%,TR+TP-5组为23%,2组比较无显著性差异(P>0.05 );行>4周期化疗后放射性肺损伤发病率RT组为85%,TR+TP-5组为47%,2组比较有显著性差异(P<0.05)。2组行≤4周期化疗后放射性肺损伤发病率与>4周期比较均有显著性差异(P均<0.05)。是否合并糖尿病RT组放射性肺损伤发病率分别为45%和43%, TR+TP-5组分别为39%和32%,2组比较均无显著性差异(P均>0.05)。结论 乳腺癌根治术后行辅助放疗的患者全身化疗增加了放射性肺损伤的发病风险,且化疗周期越长,其发病风险越高。化疗方案、是否合并糖尿病与放射性肺损伤的发生无明显相关性。乳腺癌根治术后放疗同时应用TP-5可降低放射性肺损伤发生风险。
乳腺癌根治术后放疗; 放射性肺损伤; 胸腺五肽
乳腺癌是常见的胸部恶性肿瘤,放射治疗是乳腺癌综合治疗的重要手段之一[1]。乳腺癌术后放疗大多采用胸部常规放疗,肺是胸部放疗中主要的剂量限制性器官[2],放射性肺损伤一旦发生往往不可逆转,而且临床治疗效果也不甚理想,严重影响了患者的生存质量[3]。因此预防放射性肺损伤的发生是治疗的关键。胸腺五肽(TP-5)是一种新型的免疫调节剂,能有效地调节机体免疫功能[4]。为证实TP-5可用于预防乳腺癌术后放疗所致的放射性肺损伤的发生,本研究回顾分析我院2008年1月—2011年1月97例乳腺癌根治术后行辅助性放疗患者的临床资料,旨在评价术后放疗联合胸腺五肽预防放射性肺损伤的临床疗效及放射性肺损伤发生的相关因素,现将结果报道如下。
1 临床资料
1.1 一般资料 97例乳腺癌根治术后辅助放疗患者均为女性,均有术后病理支持,年龄30~69岁,平均49岁。其中单纯放疗(RT)组32例,平均年龄47岁;放疗联合TP-5(RT+TP-5)组65例,平均年龄50岁。放疗前均曾行术后全身化疗。所有患者卡氏评分(KPS)≥70 分,具备术后辅助放疗指征。
1.2 治疗方法 所有患者采用直线加速器常规照射,于术后进行放疗。胸壁照射野采用6-9MeV电子线照射,内界为体中线,外界为患侧腋中线,上界与锁骨上野下界共线,下界平对侧乳房褶皱下2~3 cm。患侧锁骨上照射野采用6 MV-X射线照射,内界位于体中线向上沿胸锁乳突肌内缘直达甲状软骨下缘,外界为喙突内缘,上界平甲状软骨下缘,下界平第二前肋。常规分割,单次剂量DT 180~200 cGy,5次/周,总剂量DT 50 Gy/5~6周。RT+TP-5组于放疗开始之日起皮下注射胸腺五肽10 mg/次,2次/周,至放疗结束。
1.3 放射性肺损伤的诊断标准 临床上放射性肺损伤患者症状和体征差异性较大,呈隐匿性进展,多数无明显临床症状和体征,因此不易发现及诊断,而胸部CT诊断放射性肺损伤较为敏感。放射性肺损伤的影像学诊断标准:早期放射性肺炎表现为照射野内散在的小片状磨玻璃影,密度薄淡、边缘模糊、“袖套征”;晚期放射性肺纤维化表现为照射野内长条状、大片状密度增高影,也可出现不按肺叶、肺段分布的肺实变,其内可见有支气管充气征,肺泡囊、小叶间隔增厚,部分边缘整齐,部分边缘呈星状,可超出放疗照射野,边缘锐利呈“刀切状”,同侧胸膜增厚,支气管、肺门、纵隔、横隔牵拉移位等肺容积缩小改变。
1.4 随访评价 放疗前1周、放疗中1个月、放疗结束后4~16周内定期复查胸部CT,以了解肺部有无较前新增的影像学变化。
1.5 统计学方法 采用 SPSS 13.0 统计软件处理资料,计数资料采用检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 放射性肺损伤发生情况 RT组放射性肺损伤发病率为44%,RT+TP-5组为34%,2组比较未见显著性差异(P>0.05)。
2.2 致放射性肺损伤相关因素分析
2.2.1 放射性肺损伤相关因素 主要有年龄、化疗方案、化疗周期数、是否合并糖尿病、慢性阻塞性肺疾病(COPD)及吸烟史。化疗方案、是否合并糖尿病与放射性肺损伤的发生无明显相关性(P均>0.05)。见表1。

表1 2组放射性肺损伤发病相关临床因素比较
2.2.2 2组发病年龄分层情况 RT组40岁以下3例,40~49岁5例,50~59岁5例,60岁以上1例,发病率分别为33%,50%,45%,50%。TR+TP-5组40岁以下5例,40~49岁5例,50~59岁8例,60岁以上4例,发病率分别为36%,29%,36%,33%。2组各年龄层间放射性肺损伤发病率比较均无显著性差异(P均>0.05)。见图1。
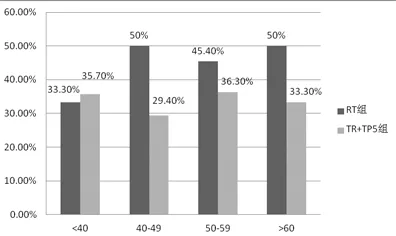
图1 2组放射性肺损伤与年龄层关系
2.2.3 化疗周期 行≤4周期全身化疗后放射性肺损伤发病率RT组为16%,TR+TP-5组为23%,2组比较有显著性差异(2=0.379,P>0.05)。行>4周期全身化疗后放射性肺损伤发病率RT组为85%,TR+TP-5组为47%,2组比较有显著性差异(2=5.367,P<0.05)。
3 讨 论
乳腺癌是女性常见的恶性肿瘤,在英美等国和我国京、津、沪等大城市甚至处于女性癌症发病率的第一位,其总发病数占女性全部恶性肿瘤发病的22.8%,死亡占总癌死亡的14.1%[5-6]。外科治疗是乳腺癌的主要治疗方法,随着对乳腺癌认识的发展和进步,放疗、化疗以及内分泌治疗也成了乳腺癌治疗的重要手段。乳腺癌术后辅助放疗能显著提高局部控制率和生存率,且能降低复发率和病死率[7]。
然而肺脏是胸部肿瘤放射治疗中主要的剂量限制性器官,照射剂量大于20 Gy后即可产生永久性损伤[8],因此放射性肺损伤是胸部肿瘤放射治疗的严重并发症,一旦发生往往不可逆转,且治疗效果欠佳。文献报道,乳腺癌根治术后行辅助放疗所引起放射性肺损伤的发病率较其他胸部肿瘤发病率高,为24.6%~38.2%[9-11]。因此放射性肺损伤的预防工作尤为重要。放射性肺损伤是一个有多重因素共同存在、互相影响、综合调控的复杂过程,具有多元性的特点[12],其中过度表达的细胞因子的致炎作用及其级联放大效应是导致放射性肺纤维化的主要机制。
TP-5是一种人工合成的新型免疫调节剂,具有双向调节机体免疫的作用,使过强或受到抑制的机体免疫功能趋于正常。TP-5可调节T淋巴细胞发育、分化和成熟,同时修复受损的T淋巴细胞,增强巨噬细胞的吞噬功能并调节巨噬细胞分泌水平[13]。从放射性肺损伤的发病机制方面分析,TP-5可抑制受照射后的肺组织过度表达和分泌多种细胞因子,从而有效减轻放疗后肺组织的损伤,达到减轻放射性肺损伤的效果。
本研究回顾性分析了我院97例乳腺癌根治术后行辅助放疗患者的临床资料,发现RT+TP-5组放射性损伤的发病率较RT组更低,说明TP-5能够降低乳癌术后辅助放疗患者的放射性肺损伤发病风险,有预防放射性肺损伤发生的趋势。但2组无显著性差异,可能与病例数较少有关,有待扩大病例进一步研究。
随着患者年龄的增大,机体内胸腺细胞出现不同程度的退化和功能丧失,致使体内超氧化物歧化酶(SOD)的活性降低,使得体内氧自由基过剩是促进放射性肺损伤发生的因素之一[14]。本研究为对不同年龄组的放射性肺损伤发病情况进行比较,将97例患者由30~69岁分为4个年龄层,2组患者随年龄增大,其放射性肺损伤发病率都有增加的趋势,支持了随患者年龄的增大其放射性肺损伤的发生风险也随之增大的观点。TP-5是胸腺生成素的活性成分,可促进胸腺细胞的生长和分化而调节减退的胸腺功能,达到调节机体内SOD含量及活性的作用。本研究治疗组各年龄层放射性肺损伤发病率均低于对照组,提示TP-5有预防放射性肺损伤的作用。
乳腺癌根治术后的全身化疗亦是乳腺癌的综合治疗中的重要组成部分,然而化疗药物在治疗肿瘤的同时,对机体正常组织也造成一定程度的损伤。化疗药物可激活炎症细胞和免疫细胞,导致体内氧自由基含量增加[15-16],并使体内炎症性细胞因子浓度升高,继而与相关蛋白结合诱导肺组织纤维化[17-18]。本研究97例患者于术后辅助放疗前均已行多周期全身化疗,因此增加了后续放疗所引起的放射性肺损伤的风险,RT组≤4周期化疗、﹥4周期化疗放射性肺损伤的发病率比较具有显著性差异,化疗周期越长,放射性肺损伤的发病率越高。TR+TP-5组也得出相同结论。提示应用TP-5明显降低了放射性肺损伤的发生率。化疗方案不同,2组放射性肺损伤的发生率均无明显差异。且是否合并糖尿病对2组放射性肺损伤的发生率均无明显相关性。
综上所述,乳腺癌患者根治术后行辅助放疗,其放射性肺损伤的发病风险有随年龄增大而增加的趋势。全身化疗增加了放射性肺损伤的发病风险,化疗周期越长,其发病风险越高。化疗方案、是否合并糖尿病及与放射性肺损伤的发生无明显相关性。乳腺癌根治术后放疗同时应用TP-5,有降低放射性肺损伤发生风险的趋势,值得更多病例进一步研究。
[1] 肖文明,王颖. 胸腺五肽对乳癌化疗病人淋巴细胞亚群的影响及其临床意义[J]. 社区医学杂志,2010,8(23):1-3
[2] Bentzen SM,SKoczylas JZ,Bernier J. Quantitative clinical radiobiology of early and late lung reactions[J]. Int J Radiat Boil,2000,76:453
[3] 陈璐,李志斌,张德明,等. 放射性肺炎研究进展[J]. 中国现代医学杂志,2010,20(2):281-284
[4] 蒋定文,李楚芳,郭明秋. 胸腺五肽研究进展[J]. 国外医学预防、诊断、治疗用生物制品分册,1999,22(2):69-72
[5] Parkin DM,Bray F,Ferlay J,et al. Global cancer statistics,2002[J]. CA Cancer J Clin,2005,55(2):74-108
[6] 杨玲,李连弟,陈育德,等. 中国乳腺癌发病死亡趋势的估计与预测[J]. 中华肿瘤杂志,2006,28(6):438-440
[7] Violet JA,Harme RC. Breast cancer:improving outcome following adjuvant radiotherapy[J]. Br J Radiol,2004,77(922):811-820
[8] Bentzen SM,Skoczylas JZ,Bernier J. Quantitative clinical radiobiology of early and late lung reactions[J]. Int J Radiat Biol,2000,76:453
[9] 刘俐,肖明克,龙斌,等. 乳腺癌术后放疗诱发放射性肺炎探讨[J]. 四川肿瘤防治,2001,14(4):242-243
[10] Muller G,Kiricutal C,Stiess J,et al. Radiationpneumonitis and ulmornaryfibrosis after the CT planned radio therapy of bron chialcareinoma[J]. Strahlenther Onkol,1994,17(2):400
[11] 姚春筱. 生脉注射液防止放射性肺损伤96例疗效分析[J]. 中华放射医学与防护杂志,2004,24(1):52-53
[12] 刘莉,张米娜. 放射性肺炎及肺纤维化[J]. 临床内科杂志,2011,28(4):227-220
[13] Siemion I Z,Kluczyk A,Cebrat M. The peptide molecular links between the central nervous and the immune systems[J]. Amino Acids,2005,29(3):161[14] 陈海英,孔月红,蔡兆明. 胸腺细胞的年龄分布及木犀草素对其免疫功能的调节[J]. 徐州医学院院报,2006,26(4):302-305
[15] 王毓洲,陈书长. 化疗药物诱发弥漫性肺泡损伤的诊治进展[J]. 癌症进展,2009,7(1):19-22
[16] Ortiz LA,Lasky J,Hamiton RFJr,et al. Expression of TNF and the NECEssity for TNF receptors in bleomycin-induced lung injury in mice[J]. Exp Lung Res,1998,24:721
[17] Nagase T,Uozumi N,Ishii S,et al. A pivotal role of cytosolic phospholipase A(2) in bleomycin-induced pulmonary fibrosis[J]. Nat Med,2002,8:480
[18] Enholm EM,Phan SH. Bleomycin binding sites on alve-olar rnacmphages[J]. J Leukoc Biol,1990,48:519
Clinical analysis of postoperative radiotherapy for breast cancer combined with thymopentin-5 on the prevention of radiation-induced lung injury
Li Chunlu, Qu Yi, Yang Yueqin, Chen Yinghai, Zou Lijuan
(The Second Affiliated Hospital of Dalian Medical University, Dalian 116023, Liaoning, China)
Objective It is to analyze the related factors of radiation-induced lung injury, and evaluate the clinical efficacy of postoperative radiotherapy for breast cancer combined with Thymopentin-5 on the prevention of radiation-induced lung injury. Methods The clinical data of 97 patients with postoperative radiotherapy for breast cancer were retrospective analyzed, including age, chemotherapy cycle, chemotherapeutics, with or with out diabetes, chronic obstructive pulmonary disease (COPD), etc. The patients were divided into 2 groups according to treatment methods, there were 32 cases in radiotherapy (RT) group, and 65 cases in radiotherapy combined with Thymopentin-5 (RT+TP-5) group. The image changes of two groups of patients CT from the beginning of the radiotherapy until 4 to 6 weeks after radiotherapy were analyzed. The morbidity and the relevant factors of two groups were compared. Results The morbidity was 44% in RT group and 34% in RT+TP-5 group, there was no significant difference between them (P>0.05). There was no significant difference between the onset of age level with two groups (P>0.05). For the group that have cycle of chemotherapy≤ 4, the rates of radiation-induced lung injury in RT group was 16% and 23% in TR+TP-5 group, there was no significant difference (P>0.05), For the group that had cycle of chemotherapy>4, the rates of radiation-induced lung injury in RT group was 85% and 47% in TR+TP-5 group, there was significant difference between them (P<0.05). There was no significant difference in the rates of radiation-induced lung injury between chemotherapy cycle in≤4 period and >4 period for both groups (allP<0.05). About whether with diabetes or not, the incidence of radiation-induced lung injury rates of RT group were 45%, 43%, while the rates of TR+TP-5 group were 39%, 32%, but there was no significant difference between both groups (P>0.05). Conclusion For the patient with radiotherapy after radical operation of breast cancer, systemic chemotherapy can increased the risk of radiation-induced lung injury, and the chemotherapy cycle is longer, the risk of radiation-induced lung injury is higher. There is no significant correlation in chemotherapeutics, with or with out diabetes with radiation-induced lung injury. Postoperative radiotherapy for breast cancer combined with TP-5 can decrease the risk of radiation-induced lung injury.
postoperative radiotherapy for breast cancer; radiation-induced lung injury; Thymopentin-5
李春璐,女,住院医师,从事肿瘤放射治疗工作。
曲怡,Tel:15541178211,E-mail:2291688270@qq.com
10.3969/j.issn.1008-8849.2014.30.005
R737.9
A
1008-8849(2014)30-3318-04
2014-03-01
