结肠癌患者化疗/热化疗前后CD4+CD25+T细胞和CTL细胞的变化及临床意义
2014-08-11周怡萍韩宏斌梁宁震房修椢
周怡萍,韩宏斌,梁宁震,房修椢
(1. 辽河油田第二职工医院,辽宁 盘锦 124010;2. 解放军第463医院,辽宁 沈阳 110042)
结肠癌患者化疗/热化疗前后CD4+CD25+T细胞和CTL细胞的变化及临床意义
周怡萍1,韩宏斌1,梁宁震1,房修椢2
(1. 辽河油田第二职工医院,辽宁 盘锦 124010;2. 解放军第463医院,辽宁 沈阳 110042)

目的 探讨结肠癌患者化疗/热化疗前后CD4+CD25+T细胞和CTL的变化及临床意义。方法 选取68例结肠癌患者,分为化疗组34例和热化疗组34例,患者治疗前后采用流式细胞术检测外周血淋巴细胞中CD4+CD25+T细胞的表达,同时检测患者CTL细胞的功能,对比观察2组患者的检测结果,分析和探讨结肠癌患者化疗/热化疗前后CD4+CD25+T细胞和CTL的变化及临床意义。结果 化疗组患者治疗前后CD4+CD25+T细胞水平分别为(19±9)%和(19±3)%,无显著性差异(P>0.05);热化疗组患者治疗前后分别为(20±7)%和(15±8)%,有显著性差异(P<0.05);热化疗组患者治疗后的CD4+CD25+T细胞水平明显低于化疗组(P<0.05)。CTL细胞杀伤活性化疗组患者治疗前后分别为(10.4±2.2)%和(15.1±4.4)%,热化疗组患者治疗前后分别为(10.9±2.7)%和(17.5±3.8)%,2组比较治疗前后比较均有显著性差异(P均<0.05);热化疗组患者治疗后的CTL细胞杀伤活性显著优于化疗组(P<0.05)。结论 热化疗可明显改善结肠癌患者的免疫抑制状态,增强患者CTL细胞的杀伤活性,可提高患者的临床治疗效果,改善预后,值得临床推广应用。
结肠癌;化疗;热化疗;CD4+CD25+T细胞;CTL细胞
结肠癌是一种常见的消化道恶性肿瘤,在全球范围内发病率均有上升趋势,仅次于胃癌和食道癌[1],5 a生存率仅为45%左右,是严重威胁人类生命和健康的重要恶性肿瘤之一[2]。结肠癌起病隐匿,很多患者产生严重并发症才去就诊,如肠梗阻。临床结肠癌的治疗以手术及术后化疗为主,化疗/热化疗是临床内科治疗结肠癌的重要手段。但术后及化疗的结肠癌患者的机体免疫功能会明显下降,因此,改善患者的免疫功能对于结肠癌患者的治疗效果和预后有很大帮助。CD4+CD25+T细胞(调节性Treg细胞)是一个具有免疫抑制功能的T细胞亚群,能够显著抑制免疫反应,进而导致肿瘤细胞逃避机体的免疫监视,产生免疫耐受。细胞毒性T淋巴细胞(CTL细胞)是白细胞的亚部,是一种特异的T细胞,可分泌各种细胞因子参与免疫作用。本研究选取2009年10月—2013年10月于本院进行治疗的68例结肠癌患者,就结肠癌患者化疗/热化疗前后CD4+CD25+T细胞和CTL细胞的变化及临床意义进行研究和探讨,现报道如下。
1 临床资料
1.1 一般资料 选取上述时期于辽河油田第二职工医院进行治疗的68例结肠癌患者,均明确诊断为结肠癌。排除标准:患有自身免疫性疾病患者(如AIDS病等);服用免疫抑制剂的患者(附泼尼松等);既往接受过同种异体骨髓移植的患者;肝肾功能不全的患者;合并其他恶性肿瘤及感染的患者;患有血液系统疾病的患者。将患者随机分为2组:化疗组34例,男23例,女11例;年龄37~72(55.3±5.7)岁;高分化7例,中分化11例,低分化16例;组织学分型为管状腺癌23例,黏液腺癌11例;国际UICC分期为ⅢA期20例,ⅢB期9例,ⅢC期5例。热化疗组34例,男22例,女12例;年龄38~70(56.2±5.5)岁;高分化8例,中分化12例,低分化14例;组织学分型为管状腺癌24例,黏液腺癌10例;国际UICC分期为ⅢA期21例,ⅢB期9例,ⅢC期4例。2组患者在年龄、性别及病情等一般资料方面比较差异均无统计学意义(P均>0.05),具有可比性。
1.2 方法 化疗组34例患者行常规化疗。方案:第1天,奥沙利铂150 mg/m2;第1—5天,亚叶酸钙200 mg/m2,5-Fu 500 mg/m2。1周期为1个疗程,共治疗6个疗程。热化疗组34例患者行化疗联合热疗。化疗方案同化疗组;热疗使用905 MHz电磁波腹腔内局部透热,最高温度43 ℃,治疗时间为60 min/次,4~5次为1个疗程,共治疗6个疗程。
1.3 观察项目
1.3.1 CD4+CD25+T细胞水平[3]取所有患者化疗/热化疗前后的外周血的淋巴细胞,将细胞浓度调整为1×107mL-1重悬,通过30 μm的滤网去除细胞团快,CD4+CD25+T细胞分选试剂盒按操作步骤分离后,通过流式细胞仪检测CD4+CD25+T细胞的表达。
1.3.2 CTL细胞杀伤活性 用含有胎牛血清的RP-MI-1640的培养液调整细胞浓度,肿瘤靶细胞调整至2×105mL-1,CTL效应细胞调整至2×106mL-1;将靶细胞盒效应细胞加入96孔的圆底细胞培养板中,100 μL/孔,3个复孔/组;设效应细胞自然释放对照孔,靶细胞自然释放对照孔和靶细胞最大释放孔;置于37 ℃、CO2体积分数为5%的培养箱中培养4~6 h,200 g离心10 min;将每孔吸出50 μL上清液对应加入另一块96孔酶联检测板中,加入50 μL的LDH基质试剂室温放置30 min,再加入50 μL终止试剂;在酶联检测仪上测定各孔的光密度(A值),检测波长492 mm。按公式计算特异性杀伤活性:杀伤率(%)=(1-(效靶孔A值-效应细胞孔A值)/靶细胞A值)×100%。

2 结 果
2.1 治疗前后CD4+CD25+T细胞水平比较 见表1。
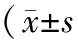
表1 2组治疗前后CD4+CD25+T细胞水平比较,%)
2.2 治疗前后CTL细胞杀伤活性比较 见表2。
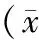
表2 2组治疗前后CTL细胞杀伤活性比较±s,%)
3 讨 论
全球每年新发结直肠癌的病例近100万,每年有近50万人死于结直肠癌[4]。我国的发病率也不断上升。该病通常会采用手术和术后化疗进行治疗,尽早发现和尽早治疗史该病提高生存率的关键[5]。从免疫学及病理学角度而言,肿瘤的发生与发展跟肿瘤细胞的免疫逃逸和免疫耐受具有密切的关系[6]。
Sakaguchi等[7]在1995年首次分离获得具有免疫调节作用的CD4+CD25+T细胞并称之为调节性T细胞,其是一类存在于正常机体内同时具有免疫无能性和抑制性的调节性T淋巴细胞,通过分泌抑制性细胞因子与T-T细胞接触性抑制,进而对抗原提呈细胞(APC)和免疫效应细胞,发挥独特的免疫调节功能[8-9]。CTL细胞对某些病毒和肿瘤细胞等抗原物质具有杀伤作用,与机体自然杀伤细胞构成机体重要防线。CD4+CD25+T细胞和CTL细胞均与肿瘤的发生和发展密切相关[10]。化疗是通过化学药物诱导细胞凋亡来达到直接杀伤肿瘤细胞的作用,是目前治疗肿瘤及某些自身免疫性疾病的一种主要手段,但患者普遍产生明显的恶心呕吐等不良反应,在杀伤靶细胞的同时可导致淋巴细胞的减少,而使机体的免疫功能受到影响。
热化疗是近年来肿瘤治疗的研究热点之一,其通过热效应将肿瘤区或全身加热至有效的治疗温度范围并维持一定时间,以杀灭肿瘤细胞,进而达到清除体内肿瘤细胞的作用,并且可以促进细胞因子的合成,增强免疫效应。有研究表明,对于肿瘤患者的治疗,采用热疗与化疗相结合的方法比单纯化疗效果更好,且无瘤期更长[11]。
本研究通过对结肠癌患者化疗前后以及热化疗前后外周血CD4+CD25+T细胞水平变化和CTL细胞杀伤活性变化进行检测发现,热化疗组患者治疗后的CD4+CD25+T细胞水平均明显低于治疗前,并且热化疗组患者明显低于化疗组;2组患者治疗后的CTL细胞杀伤活性均有增强,但热化疗组患者治疗后的CTL细胞杀伤活性优于化疗组。
综上所述,热化疗可明显改善结肠癌患者的免疫抑制状态,增强患者的CTL细胞的杀伤活性,可提高患者的临床治疗效果,改善预后,值得临床广泛推广应用。
[1] 王郭虹,杨鸿,姜凯,等. 新辅助化疗对结肠癌患者手术及预后的影响[J]. 中国医药导刊,2013,15(6):1012-1013
[2] 孙秀梅,高峰,李贵新,等. 新辅助化疗后大肠癌患者癌组织中CD44v6,p27的表达及意义[J]. 山东医药,2010,50(11):75-77
[3] 施怡,李晓斌,章岳山. 结直肠癌患者化疗/热化疗前后CD4+CD25+T细胞和CTL变化[J]. 中国癌症杂志,2010,20(8):626-629
[4] 袁琳娜,郭志琴,柯萍,等. 结直肠癌组织Tip60蛋白表达及其临床意义探讨[J]. 中华肿瘤防治杂志,2014,21(1):43-46
[5] 楚朝辉,张和平,裴秋立,等. 直肠癌根治术中多途径化疗的临床应用[J]. 疑难病杂志,2011,10(2):136-137
[6] 高强,邱双健,樊嘉. CD4+CD25+FOXP3+调节性T细胞在肿瘤免疫逃逸中的作用研究进展[J]. 中国癌症杂志,2007,8(17):657-663
[7] Sakaguchi S,Sakaguchi N,Asano M,et al. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J]. J Immunol,1995,155(3):1151-1164
[8] 史增梅. 化疗联合热疗对直肠癌患者治疗前后CD4+CD25+T细胞和CTL细胞的影响[J]. 河北医药,2012,34(13):1978-1979
[9] 王欣,杨敬慈,张广杰,等. CD4+CD25+调节性T细胞表达在ITP和AIHA中的意义[J]. 河北医药,2011,33(8):2462-2463
[10] Lim HW,Hillsamer P,Banham AH,et al. Direct suppression of B cells by CD4+CD25+regulatory Tcells[J]. J Immunol,2005,175(7):4180-4183
[11] 张勰义,张晨鹏,孙晓光,等. 结直肠癌预后的影响因素研究[J]. 中国全科医学,2011,14(36):4128-4130
The changes and clinical significance of CD4+CD25+regulatory T cells and cytotoxic T cell in patients with colon cancer treated by chemotherapy or thermochemotherapy
Zhou Yiping1, Han Hongbin1, Liang Ningzhen1, Fang Xiugui2
(1.The Second Worker’s Hospital of Liaohe Oil Field, Panjin, Liaoning 124010, China; 2.Hospital 463 of PLA, Shenyang 110042, Liaoning, China)
Objective It is to investigate the changes and clinical significance of CD4+CD25+regulatory T cells and cytotoxic T cell in patients with colon cancer treated by chemotherapy or thermochemotherapy. Methods 68 patients with colon cancer were collected and divided into chemotherapy group with 34 cases and thermochemotherapy group with 34 cases, CD4+CD25+regulatory T cells in peripheral blood before and after treatment were measured by flow cytometry, and the killing function of cytotoxic T cell was detected at the same time. The test results of two groups were compared, and the changes and clinical significance of CD4+CD25+regulatory T cells and cytotoxic T cell in patients with colon cancer treated by chemotherapy or thermochemotherapy were analyzed and discussed.Results The level of CD4+CD25+regulatory T cells, chemotherapy group before and after treatment respectively was (19±9)% and (19±3)%, there was no significant difference (P>0.05). Thermochemotherapy group before and after treatment respectively was (20±7)% and (15±8)%, there was significant difference(P<0.05). The change of CD4+CD25+regulatory T cells after treatment of thermochemotherapy group was significantly lower than chemotherapy group (P<0.05). The killing function of cytotoxic T cell, chemotherapy group before and after treatment respectively was (10.4±2.2)% and (15.1±4.4)%, thermochemotherapy group respectively was (10.9±2.7)% and (17.5±3.8)%, there was no significant difference between them in both groups (P<0.05). The change of killing function of cytotoxic T cell after treatment of thermochemotherapy group was significantly better than chemotherapy group, (P<0.05). Conclusion Thermochemotherapy can significantly improve the status of immunesuppression in colon cancer patients and enhance killing function of cytotoxic T cell, and can improve the clinical effect and the prognosis, it is worth to be widely applied clinically.
colon cancer; chemotherapy; thermochemotherapy; CD4+CD25+regulatory T cells; cytotoxic T cell
周怡萍,女,主治医师,研究方向为肿瘤专业。
辽宁省科学技术计划项目(2013020198-204)
10.3969/j.issn.1008-8849.2014.30.003
R735.35
A
1008-8849(2014)30-3313-03
2014-04-05
