人参二醇组皂苷具有与地塞米松类似的改善LPS处理小鼠肾功能的作用*
2014-08-08杜艳伟王晓琴刘莲勤赵雪俭
陈 燕, 杜艳伟, 王晓琴, 付 双, 刘莲勤, 于 淇, 方 圆, 高 品, 杨 光, 孟 艳, 赵雪俭△
(吉林大学1基础医学院病理生理学教研室, 2第一医院肾病科,吉林 长春 130021)
内毒素血症诱发的失控性全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)是导致多器官功能衰竭的重要原因,而急性肾损伤(acute kidney injury,AKI)是其中最严重的并发症,致死率极高[1]。Annane[2]认为脓毒症诱发的SIRS中,致炎细胞因子如肿瘤坏死因子α (tumor necrosis factor α, TNF-α)等释放又可导致炎症细胞进一步激活形成炎症因子“瀑布”反应,患者处于危急状态时外源性糖皮质激素能逆转这种状态,使心血管系统恢复稳态,各器官的功能恢复,从而挽救了患者的生命。2013年Choi等[3]认为糖皮质激素可通过减轻线粒体损伤和凋亡,起到治疗脓毒性AKI的作用。实际上,糖皮质激素抢救危症和多种难治性疾病的功能很强大。尽管如此,糖皮质激素的副作用不容忽视, 譬如,胃肠道应激性出血可成为各种危症患者的隐形杀手[4]。此外,肥胖、骨质疏松症和胰岛素抵抗等副作用难以防治[5]。因此,临床急需有与糖皮质激素类似疗效的而无糖皮质激素样副作用的药物。自古以来,人参汤有 “起死回生”之功效。为用现代技术揭示其中的奥秘,本研究组通过系列研究发现,人参二醇组皂苷(panaxadiol saponins,PDS)有地塞米松(dexamethasone, DEX)相类似的改善失血性休克犬心肺微循环、逆转心肺功能等作用[6]。而且,PDS没有DEX相类似的副作用。然而,PDS是否同DEX一样能够减轻脓毒症诱导的AKI,尚缺乏实验证据。因此,本研究拟在建立LPS诱导的AKI小鼠模型的基础上,对比研究PDS和DEX对LPS诱导的AKI的影响及其分子机制。
材 料 和 方 法
1 小鼠AKI模型复制与分组
C57BL/6小鼠随机分为盐水对照(control)组、LPS模型组(LPS组)、PDS+LPS组和DEX+LPS组(共计32只,n=8)。对照组经腹腔注射0.9%氯化钠注射液0.5 mL,其余3组分别经腹腔注射LPS 10 mg/kg。PDS+LPS组、DEX+LPS组小鼠在LPS注射前1 h分别经腹腔注射PDS(25.0 mg/kg)或DEX(2.5 mg/kg)。LPS处理12 h后,麻醉下取肾脏组织冻存或固定,备蛋白检测与形态学观察;采集血液,血液在室温下离心(3 000 r/min)10 min制备血清样本, 应用全自动生物化学分析仪检测小鼠血清肌酐(creatinine, CREA)和血尿素氮(blood urea nitrogen,BUN)的含量。
2 酶联免疫法检测血清TNF-α和IL-6含量
取小鼠血清,用酶联免疫法(试剂盒购自上海科敏生物技术有限公司)测定血清TNF-α和IL-6的水平。酶标仪为Bio-Tek,型号ELX800。TNF-α和IL-6的血清浓度用ng/L表示。
3 应用免疫印迹(Western blotting)检测蛋白的表达
3.1肾组织蛋白提取 总蛋白、细胞质和细胞核蛋白的提取:将100 mg肾组织用液氮研磨成粉末,并移至EP管中,再加入500~800 μL组织裂解液RIPA(含PMSF和蛋白酶抑制剂)于冰上孵育10 min,室温放置10 min,4 ℃、12 000 r/min,离心20 min。吸取上清分装,保存于-80 ℃。细胞核蛋白(n-pro)与细胞浆蛋白(c-pro)的提取:按NE-PER核蛋白-胞浆蛋白提取试剂盒(Thermo Scientific Pierce)的说明书操作,分别提取出这2种蛋白。
3.2免疫印迹法检测 胞质和胞核提取物及总蛋白浓度通过BCA法测定。按常规方法配制聚丙烯酰胺凝胶,依次进行SDS-PAGE、转膜、封闭、抗体孵育、ECL显色。抗体包括锰超氧化物歧化酶(manganese superoxid dismutase,Mn-SOD)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、糖皮质激素受体(glycocorticoid receptor,GR)、p-IκB、IκB、p50、p65、lamin B1 (Abcam)和β-actin (Proteintech Group)。辣根过氧化物酶(HRP)标记的抗兔IgG Ⅱ抗购自Proteintech Group(稀释度为1∶10 000)。
3.3结果分析 特异性条带的表达丰度用上海天能科技有限公司GIS凝胶图像分析系统进行灰度扫描。以β-actin或Lamin B1 作为内参照,各蛋白表达水平的组间比较用统计学软件分析。
4 肾组织一氧化氮(nitric oxide,NO)和丙二醛(malondialdehyde,MDA)含量的检测
肾组织NO含量检测,采用硝酸还原酶法测定;肾组织MDA检测,应用硫代巴比妥酸法。所用检测试剂盒均由南京建成生物工程研究所提供。
5 统计学处理
数据用均数±标准误(mean±SEM) 表示。组间差异采用SPSS 17.0统计软件进行单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 LPS 成功建立AKI小鼠模型,PDS和DEX均能减轻LPS诱导的AKI
LPS 组肾脏指数明显增加,LPS组肾脏相对重量(0.0073±0.0004)显著高于对照组(0.0056±0.0005)(P<0.01)。然而, PDS和DEX组肾脏相对重量 (0.0064±0.0001和0.0065±0.0001)明显低于LPS组(P<0.05)。
BUN含量 LPS组为(32.31±1.76) mmol/L,对照组为(11.83±0.99)mmol/L,LPS组显著高于对照组(P<0.01)。然而,PDS+LPS组的BUN含量为(24.95±2.61)mmol/L,与DEX+LPS组的BUN含量[(24.90±2.41) mmol/L]接近,均显著低于LPS组(P<0.05)。 血清CREA含量,LPS组为最高[(44.15±2.87)μmol/L],与对照组[(16.16±1.43)μmol/L]比较差异显著(P<0.01);PDS+LPS组[(32.60±2.80)μmol/L]和DEX+LPS组[(31.77±4.60)μmol/L]接近,均明显低于LPS组(P<0.05),见表1。这些结果表明腹腔注射10 mg/kg LPS,12 h后能成功复制LPS诱导的AKI小鼠早期动物模型,并且PDS具有与DEX相类似的改善AKI小鼠肾功能的效应。

表1 PDS对LPS所致急性肾损伤小鼠肾脏指数、血清CREA和BUN的影响
2 PDS和DEX改善LPS诱导的AKI小鼠肾功能的作用机制
2.1PDS和DEX均能抑制LPS诱导AKI小鼠TNF-α和IL-6的产生 如图1所示,LPS组血清TNF-α和IL-6含量显著高于对照组(P<0.05,P<0.01)。PDS组TNF-α和IL-6含量明显低于LPS组(P<0.05),DEX组与LPS组比较,TNF-α有下降趋势,IL-6显著降低(P<0.05)。

Figure 1. PDS and DEX inhibited TNF-α (A) and IL-6 (B) production in LPS-induced AKI mice. Mean±SEM. n=8.*P<0.05, **P<0.01 vs control;#P<0.05 vs LPS.
2.2PDS和DEX均能抑制LPS诱导AKI小鼠NF-κB信号通路的活化 如图2 所示,LPS组磷酸化IκB(p-IκB)蛋白表达水平与对照组比较明显增高(P<0.01),PDS组p-IκB蛋白表达水平明显低于LPS组(P<0.05),DEX组的p-IκB表达水平与LPS组比较也有降低趋势。 LPS组的核NF-κB p65和p50的表达水平与对照组比较显著增高(P<0.05)。然而,与LPS组比较,PDS组和DEX组核内NF-κB p65和p50表达水平显著下调(P<0.05)。可见,PDS和DEX抑制了IκB蛋白的磷酸化水平,进而抑制了NF-κB信号通路活化,减少炎症因子产生与释放,逆转LPS诱导AKI的肾功能。
2.3PDS和DEX均能抑制LPS处理小鼠肾脏iNOS的表达和NO含量的升高 LPS组肾脏组织iNOS蛋白表达水平和NO含量与对照组比较均显著增高(P<0.05)。然而,PDS组和DEX组肾脏组织iNOS蛋白表达水平和NO含量均显著低于LPS组(P<0.05),见图3。

Figure 2. PDS and DEX suppressed NF-kappa B signaling pathway activation in the kidney of LPS-induced AKI mice.Mean±SEM. n=8.*P<0.05 vs control; #P<0.05 vs LPS.
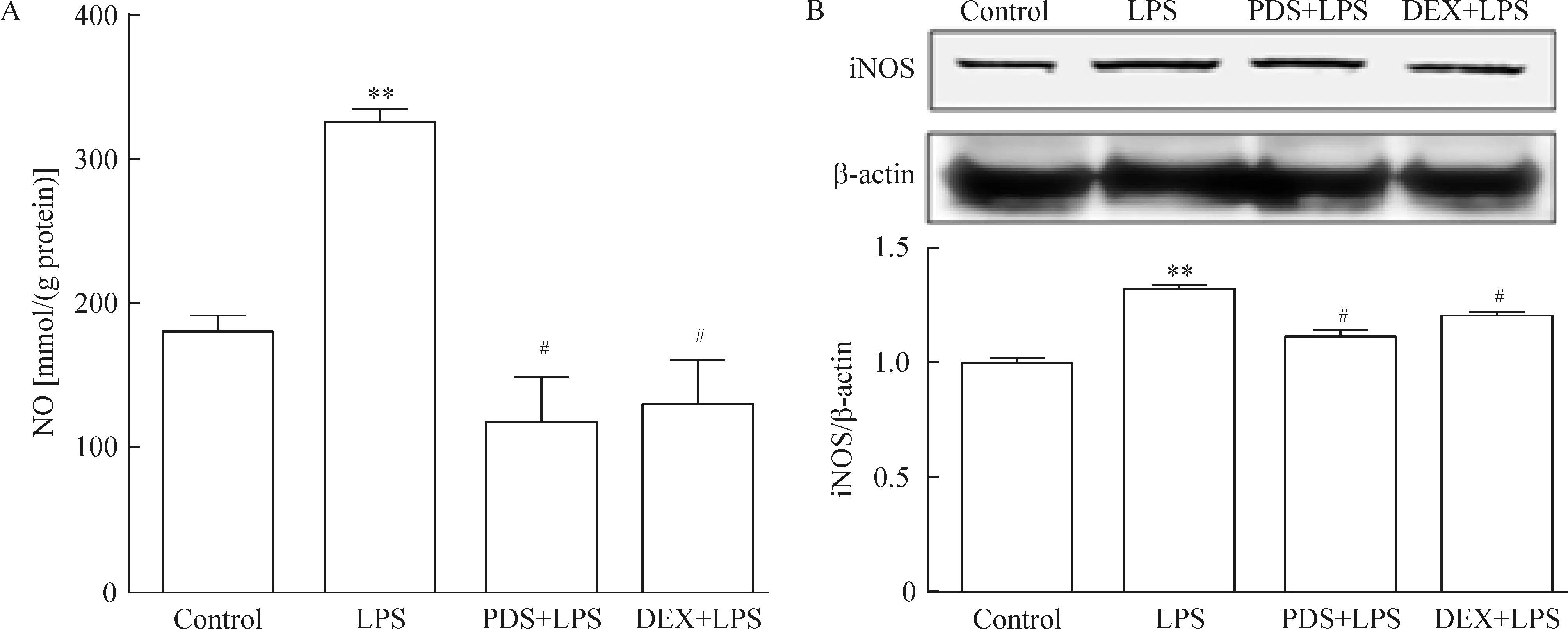
Figure 3. PDS and DEX reduced renal nitric oxide (NO) production (A) and inducible notric oxide snythase (iNOS) expression (B) in LPS-treated mice.Mean±SEM. n=8.**P<0.01 vs control; #P<0.05 vs LPS.
2.4PDS和DEX均能降低LPS处理小鼠肾脏MDA的含量,上调肾组织Mn-SOD蛋白的表达 LPS组肾组织MDA含量与对照组比较明显增高(P<0.05),而清除氧自由基酶Mn-SOD的蛋白表达水平明显下降(P<0.05),见图4。LPS诱导的氧化应激加重AKI小鼠的肾脏功能障碍。然而,PDS和DEX则通过抗氧化应激作用减轻LPS诱导的AKI。

Figure 4. PDS and DEX up-regulated renal Mn-SOD expression (B) and decreased MDA content (A) in LPS-treated mice.Mean±SEM. n=8.*P<0.05, **P<0.01 vs control; #P<0.05 vs LPS.
3 PDS与DEX均能增加LPS处理小鼠肾脏细胞核GR(nuclear GR, n-GR)的含量
总GR(total GR,t-GR)除对照组表达最低,其余3组t-GR表达水平均明显增高,组间没有显著差异。LPS组n-GR水平与对照组比较明显降低(P<0.05),PDS+LPS组和DEX+LPS组n-GR表达水平相似,均明显高于LPS组(P<0.05),见图5。这些结果提示,PDS有可能是GR的功能配体。

Figure 5. PDS and DEX increased nuclear glucocorticoid receptor (n-GR) content in the kidney from LPS-treated mice. Mean±SEM. n=8.*P<0.05 vs control;#P<0.05 vs LPS.
讨 论
脓毒症诱发的失控性SIRS是导致多器官功能衰竭的重要原因,AKI是其中最严重的并发症,致死率极高[7]。本研究组用LPS 10 mg/kg腹腔注射,12 h已经成功地用LPS诱导出早期AKI小鼠模型。LPS组血清BUN含量显著高于对照组;血清肌酐含量LPS组同样显著高于对照组。重要的是,PDS和DEX均能明显地改善LPS诱导AKI小鼠的肾功能,这些结果显示PDS预处理具有DEX相似的效果,均能减轻LPS诱导的AKI。为探讨PDS和DEX减轻LPS诱导的AKI的机制, 我们进行了进一步研究。
AKI的发病源于对促炎因子的反应,包括细胞因子分泌和活性氮氧自由基的作用[8]。譬如,TNF-α不仅仅是具有杀灭肿瘤细胞作用的细胞因子,而且,TNF-α与2个不同的受体结合,能激活不同的和重叠的信号转导通路。血管内皮细胞受TNF-α攻击后,通过接受大量的促炎信号,可增加白细胞黏附、血管渗漏和血栓形成等。因此,TNF在炎症性疾病的发病机制中起关键作用[9-10]。本研究发现,LPS组血清TNF-α和IL-6 含量与对照组比较明显升高。而PDS和DEX均明显抑制LPS诱导的TNF-α 和IL-6的产生。
SIRS的发生与NF-κB信号通路的活化相关。在静息时抑制性蛋白IκB 与NF-κB以二聚体的形式结合,以无活性的形式存在于胞浆中。然而,当细胞接受TNF-α等炎症因子刺激时,会激活IκB激酶[9],促使IκB磷酸化,导致IκB发生泛素化和蛋白酶体降解,从而释放NF-κB,使其解离成p65和p50 转入核内调节多种基因产生与释放炎症因子,诱发失控性SIRS,进而导致多器官功能损伤。本研究结果表明,LPS组p-IκB蛋白表达水平与对照组比较明显增高(P<0.01),必然促进NF-κB的释放,核p65和p50的蛋白表达LPS组明显高于对照组(P<0.05)。p50和p65启动多种细胞因子的产生与释放,进而加重LPS诱导的AKI的肾功能损伤。而PDS+LPS组p-IκB蛋白表达水平明显低于LPS组(P<0.05),DEX组的p-IκB表达水平与LPS组比较也有降低趋势。而且,与LPS组比较,PDS组和DEX组核内NF-κB p65和p50表达水平显著下调。可见,PDS和DEX均能抑制肾脏组织IκB蛋白的磷酸化,进而抑制肾脏NF-κB信号通路的活化。
本研究还发现, PDS和DEX均能下调LPS诱导的小鼠肾组织iNOS表达, 并上调Mn-SOD蛋白表达。Holthoff等[11]研究表明,白藜芦醇通过抑制活性氮自由基的活性实现了减轻脓毒症性AKI的作用。Wu等[12]研究显示选择性iNOS抑制剂L-N6-(1-iminoethyl)-lysine减轻了肾小管的氧化应激,并纠正了微循环的异常。本研究发现PDS和DEX有同样的下调LPS诱导的AKI小鼠肾脏iNOS和NO含量的作用。Kruzel等[13]研究显示,LPS诱导的氧爆发起源于线粒体,ROS是从呼吸链的复合体Ⅲ中释放的。有研究发现人参二醇组皂苷Rb1(含4个葡萄糖)可以直接与羟自由基(OH· )相互作用,保护局部缺血神经元[14]。本研究表明在LPS组线粒体特异的捕捉氧自由基的酶Mn-SOD表达水平与对照组相比明显降低。然而,PDS+LPS组和DEX+LPS组的Mn-SOD蛋白表达水平与LPS组比较被明显上调。可见,PDS和DEX均能抑制氧化应激减轻LPS诱导的AKI。
众所周知, DEX通过GR发挥功能作用。DEX作为配体与GR结合导致GR活化,活化的GR以同源二聚体形式转移到核内,再与正调节的GRE结合后,能够诱导一些抗炎蛋白等表达。本研究发现 PDS与DEX十分相似, 均能增加肾脏组织细胞n-GR蛋白的含量。然而,PDS是否与DEX一样也会作为功能配体与GR结合导致GR活化 ,以配体-GR复合物的形式转入细胞核并能诱导GR的转录活性呢?我们的分析认为,PDS作为GR的功能配体可能性较大,PDS由Rb1、Rb2、Rc和Rd等组成,都在同一位置上含有糖链,在酸性环境下糖链被水解掉就会与受体相互作用,发挥甾醇的多种生理功能。Lee等[15]已经证明人参单体Rg1是核内糖皮质激素受体的功能性配体。另一种可能就是PDS可能作为一种激活剂促进糖皮质激素与GR结合,然后,以二聚体形式入核发挥作用。
(致谢:人参二醇组皂苷由吉林大学天然药物研究室提供,是从人参茎叶中提取的专利产品,专利号: ZL 98 1 00070.3。发明人:马兴元、陈燕萍等。专利权人:吉林大学。)
[参 考 文 献]
[1] Venkatachalam MA, Weinberg JM. The tubule pathology of septic acute kidney injury: a neglected area of research comes of age[J]. Kidney Int,2012,81(4):338-340.
[2] Annane D. Corticosteroids for severe sepsis: an evidence-based guide for physicians[J]. Ann Intensive Care, 2011,1(1):7.
[3] Choi HM, Jo SK, Kim SH, et al. Glucocorticoids attenuate septic acute kidney injury[J]. Biochem Biophys Res Commun, 2013,435(4):678-684.
[4] 徐 琳,赵雪俭,赵 丹,等. 人参二醇皂甙对失血性休克犬单胺类递质和单胺氧化酶的影响[J]. 中国病理生理杂志,1990,6(2):69-72.
[5] Brennan-Speranza TC, Henneicke H, Gasparini SJ, et al. Osteoblasts mediate the adverse effects of glucocorticoids on fuel metabolism[J]. J Clin Invest, 2012,122(11):4172-4189.
[6] 刘喜春,李 璐,于振香,等. 人参二醇皂苷对LPS休克大鼠肺组织AQP1表达的影响[J]. 中国病理生理杂志, 2006,22(8):1562-1565.
[7] Venkatachalam MA, Weinberg JM. The tubule pathology of septic acute kidney injury: a neglected area of research comes of age[J]. Kidney Int, 2012,81(4):338-340.
[8] Wu L, Mayeux PR. Effects of the inducible nitric-oxide synthase inhibitor L-N6-(1-iminoethyl)-lysine on microcirculation and reactive nitrogen species generation in the kidney following lipopolysaccharide administration in mice[J]. J Pharmacol Exp Ther, 2007,320(3):1061-1067.
[9] Bradley JR. TNF-mediated inflammatory disease[J]. J Pathol, 2008,214(2):149-160.
[10] Naito M, Bomsztyk K, Zager RA. Endotoxin mediates recruitment of RNA polymerase II to target genes in acute renal failure[J]. J Am Soc Nephrol,2008, 19(7):1321-1330.
[11] Holthoff JH, Woodling KA, Doerge DR, et al. Resveratrol, a dietary polyphenolic phytoalexin, is a functional scavenger of peroxynitrite[J]. Biochem Pharmacol, 2010,80(8):1260-1265.
[12] Wu L, Gokden N, Mayeux PR. Evidence for the role of reactive nitrogen species in polymicrobial sepsis-induced renal peritubular capillary dysfunction and tubular injury[J]. J Am Soc Nephrol, 2007,18(6):1807-1815.
[13] Kruzel ML, Actor JK, Radak Z, et al. Lactoferrin decreases LPS-induced mitochondrial dysfunction in cultured cells and in animal endotoxemia model[J]. Innate Immun, 2010,16(2):67-79.
[14] Lim JH, Wen TC, Matsuda S, et al. Protection of ischemic hippocampal neurons by ginsenoside Rb1, a main ingredient of ginseng root[J]. Neurosci Res, 1997,28(3):191-200.
[15] Lee YJ, Chung E, Lee KY, et al. Ginsenoside-Rg1, one of the major active molecules from Panax ginseng, is a functional ligand of glucocorticoid receptor[J]. Mol Cell Endocrinol, 1997,133(2):135-140.
