温和压力对面包酵母C I C C 1 4 4 7谷胱甘肽合成的影响
2014-07-27,*
,*
(1.浙江新银象生物工程有限公司,浙江台州 317200;2.天津科技大学生物工程学院,天津 300457;3.工业发酵微生物教育部重点实验室,天津 300457)
1921年Hopkins首先发现了谷胱甘肽,并命名为glutathione(GSH),其化学结构在 1930 年得到确定[1],由L-半胱氨酸、L-谷氨酸和甘氨酸缩合而成[2]。GSH是体内重要的抗氧化剂,能减少氧化剂对巯基的破坏作用,保护细胞膜中含巯基的蛋白质不被氧化[3]。谷胱甘肽不仅具有解毒作用,而且可以作为功能性食品添加剂[4],在肉制品中添加GSH可以强化风味,添加到水果罐头中可以防止色素沉积等[5]。
压力对细胞代谢的影响已有相关报道[6-7]。压力一方面影响微生物酶促反应进而使微生物细胞代谢发生改变,另一方面压力会影响微生物基因及相关蛋白的表达,从而改变微生物细胞的代谢[8]。压力大小和保压时间、加压前培养时间、升降压速率、培养基成分、温度、pH等[9-11]压力作用条件都会对微生物产生一定的影响。本文研究了温和压力(0.1 MPa~5.0 MPa)对面包酵母CICC1447生物合成GSH的影响,得到最优加压条件。
1 材料与方法
1.1 材料与试剂
面包酵母(Saccharomyces cerevisiae)CICC1447由工业发酵微生物教育部重点实验室(天津科技大学)保藏;四氧嘧啶ALLOXAN(分析纯)购自Sigma公司;GSH标品(色谱纯)购自上海生工生物工程有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
HA-X型高压反应设备:海安县石油科研仪器厂;CR22G II高速冷冻离心机:日本日立公司;FACSC alibur型流式细胞仪:美国碧迪公司;752型紫外光栅分光光度计:上海精密仪器科学技术有限公司;SCIENTZ—ⅡD超声波破碎仪:宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 发酵实验
从保藏斜面上挑取1~2环菌体,接入YEPD种子培养基中,温度30℃,转速150 r/min摇床培养16 h~24 h后,再以10%的接种量接入发酵培养基(酵母膏5 g/L、葡萄糖 30 g/L、硫酸镁 1.5 g/L、硫酸铵 5 g/L、硫酸钾3.6 g/L、磷酸二氢钾1.0 g/L、硫酸锰0.008 g/L,硫酸亚铁0.008 g/L、pH 6.0[12]),进行扩大培养。500 mL三角瓶中装液量为100mL、30℃、150r/min培养20h后转入高压反应釜进行加压发酵,同时以常压发酵作为对照。
1.3.2 GSH质量浓度测定
利用温差破碎法提取GSH,采用四氧嘧啶法进行GSH质量浓度测定[13]。
1.3.3 菌体量的测定
采用烘干恒重法测定菌体量[14]。
1.3.4 细胞存活率及活细胞数的计算方法
采用美兰染色并用血球计数板进行测定[15]。
1.3.5 染色剂与胞内DNA结合产生荧光的强度测定
参照肖安风等人的方法用生理盐水悬浮离心收集的酵母细胞[16],制成约1×107cells/mL的细胞悬液,在500 μL 细胞悬液中加入 75 μg碘化丙啶(PI),避光反应5 min。将染色好的样品放入流式细胞仪,荧光激发波长为488nm,使用660/16nm带通滤片检测PI荧光强度。
2 结果与分析
2.1 常压发酵实验
为了研究温和压力对面包酵母谷胱甘肽生物合成能力的影响,对面包酵母进行常压发酵试验,作为对照见图1。
由图1可知,发酵27 h时菌体量达到最大,同时GSH质量浓度也达到最大36.67 mg/L。27 h时后GSH与菌体量同时下降,可能由于发生菌体自溶导致GSH质量浓度降低。

图1 面包酵母CICC1447 GSH常压发酵曲线Fig.1 Fomentation curve of GSH under atmospheric pressure of Saccharomyces cerevisiae CICC1447
2.2 保压时间对GSH合成的影响
以高纯空气(O2∶N2=21∶79)为加压介质,在发酵20 h时以0.05 MPa/min速率将压力升到1.0 MPa,研究保压时间对GSH生物合成量的影响,空白对照为常压发酵见图2。

图2 保压时间对面包酵母CICC1447 GSH合成的影响Fig.2 Effect of holding time on the synthesis of GSH of Saccharomyces cerevisiae CICC1447

图3 保压时间对面包酵母CICC1447的影响Fig.3 Effectofholdingtimeon SaccharomycescerevisiaeCICC1447
由图2可以看出,在1.0 MPa压力下处理时间6 h后,酵母胞内积累GSH的质量浓度达到最大值42.86 mg/L,较常压发酵提高了15.36%。保压9 h的处理组GSH合成量低于保压6 h的处理组。
由图3可知,随着保压处理时间的延长,酵母菌细胞的存活率由100%(0 h)下降到85.67%(9 h),加压6 h后菌体量也有所下降。这可能是酵母细胞在长时间受到压力刺激后,细胞膜通透性发生改变,导致胞内代谢发生变化甚至因细胞膜的破损而自溶。GSH作为应激性反应的主要代谢产物,在菌体受到压力刺激时,为了维持正常的代谢活动,菌体产生应激反应开始大量积累GSH。但随着保压时间延长,菌体存活率下降,可能部分菌体细胞破碎,从而使GSH浓度反而降低。
2.3 压力对GSH合成量的影响
在20 h时以升降压速率为0.05 MPa/min将压力分别升到 0.5、1.0、1.5、2.0 MPa,选择保压时间 6 h 进行发酵,结果见图4。

图4 压力对面包酵母CICC1447 GSH合成的影响Fig.4 Effect of pressure on the synthesis of GSH of Saccharomyces cerevisiae CICC1447
当压力为0.5 MPa时,GSH浓度较对照组提高17.03%,但随着压力的进一步增加,GSH浓度开始下降,当压力超过1.5 MPa后,GSH浓度迅速下降。图5证明压力大小对面包酵母细胞存活率、菌体量的影响较大,随着压力的升高,当压力超过1.0 MPa时,酵母菌的存活率迅速下降,由0.5 MPa时的98.23%下降到2.0 MPa时的62.45%。菌体在低压条件下,为了应对压力刺激,促进了GSH的积累,但当压力超过菌体承受极限,代谢出现紊乱,使存活细胞中应激代谢产物含量降低[17],单位质量细胞生产的GSH开始下降,另一方面大量细胞开始破碎,细胞总量降低,也加速了GSH产量的降低。因此确定0.5 MPa为酵母菌积累GSH的最佳压力条件。

图5 压力对面包酵母CICC1447的影响Fig.5 Effect of pressure on Saccharomyces cerevisiae CICC1447
2.4 升降压速率对GSH合成量的影响
在上述最优条件下,以升降压速率分别为0.05、0.10、0.15、0.20、0.25 MPa/min 进行实验,从图 6 可以看出,当升降压速率在0.10 MPa/min以下时,升降压速率对积累合成GSH的影响不大。但当升降压速率大于0.10 MPa/min时,GSH的浓度随升降压速率的增大而减小。升降压速率会对细胞存活率和菌体量产生影响(图7)。细胞存活率和菌体量在升降压速率为0.05 MPa/min~0.10 MPa/min时变化不大,随着升降压速率提高,细胞存活率迅速下降。

图6 升降压速率对面包酵母CICC1447 GSH合成的影响Fig.6 Effect of pressurization and depressurization rates on the synthesis of GSH of Saccharomyces cerevisiae CICC1447
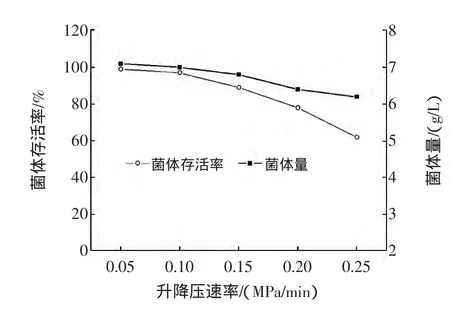
图7 升降压速率对面包酵母CICC1447的影响Fig.7 Effect of pressing and depressing rates on Saccharomyces cerevisiae CICC1447
升降压速率对GSH合成影响的主要原因在于菌体对压力变化速率的适应能力。升降压速率小,菌体有足够的时间来调节以适应压力变化,升降压速率过大后,菌体难以快速调节自适应系统使内外压力平衡,导致细胞死亡[18]。说明在升降压速率较低时酵母细胞可以通过自身调节适应压力变化[19]。升降压速率的变化在影响细胞存活率及细胞量的同时,也会改变菌体产生的应激性反应,升降压速率较低时促进GSH的积累,当升降压速率过大,菌体难以快速平衡内外压力而破裂死亡,进而影响了GSH的积累。
2.5 温和压力下PI与酵母胞内DNA结合产生的荧光强度变化
为证明压力是否造成细胞膜结构破坏,将常压下培养20 h的酵母CICC1447细胞于1.0 MPa、N2为加压介质条件下分别处理1 h和3 h,以常压处理为对照样,利用流式细胞术分析压力处理样品与对照样品PI荧光强度变化,结果表1。

表1 不同压力及时间下面包酵母CICC1447荧光强度的比较Table 1 Comparison of fluorescence intensities of Saccharomyces cerevisiae CICC1447 cells under different pressure and time
从表1显示常压对照组面包酵母CICC1447细胞1 h和3 h的细胞荧光强度分别为2.32和2.58。而在1.0 MPa下保持1 h和3 h,细胞荧光强度分别增加至2.47和2.93,较常压对照组分别提高了6%和13.56%。PI主要是与细胞核中的DNA结合产生荧光,其不能进入细胞膜完整的活细胞,当细胞死亡后细胞膜破损,PI可进入细胞与DNA结合,进而产生荧光信号。长时间压力处理对细胞影响较大,一方面压力处理可刺激细胞GSH产量的提高,但如果压力时间过长会破坏细胞膜结构,进而造成细胞死亡,从而降低GSH产量。
3 结论
以面包酵母CICC1447为研究对象,研究了不同的保压时间、压力、升降压速率及加压前培养时间对GSH生物合成量的影响,确定了保压时间6 h、压力0.5 MPa、升降压速率 0.05 MPa/min~0.10 MPa/min,GSH产量较常压提高了17.21%。流式细胞仪结果表明,温和压力短时间处理可刺激细胞的应激反应,提高GSH产量,但当较高压力长时间处理后,细胞膜破碎,细胞死亡,会降低GSH产量。
说明利用加压作为胁迫条件在一定条件下可以提高应激产物GSH的生物合成能力,这对提高谷胱甘肽产量有一定的指导意义。可以继续研究压力作用下GSH合成酶系酶活的变化,以便更深入地探讨加压应激反应作用机理。
[1] PENNINCKX M J,ELSKENS M T.Metabolism and functions of glutathione in micro-organisms[J] .Advances in Microbial Physiology,1993,34:239-301
[2] 贾贞,王丹,游松.谷胱甘肽的研究进展[J] .沈阳药科大学学报,2009,26(3):238-242
[3] 袁平戈,张大志.还原型谷胱甘肽的作用机制及临床应用[J] .药品评价,2006,3(5):385-390
[4] 刘超,袁建国,李峰.谷胱甘肽国内外研究进展[J] .山东食品发酵,2010(4):7-10
[5] 周宇光,付国平,肖仔君.谷胱甘肽的生产和应用研究进展[J] .食品工业科技,2003,24(3):89-91
[6] FUMIYOSHI ABE,CHIAKI KATO,KOKI HORIKOSHI.Pressureregulated metabolism in microorganisms[J] .Trends in Microbiology,1999,7(11):447-453
[7] WELCH T J,FAREWELL A,NEIDHARDT F C,et al.Stress response of Escherichia coli induced by elevated hydrostatic pressure[J] .Journal of Bacteriology,1993,175(22):7170-7177
[8] LEE J M,GIANCHANDANI E P,PAPIN J A.Flux balance analysis in the era of metabolomics[J] .Briefings in Bioinformatics,2006,7(2):140-150
[9] 范志华.压力对酵母菌及其产海藻糖的影响[D] .天津:天津科技大学,2004
[10] JANKOWSKA A,REPS A,PROSZEK A,et al.Influence of the high pressure on some biochemical properties of kefir microflora(effect of HPP on kefir microflora)[J] .High Pressure Research,2003,23(1):87-92
[11] 赵波,赵文杰,顾敏,等.硫酸铵与对酵母高密度发酵生产谷胱甘肽的影响[J] .中国医学工业杂志,2009,40(3):180-182
[12] 乔长晟,刘伯宁,徐旭,等.压力作用下面包酵母胞内谷胱甘肽和麦角固醇的变化[J] .中国生物工程杂志,2006,26(1):56-59
[13] 刘娟,王雅琴,刘刚,等.发酵液中还原型三种测定方法的改进及其比较[J] .北京化工大学学报,2004,31(3):37-38
[14] 范崇东,王淼.酵母细胞中GSH的微波辅助提取[J] .食品与发酵工业,2004,30(4):27-31
[15] 陈娜.压力对谷胱甘肽生物合成的影响及其分离提取工艺研究[D] .天津:天津科技大学,2008
[16] 肖安风,周祥山,周利,等.应用流式细胞术检测毕赤酵母的细胞活性[J] .微生物学通报,2006,33(6):22-26
[17] 乔长晟,贾士儒,徐旭,等.压力影响酵母海藻糖生成的初步研究[J] .食品科学,2005,26(5):34-37
[18] 姜岷,陈可泉,蔡婷,等.超高静压在琥珀酸生产菌株选育中应用[J] .微生物学通报,2008,35(4):561-564
[19] 周晓.反复间歇真空发酵过程中酿酒酵母适应性进化的系统分析[D] .天津:天津大学,2011
[20] 熊福星.酵母细胞酶法催化合成谷胱甘肽研究[D] .南昌:南昌大学,2012
[21] 刘娟,何秀萍,王雅琴.高产谷胱甘肽的酵母融合菌株的选育及其培养条件的研究[J] .微生物学通报,2003,43(1):99-103
