最终灭菌与非最终灭菌小容量注射剂工艺设计的探讨
2014-07-27廖锐仑
廖锐仑
广州康臣药业有限公司,广东广州 510168
无菌产品是指中国药典规定需要进行无菌项目检查的原料药和制剂。按照生产工艺的不同可将注射剂分为最终灭菌和非最终灭菌两种。而小容量注射剂是工业生产中常见的制剂。
最终灭菌和非最终灭菌两种剂型在生产工艺上有相近之处,但二者之间存在本质区别。其区别在于最终灭菌小容量注射剂是在药液灌装时完成灭菌的,而非最终灭菌注射液除了对于药液进行过滤除菌外,还需要对于操作的每个环节和步骤进行无菌控制。其中灌封和除菌过滤操作应该在无菌操作区中完成,这是二者在生产工艺环节中最大的区别。无菌药品的生产对于生产的环境、人员和设备的洁净等级要求必须符合GMP的要求。在生产过程中应避免药液的二次污染。下面就结合自身的工作经历讨论下最终灭菌和非最终灭菌在生产工艺上的差异。
1 设计的依据不同
1.1 对于生产环境洁净度的要求不同
根据《药品生产质量管理规范(2010年修订)》附录中对于无菌药品的要求。小容量注射剂采用联动线进行操作时,由于灭菌烘箱和灌封机带有A级洁净区系统,洗瓶在D级的操作环境下,灌封操作则在C级洁净区背境下的A级洁净区操作,就能够达到最终灭菌药品的环境要求。而对于采用非最终灭菌操作的药品,洗瓶时在D级的操作环境下,灌封操作只允许在B级洁净操作环境下采用局部A级洁净区操作。
1.2 对于着装要求不同
对于工作服的式样、选材和穿戴方式,《药品生产质量管理规范(2010年修订)》中做了详细的规定。即工作服的洁净等级必须和空气洁净等级和操作环境相适应。无菌操作区的工作服不能与非无菌操作的工作服混淆,并且在清洗、灭菌时应分开进行。同时,对无菌工作服表面颗粒控制性和微生物方面要求(建议符合IEST-RP-CC 003.3《洁净室及相关受控环境:服装要素》)、无菌手套的无菌无粉性甚至于工作服折叠方式(便于操作人员的无菌更衣)的要求也远远高于非无菌工作服。
1.3 对于灭菌操作区的要求不同
由于A级、B级、C级、D级操作区的洁净等级和微生物动态控制的差异性,当物料、设备、容器具等物品从C级洁净区进入洁净等级高的洁净区(如B进入级洁净区)要进行严格的消毒灭菌等相关操作,并且保证在期间的传递中不受到二次污染。这是GMP对于采用非最终灭菌操作的药品做了相关的规定。
2 工艺设计方面的差异
2.1 在平面布局上的差异
最终灭菌和非最终灭菌药品在制备中大部分均采用以安瓿为内包材进行洗烘灌的生产工艺。在上述两者当中,最大的区别是非最终灭菌的药品在灌封、除菌过滤的工序中要在无菌的环境下(B级背景下的局部A级洁净区)进行操作。在这两步重要的工序中对于人员、药液、器具和设备的净化都有较严格的要求。首先,人员进入B级操作区,通过换穿经灭菌处理的专用洁净服及鞋。由于与其他洁净级别上的要求不同,所以进入B级洁净区操作人员不能与其他的操作员弄混衣服,尤其是B级洁净区的工作服需测试其发尘量是否符合洁净区标准,不会对洁净区造成二次污染。厂房有设置供进入B级洁净区独立的人员进出系统,保证进入B级洁净区的人员不会与离开的操作工同时更衣造成污染。其次是对药液的净化,按照国家药品的生产管理规范要求,对于小容量注射剂的最终灭菌操作其空气的洁净程度及微生物控制的要求均比非最终灭菌操作的要低。
药液配制方面,最终灭菌产品与非最终灭菌产品的配制也有如下区别:
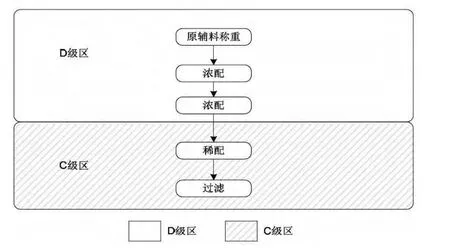
最终灭菌产品的工艺流程
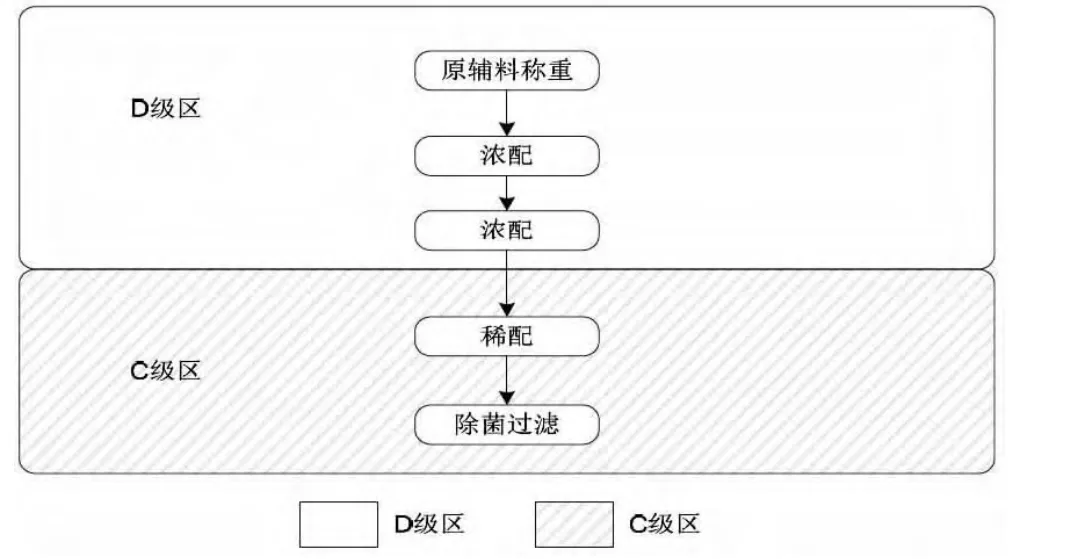
非最终灭菌产品的工艺流程
但如果产品不能进行除菌过滤的,则需要在B级洁净环境下的A级洁净区内进行配制。
对于非最终灭菌产品操作,如药液的配制、除菌过滤、灌装对于空气的洁净等级都要比最终灭菌操作的空气的洁净程度要高一个级别以上(例如:非最终灭菌产品的灌装背景为ISO等级5,而最终灭菌产品的灌装背景为ISO等级7)。
一般来说,能进行除菌过滤的产品,我们均会在生产时把药液配制和除菌过滤这两种工序分隔开来,使用管道将配制好的药液经两级0.22um除菌过滤器除菌过滤送入无菌操作区。最后对于器具和设备的净化处理,非最终灭菌操作的小容量注射剂较最终灭菌操作的注射剂要求更严格,这就需要厂房要有独立存放无菌操作区的器具和设备的车间。从非无菌生产区到无菌生产区之间要设立专用的物流通道,例如传进物料与传出废弃物应设置不同的传递窗,从而避免物料在同一传递窗内出现交叉污染的情况。
3.2 关于设备选型的差异
对于在工艺设计中,最终灭菌的注射液在生产过程中会采用检漏灭菌一体化的仪器进行安瓿的灭菌和检漏操作,而对于非最终灭菌的药液则不需要灭菌,只需要进行检漏操作即可。值得注意的是,无论最终灭菌产品或非最终灭菌产品,在检漏过程中都应避免由于检漏过程而造成的二次污染,《药品生产质量管理规范(2010年修订)》也明确检漏用的介质至少应为纯化水,但个人认为在技术不断发展的今天,可以考虑使用高压电检漏或,这两种方式既能达到检漏目的又能避免检漏用水对产品的二次污染。同时,逐支真空检漏这一方式也得到欧盟、FDA的确认,只是目前国内以食品行业使用该类设备较多,在制药行业尚未得到较多的关注。
4 总结
注射剂作为各种剂型中较为重要的制剂,在临床应用上有着别的剂型不可替代的作用。因此工业中对于注射剂的生产工艺和质量要求更为严格。其中对于注射液在热源、澄清度、渗透压、酸碱度、微生物数控制上都有严格的要求。本文从设计的依据、平面布局、设备选型方面出发对于最终灭菌和非最终灭菌的小容量注射剂进行了工艺设计差异性的探究讨论,希望能够为小容量注射剂的生产提供依据,为企业能够生产出符合国家标准的产品提供参考。
[1]国家药品监督管理局.药品生产质量管理规范(2010年修订)及附录[S].
[2]国际药典委员会.中华人民共和国药典2000年版二部[S].化学工业出版社.
[3]医药工业洁净厂房设计规范(2000年修订)征求意见稿2[M].2版.北京:化学工业出版社.
[4]黄健华.洁净室服装系统要素[J].洁净室,2010(6).
