光照和肌醇对木霉生长和产脂能力影响
2014-07-12梁峰王莉苑嫒宋兆齐刘秀花
梁峰,王莉,苑嫒,宋兆齐,刘秀花
(1.商丘师范学院生物精炼河南省工程实验室,河南商丘476000;2.商丘师范学院生命科学学院,河南商丘476000)
光照和肌醇对木霉生长和产脂能力影响
梁峰1,王莉2,苑嫒2,宋兆齐2,刘秀花2
(1.商丘师范学院生物精炼河南省工程实验室,河南商丘476000;2.商丘师范学院生命科学学院,河南商丘476000)
木霉菌的许多种属都能够产生脂类物质,并且已经被用来研究脂类物质的生产.本研究主要探索光照和肌醇对木霉生物量积累和油脂量积累的作用.结果表明:与遮光处理组相比,正常光照培养条件更易于菌株成熟孢子的形成,并且正常光照培养也利于菌株L1生物量和油脂量的积累;肌醇的添加会促进菌株生物量的积累,但是对菌株L1油脂量的积累有一定的抑制作用,对菌株L2,相比无肌醇添加组,肌醇的添加在一定的培养时间上有利于油脂的形成.同时发现光照和肌醇能够影响木霉的脂类构成.
霉菌;黑暗;肌醇;中性脂;生物柴油
微生物油脂(microbial oil)又称单细胞油脂(single cell oil,SCO),是由酵母、霉菌、细菌和藻类等微生物在一定条件下将碳水化合物、碳氢化合物和普通油脂等碳源转化为菌体内大量贮存的油脂及一些具有特殊功能的脂质.某些微生物在一定条件下能将碳水化合物、碳氢化合物和普通油脂等转化为菌体内大量贮存的油脂,如果油脂含量超过细胞干重的20%,则此微生物称为产油微生物.利用产油微生物生产生物柴油是一项具有广泛应用前景的技术.
1980年WIDDENP等[1]研究发现,木霉在土壤生物量中占有较大的比例,较易分离获得[2].木霉菌的许多种属已经被用来研究脂类物质的产生,木霉所能产生的脂肪酸种类主要为16C饱和脂肪酸,18C单不饱和脂肪酸和18C多不饱和脂肪酸等[3].目前国内外利用微生物发酵作物秸秆生产微生物油脂存在两大瓶颈[4].第一,秸秆的主要成分木质纤维素难以被降解,利用效率很低;第二,用于大规模生产微生物油脂的微生物一般不能利用木质纤维素生长,只能利用简单的营养物质(淀粉、葡萄糖等)生长发育,生产成本较高.因此,要想利用微生物转化农作物秸秆生产生物柴油(biodiesel),必须首先解决好这两方面的问题.因此找到一种既能高效降解木质纤维素又能将分解木质纤维素获得的单糖有效地转化为脂类物质的微生物成为解决这两方面问题的关键.研究发现木霉能分泌纤维素酶、半纤维素酶和木质素酶,且酶稳定性较好,并能产生和积累微生物油脂[5],因此,利用木霉开展微生物柴油的研究具有重要理论意义和实用价值.
肌醇(inositol)广泛存在于各种天然动物、植物及微生物组织中[6],是一种“生物活素”,参与生物体内的新陈代谢活动,用于多种菌种的培养和促进霉菌的增长[7-8].本文报道了光照和肌醇对木霉的脂类代谢与积累的影响.
1 材料与方法
1.1 研究材料与培养基
本实验所使用的菌株是两株木霉,分别标记为L1、L2,由本实验室分离保存.研究使用GMY液体培养基[9-10](1 L含KH2PO48 g,MgSO4·7H2O 0.5 g,Glucose 40 g,Yeast extract 3 g,调 pH=5.5);GMY 液体 1 L 加琼脂 15 ~20 g得到固体培养基,GMY-肌醇液体培养基中肌醇(过滤除菌)含量为1 mg/1mL,其它成分同GMY液体培养基.
1.2 研究方法
1.2.1 平板培养与遮光处理
取孢子悬液1小环点种平板中央,置培养箱中37℃恒温培养.L1和L2分别分成2组,正常光照培养和黑暗培养.每组接种3块平板,分别于培养1 d、2 d、3 d时取出观察菌落形态和孢子的形成情况,拍照.
1.2.2 摇瓶培养
取GMY40液体培养基100 mL至250 mL三角瓶中,每瓶接种孢子量约为107个,225 rpm摇床28℃恒温培养.木霉L1设黑暗培养和添加肌醇2个实验组,L2只做添加肌醇处理处理.
1.2.3 脂肪粒染色与观察
摇瓶培养时间达到1 d、2 d、3 d的时候,分别挑取不同处理方式下的菌丝体进行苏丹黑染色[11]显示细胞内脂肪粒,显微摄影获得图片.根据菌丝体中脂肪粒的大小和密度定性判断两株霉菌在不同培养时间和培养条件下的脂肪粒积累情况.
1.2.4 生物量测定
培养时间分别达到1 d、2 d、3 d时,将不同处理方法的摇瓶取出,菌丝体挑取完成后,抽滤、冻干得干菌体.
1.2.5 脂肪含量测定
分别采用索氏抽提法[12]热酸解[13]提取微生物油脂.提取的油脂经重量分析后,用石油醚从提取瓶中溶出并定容备用.
1.2.6 油脂薄层层析(TLC)[14]
2 结果与分析
2.1 光照对两株木霉L1、L2生长和产脂能力的影响
正常光照处理和遮光处理对两株木霉L1、L2生长和产孢子能力的影响较大.如图1所示,培养2 d后,L1遮光与自然光照条件下都能长满平板并出现成熟孢子,光照条件下生长情况要快于遮光处理,成熟孢子的形成更加明显;L2两种处理下2 d尚未出现成熟孢子.培养3 d后,L1两种培养条件下的进一步生长,成熟孢子大面积形成,但是正常光照条件仍然优于遮光;正常光照培养条件下的L2已经出现成熟孢子,黑暗培养条件下尚无成熟孢子的出现.由L1、L2的生长情况可以得知,光照条件下有利于成熟孢子的形成,光照有利于木霉的生长与繁殖.
2.1.1 光照对菌株L1细胞脂肪粒形成的影响
木霉L1菌株在液体GMY震荡培养时完全黑暗和正常光照不同条件下细胞内脂肪粒的数量和大小有一定的变化.如图2所示,经苏丹黑染液染色后,脂肪颗粒被染成蓝黑色,颗粒的大小和多少代表油脂积累的程度.可以看出,随着发酵时间的延长,两种处理条件下的油脂颗粒的体积都会变大、数量都会增多.但是同一培养时间点正常光照培养条件下L1菌丝体中的脂肪粒较遮光条件下的数量多体积大,即油脂含量高,说明正常光照促进油脂颗粒的形成.
2.2 肌醇对木霉L1、L2脂肪粒形成的影响
肌醇对菌株L1脂肪粒形成有一定的影响.如图2所示,L1在GMY培养基和添加肌醇(1mg/1mL)的GMY培养基中震荡培养,随着发酵时间的延长油脂颗粒的体积都会变大、数量都会增多.但是同一时间点在正常光照培养条件下且无肌醇添加时,L1菌丝体中的蓝黑色颗粒较多,即油脂含量高,说明肌醇的添加会减少油脂颗粒的形成.
肌醇对菌株L2脂肪粒形成有一定的影响.图2可以看出,随着发酵时间的延长,油脂颗粒体积会变大、数量会增多,并且培养时间分别为1 d、3 d时,均是在正常光照培养条件下且无肌醇添加时,L2菌丝体中的蓝黑色颗粒较多,即油脂含量高,但是培养时间为3 d时,菌株L2在以含有肌醇的培养基中,脂肪颗粒的体积较另一组大;培养时间为2 d时,菌株L2在以含有肌醇的培养基中,脂肪颗粒的数量较另一组多,即油脂含量高.
2.3 光照和肌醇对木霉生物量的影响
光照对L1的生物量影响不大,而肌醇对菌株L1生物量的影响在培养的后期较明显.如图3所示,菌株L1在三种处理条件下,随着发酵时间的增加,生物量越来越多.与正常培养条件组相比,添加肌醇后,培养时间为1 d时,二者生物量无明显差异;2 d时生物量略高于正常培养;3 d时肌醇组生物量明显高于正常培养组是前者的1.16倍.黑暗培养与正常培养相比,在不同时间点生物量均无较大差别.
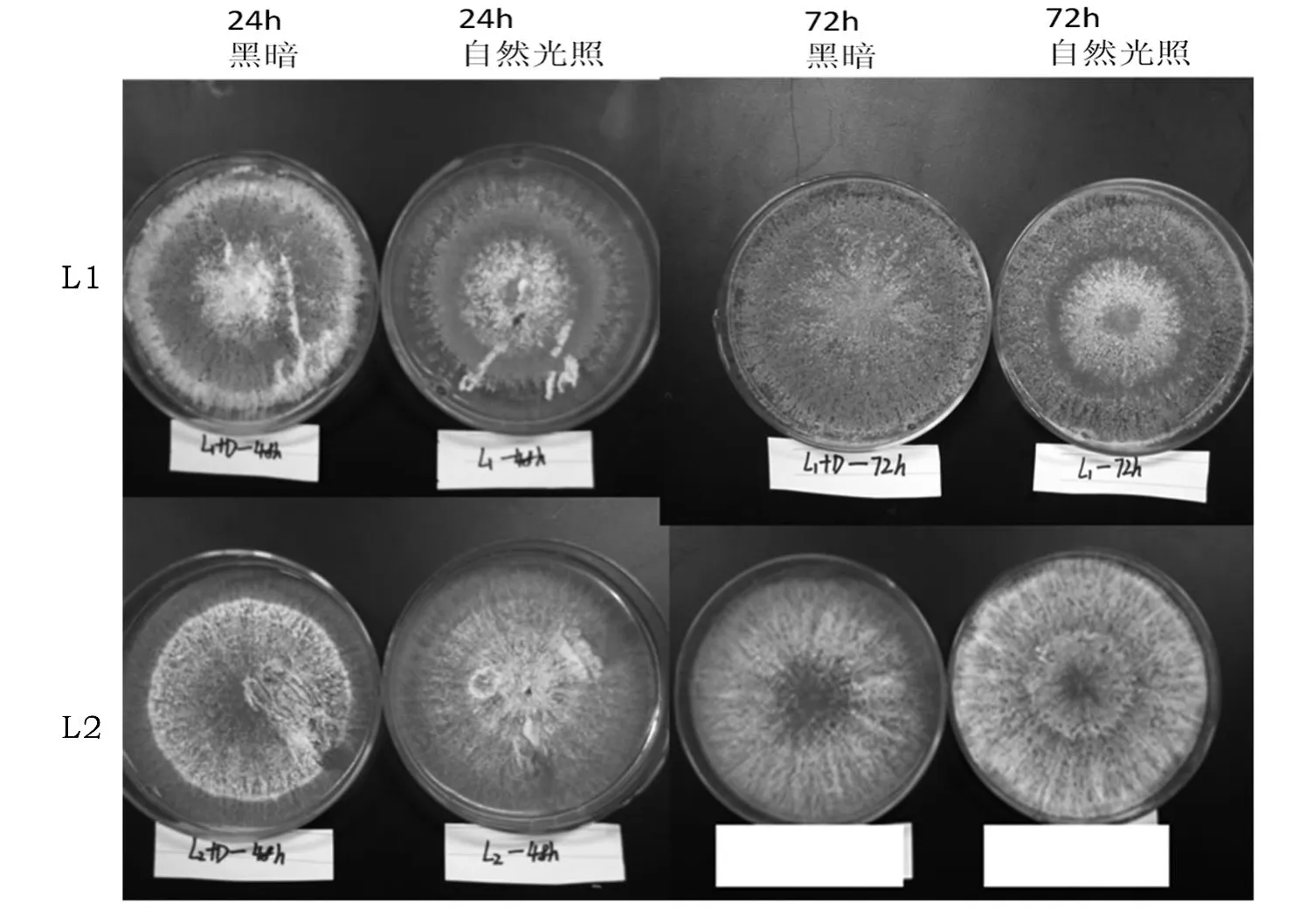
图1 光照对L1、L2生长能力的影响Figure 1 The influence of light on growth ability of strain L1、L2
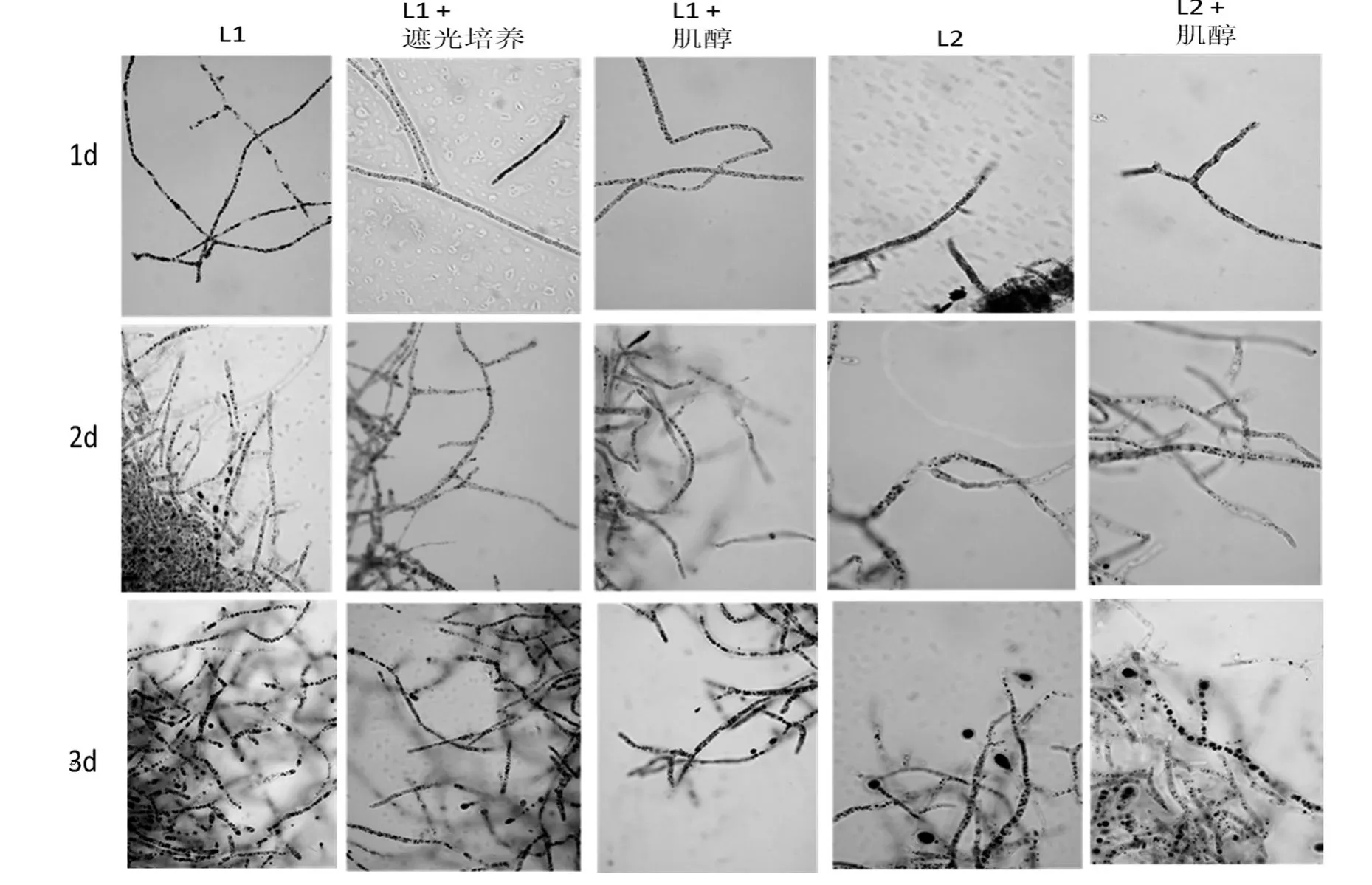
图2 木霉L1和L2菌体细胞脂肪粒显微图片菌株Figure 2 Micrographs of cells with lipid globules of strain L1 and L2
肌醇对菌株L2生物量影响的较小.如图4所示,菌株L2,在两种处理条件下,随着发酵时间的增加,生物量越来越多,并且添加肌醇后,在培养时间为2 d、3 d时,肌醇添加组生物量都略高于对照组.
2.4 光照和肌醇对木霉产脂能力的影响
光照和肌醇对菌株L1油脂产量都有明显的抑制作用.由图5可以看出,菌株L1在三种处理条件下,随着发酵时间的增加,油脂产量越来越高,与图2、图3苏丹黑染色结果吻合.与正常组相比,添加肌醇后,培养时间为1 d时,二者油脂产量无明显差异;2 d时,正常培养油脂产量明显高于肌醇添加组,是后者的1.97倍;3 d时是后者的的1.63倍.说明1mg/mL肌醇的添加不利于脂肪颗粒的形成.黑暗组与正常培养组相比,在培养时间为1 d时,前者油脂产量略高;但是,2 d时反而正常培养组是遮光组的2.79倍;3 d时是遮光组的2.07倍.说明在培养时间段的后续培养中,遮光处理不利于脂肪颗粒的形成.
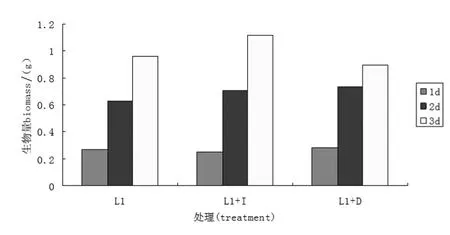
图3 光照和肌醇对L1菌株生物量的影响Figure 3 Light and inositol impact on the biomass of L1 strains
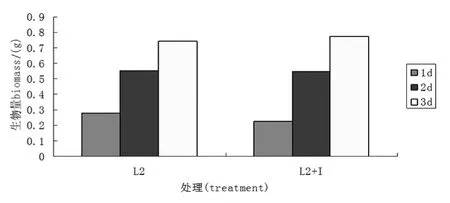
图4 肌醇对L2菌株生物量的影响Figure 4 Inositol impact on the biomass of L2 strains
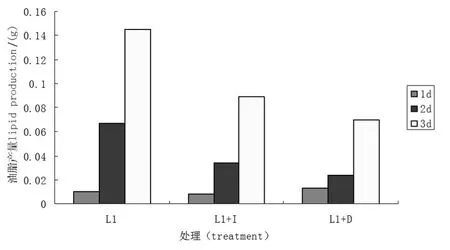
图5 光照和肌醇对L1菌株油脂产量的影响Figure 5 Light and inositol impact on the lipid production of L1 strains
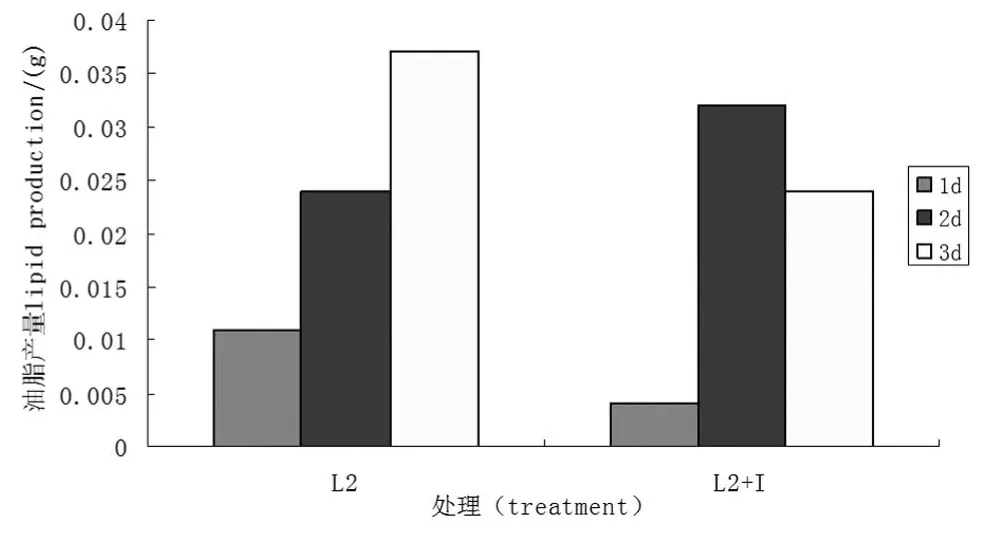
图6 肌醇对L2菌株油脂产量的影响Figure 6 Inositol impact on the lipid production of L2 strains
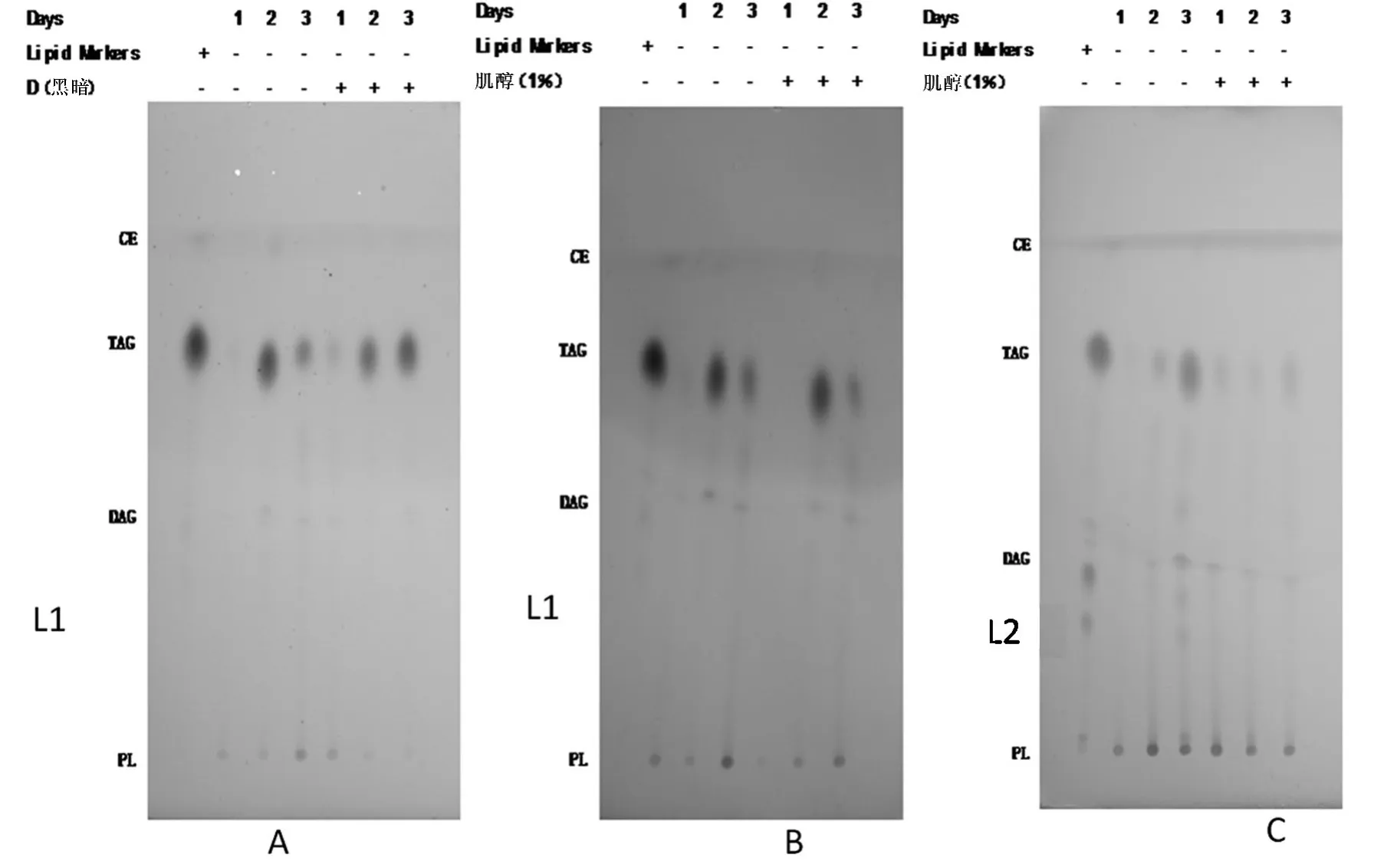
图7 索氏提取得菌株L1中性脂的薄层层析图谱Figure 7 TLC of L1 non-polar lipids of Soxhlet extraction
CE:胆固醇脂;TAG:三油酸甘油脂(甘油三酯);DAG:二油酸甘油脂(甘油二酯);PL:磷脂;“+”表示实验采用该处理方式,“-”表示实验未采用该处理方式.
肌醇对木霉L2油脂产量影响呈现早期促进后期抑制的现象,但影响程度没有L1的大.由图6可以看出正常培养油脂产量随时间的增加而增高,而添加肌醇时,培养时间为3 d时,油脂产量较2 d时低,与图2苏丹黑染色结果吻合.1 d时,正常组油脂产量是肌醇组的2.75倍;2 d时肌醇组油脂产量是正常组的1.33倍;3 d时,正常组油脂产量是添加组的1.54倍.说明在特定的培养时间段肌醇在木霉产脂能力上的调控,对菌株L2的调控不同于菌株L1,对菌株L2的调控在早期就显现出来.
2.5 光照和肌醇对木霉油脂成分的影响
由图7可以看出,三种条件下的菌株L1中油脂的主要成分是甘油三酯和磷脂,正常组甘油三酯的含量是先增加后减少,磷脂的含量是先减少后增加;与正常组相比黑暗组甘油三酯的含量是一直增加,磷脂的含量是一直减少(图7A);与正常组组相同,添加肌醇组甘油三酯的含量也是先增加后减少,磷脂的含量却是一直增加(图7B).
由图7C所示,L2在两种条件下的菌株中油脂的主要成分是甘油三酯和磷脂,正常组甘油三酯的含量是一直增加,磷脂的含量是一直减少;与正常组相同,添加肌醇组甘油三酯的含量也是一直增加,磷脂的含量是一直减少.
3 讨论
平板培养菌株L1在培养时间为3 d时,两种培养条件下的L1虽然都有成熟孢子形成,但是与正常光照组相比,可以明显看出遮光培养条件不利于木霉成熟孢子的形成,即不利于木霉的生长.菌株L2的培养情况可以进一步证实该结论.
摇瓶培养时,由显微镜下的镜检图像显示,与正常光照组相比,遮光处理下,菌丝体内的蓝黑色颗粒较少,说明遮光处理不利于油脂颗粒的积累;从油脂量的定量分析上,2 d时,无论是定性还是定量,都可以得出遮光处理不利于油脂颗粒的积累.摇瓶培养条件下,对于菌株L1,与正常光照组相比,肌醇添加后菌丝体内的蓝黑色颗粒较少,说明肌醇的添加不利于油脂颗粒的积累;从油脂量的定量分析上,无论是定性还是定量,都可以得出肌醇的添加不利于菌株L1油脂颗粒的积累.肌醇对菌株L2产脂能力的影响不同于L1,肌醇对菌株L2的调控在早期就显现出来.
进一步研究多个木霉菌株可以验证上述推断是否在木霉属真菌有普遍性.本文只研究了黑暗条件和100 mg/100 mL肌醇浓度对菌株L1和L2生长和产脂能力的影响,可以进一步研究更高浓度或更低浓度的肌醇或遮光处理中给予间断光照刺激对木霉生长和产脂能力的影响,以找到发酵产脂的最佳工艺方案,从而获得最好的微生物油脂产品.
[1] Widden P,Abitbol J.Seasonality of Trichoderma species in aspruce-forest soil[J].Mycologia,1980,72:775 -784.
[2] 杨合同.木霉的分类与鉴定[M].北京:中国大地出版社,2009.374-378.
[3] Ruiz N,Dubois N ,Wielgosz-Collin G.Lipid content and fatty acid composition of a marine derived Trichoderma Longibrachiatum strain cultured by agar surface and submerged fermentations[J].Process Biochem,2007,42(4):673-680.
[4] Ratledge C.Microbial Lipids Vol 2[M].London:Academic Press,l989.567 -668.
[5] K S Tyson.Biodiesel research pmgress 1992—1997[J].NREL Technical Report,NRER/TP -580-24443,1998.
[6] 汪多仁.肌醇的开发与应用进展[J].化工中间体,2002(18119):23-25.
[7] 刘晓勇,钱和,刘建利.肌醇研究近况与展望[J].江苏食品与发酵,2003(4):7-10.
[8] 黄海东,赵良启,李晓雁.筛选聚羟基烷酸产生菌的一种方法[J].生物技术,2004,14(2):29-30.
[9] Fisher D B,Wang N.Sucrose Concentration Gradients along the Post-Phloem Transport Pathway in the Maternal Tissues of Developing.Detection of cerebral myo-inositol[J].Febsletters,1995,18(1):107 - 172.
[10] Shi Y,Shu L,Su S.Juvenile tilapia or eochromisnilocus O reochnm is requirements dielay myo-inositol for maximal growth[J].Aquaculture,2005,243:273-277.
[11] 刘波,孙艳,刘永红.产油微生物油脂生物合成与代谢调控研究进展[J].微生物学报,2005,45(1):153-156.
[12] Betina V,Koman V.Changes in the Lipid Composition during the Photo - Induced Conidiation of Trichoderma viride[J].Folia Microbiol,1980,25:295 -300.
[13] 阮元,李文.索氏提取法测定农产品中脂肪含量实验中的几个注意事项[J].农家之友,2009(11):18-19.
[14] 姚乾元.薄层层析法及其应用[J].化学通报,1962(8):9-15.
Light and inositol effect on the growth and lipid production of two trichoderma sp.strains
LIANG Feng1,WANG Li2,YUAN Ai2,SONG Zhaoqi2,LIU Xiuhua2
(1.Biorefinery Engineering Lab of Hena Province,Shangqiu Normal University,Shangqiu 476000,China;2.Department of Life Science,Shangqiu Normal University,Shangqiu 476000,China)
The method of microbial biosynthesis in vivo in order for the preparation of Microbial Oil is a new path in development of oil resources.In order to optimize the fermentation conditions,first,the experiment use cell morphological and cytochemical methods(Sudan Black staining)for primary screening of two Trichoderma strains under different culture conditions.The results show that:under normal lighting culture conditions ,L1 strain grows by GMY40 liquid medium for the culture medium,pH 5.5,28℃ fermentation for 3 days,bringing about microbial fat content 15.11%,the biomass 9.62 g/L,oil yield 1.45 g/L .Coordinate expression is that Light and inositol can affect the lipid composition of Trichoderma by TLC analyze method.
mycete;darkness;inositol;neutral lipide;biodiesel
2014-04-15;
2014-04-22
梁峰(1966-),男,河南永城人,商丘师范学院教授,博士,主要从事生物质能源的研究.
Q939.21+7
A
1672-3600(2014)06-0060-05
【责任编辑:徐明忠】
