预处理对木质纤维素生物质细胞壁超微结构的影响
2014-06-24吉喆凌喆张逊马建峰许凤
吉喆,凌喆,张逊,马建峰,许凤
北京林业大学林木生物质化学北京市重点实验室,北京 100083
预处理对木质纤维素生物质细胞壁超微结构的影响
吉喆,凌喆,张逊,马建峰,许凤
北京林业大学林木生物质化学北京市重点实验室,北京 100083
预处理是提高木质纤维素生物质向生物燃料转化的有效途径,但生物质的天然抗降解屏障严重阻碍了这一转化的进行,因此全面了解预处理过程中植物细胞壁的微观结构及区域化学变化是实现农林生物质高效转化的基础。本文总结了多种预处理方法对植物细胞壁超微结构影响的研究进展,对生物质科学研究可能有一定的促进和指导作用。
生物质预处理,组分分布,微观结构,纤维素,半纤维素,木质素,酶水解
木质纤维素生物质 (Ligncocellulosic biomass) 资源丰富,具有可再生性。利用木质纤维原料生产燃料乙醇等功能性产品,为人类降低对化石燃料的依赖、缓解全球气候变暖提供了可能[1-2]。生物质的转化通常包括3个步骤:1) 生物质预处理; 2) 纤维素和半纤维素水解为可发酵的单糖;3) 将单糖发酵为燃料乙醇。然而,当前生物质向燃料乙醇和化学品的转化仍存在高成本、低效率等问题,其中原料预处理技术的不成熟成为了限制木质纤维素生物质高值化利用的瓶颈之一,这主要是由于植物纤维原料中组分分布不均一性和细胞壁的结构复杂性,使生物质难以被降解[2]。因此,从细胞及分子水平全面研究生物质预处理机理,以及预处理过程中植物细胞壁的微观结构和区域化学变化是实现农林生物质高效转化的有效途径。本文总结了多种具有发展前景的预处理方法,从细胞水平就生物质预处理如何引起生物质主要组分在细胞壁不同微区的改变,如何破坏纤维素、半纤维素和木质素之间的联结,从而提高后续酶水解糖化效率等问题进行了总结归纳,以期为木质纤维素生物质转化领域的科学研究提供一定的促进和指导作用。
1 预处理的必要性
质素相互交联覆盖于纤维素表面,形成致密的保护层,阻碍了酶对纤维素的可及性。如图1所示,植物细胞壁由多层结构组成,各壁层中组分分布差异较大,其中细胞角隅区域木质素浓度最高,复合胞间层次之,次生壁层最低;而纤维素的分布情况与木质素相反,次生壁层纤维素浓度最高,其次是复合胞间层,细胞角隅区域纤维素浓度最低[3-6]。植物细胞壁的结构复杂性和组分分布不均一性构成了生物质转化过程中的天然抗降解屏障,严重阻碍了木质纤维素生物质向燃料乙醇的生物转化。

图1 构树纤维细胞透射电镜图像和木质素分布拉曼成像[3](A:用1%高锰酸钾对构树超薄切片进行染色,在透射电镜图像中可根据颜色深浅区分细胞壁的分层结构及木质化程度,细胞角隅区域和复合胞间层木质化程度较次生壁高;B:构树纤维细胞壁中木质素分布拉曼成像,细胞角隅区域和复合胞间层木质素浓度较次生壁高;CC:细胞角隅区域;CML:复合胞间层;S:次生壁 (S1, S2, S3))Fig. 1 TEM micrograph of an ultrathin transverse section of Broussonetia papyrifera fiber cell wall[3]. The dense staining of the CC and CML indicates that both of them are strongly lignified. (A) CC, cell corner; CML, compound middle lamella; S1, outer secondary wall; S2, middle secondary wall; S3, inner secondary wall. (B) Raman image of lignin distribution in Broussonetia papyrifera cell wall.
木质纤维原料主要包含纤维素、半纤维素、木质素和少量的果胶。纤维素是由葡萄糖通过β-1,4 糖苷键联结而成的线性高分子聚合物,常以聚集态存在构成晶体结构;半纤维素与木
因此,生物质进行酶水解之前需要先进行预处理,其目的是通过破坏植物细胞壁的原本结构,分离或脱除部分木质素,降低纤维素结晶度,增加原料底物的孔隙率,从而提高酶对纤维素的可及性,以促进纤维素和半纤维素向单糖的转化[7]。一般来讲,理想的预处理技术需要满足以下几点:1) 避免碳水化合物的降解或损失;2) 提高多糖转化率;3) 避免产生对后续酶水解及发酵过程起抑制作用的化合物;4) 避免使用对环境污染严重和反应器材质高要求的化学试剂;5) 性价比高[8]。目前使用较多的预处理方法包括物理法、化学法、物理-化学法、生物法[9-11]。
2 化学预处理
2.1 稀酸及热水预处理
稀酸预处理一般是用浓度低于10%的硫酸、盐酸、磷酸等催化剂处理生物质,通过脱除生物质组分中的半纤维素和少量木质素,以提高酶水解效率。而热水预处理则是在不添加任何催化剂的情况下通过溶解生物质组分中的半纤维素来增加纤维酶的可及性从而增加酶水解的效率。
Abud等[12]研究了稀H2SO4预处理甘蔗Sugarcane过程中纤维素微纤丝形态学的变化。原子力显微镜 (AFM) 成像结果表明,不同细胞区域纤维素微纤丝取向和木质素浓度存在差异性,且稀酸预处理对纤维素微纤丝的影响呈不均一性。总言之,稀酸预处理后纤维素微纤丝排列方向未发生改变,但原有的纤维层状结构消失,细胞表面伴随球状颗粒的形成。部分研究发现当处理温度超过木质素的玻璃态转化温度时,木质素由固态转为熔融状态,进而重聚缩合成为富含木质素的球状颗粒,附着于细胞表面[13-14]。然而,Hu 等[15]在稀酸处理杨木Populus trichocarpa x deltoids综纤维素的研究中证实,这些球状颗粒是由碳水化合物和木质素降解产物共同组成的假木素 (Pesudolignin)。Donohoe等[16]进一步研究了该球状颗粒的形成机理,发现在稀酸预处理之后的玉米秸秆Corn stover和柳枝稷Switchgrass中,球状颗粒主要聚集在胞间层、纹孔及细胞次生壁各个亚层之间,并通过纹孔区域被挤压到细胞壁表面。Li等[17]研究发现假木素可能会与纤维素酶产生不可逆的非功能性吸附,降低纤维素酶的有效性,从而对后续酶水解产生抑制作用。这说明木质素的脱除与重排对后续酶水解的影响同等重要。
在草类原料中,羟基肉桂酸(Hydroxycinnamic acids) 作为木质素与半纤维素结合的交联聚合物,使细胞壁的结构更加致密牢固,加剧了酶对纤维素吸附的困难程度[18]。Belmokhtar等[19]研究了稀酸预处理对奇岗Miscanthus x giganteus细胞壁形态学和羟基肉桂酸分布的影响,结果表明稀酸预处理会使细胞壁发生轻微润胀,并脱除了绝大部分的羟基肉桂酸,但不同细胞组织各亚层之间其溶出速率存在较大差异。
稀酸及热水预处理的作用主要是脱除半纤维素,而木聚糖作为半纤维素的重要组分之一,其相关研究备受关注。Brunecky等[20]利用免疫荧光标记技术 (Immunofluorescence labeling)研究了稀酸预处理前后玉米秸秆中木聚糖的分布规律变化,结果表明稀酸预处理过程中,茎部组织厚壁细胞次生壁中层 (S2) 的木聚糖含量快速下降,而细胞壁内侧 (与细胞腔交界处)和胞间层木聚糖含量稍有上升,说明细胞内的木聚糖在被完全溶解到溶液之前,在细胞内发生了迁移,聚集在细胞边缘 (图2)。DeMartini等[21]研究了杨木在热水预处理过程中半纤维素多糖溶出规律,结果显示随着处理强度的增强,聚阿拉伯糖半乳糖和果胶率先溶出,其次是木聚糖及木葡聚糖,而木质素最后溶出,这表明在杨木细胞壁中木素与碳水化物之间的键合紧密牢固,是引起生物质抗降解的主要原因。
2.2 碱性预处理
碱性预处理的作用主要是打断木质素与半纤维素之间的键合,脱除大量木质素与部分半纤维素以增加酶对纤维素的可及性,从而提高酶水解效率。其中氢氧化钠 (NaOH) 和氨液预处理的应用较为广泛。
图2 热水预处理过程中玉米秸秆细胞壁中木聚糖分布免疫标记 (LM11抗体) 荧光图像[20](A:对照组;B:140 ℃预处理2 min样品脱除约25%木聚糖;C:140℃预处理10 min样品脱除约60%木聚糖;D:140 ℃预处理20 min样品脱除约77%木聚糖;放大600倍) Fig. 2 Sections of cross sections stained with LM11 xylan antibody well as signal intensity surface maps of (A) native CS; (B) 140 ℃, 2 min (25% xylan removed); (C) 140 ℃, 10 min (60% xylan removed); (D) 140 ℃, 20 min (77% xylan removed) illustrate the progressive loss of xylan from the centre of the cell wall, and its retention in the middle lamella and lumen of the cells[20].
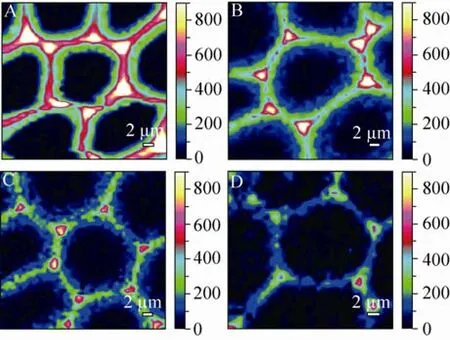
图3 NaOH预处理过程中杨木纤维细胞壁木质素分布拉曼成像比较 (A:对照组;B:20 min;C:60 min;D:90 min)Fig. 3 The Raman images of lignin distribution in poplar fiber walls during sodium hydroxide pretreatment at different residence times of 0 (A), 20 (B), 60 (C), and 90 min (D). The rapid loss of Raman intensity in the secondary cell wall along the increased residence time suggests a preferential removal of lignin from these regions.
Chu等[22]利用共聚焦拉曼显微成像技术研究了NaOH 预处理前后芒草Miscanthus薄壁细胞壁中组分分布变化,发现对照组中纤维素与木质素共存,并有木质素-半纤维素复合体球状结构存在于细胞内壁;经NaOH预处理之后,木质素优先从细胞壁内侧脱除,而纤维素的晶型结构未发生改变,细胞壁内侧球状结构仍然存在,但经拉曼光谱分析证实其内部包含部分蜡质。笔者在对杨木进行NaOH预处理时,也同样发现细胞次生壁优先脱除木质素(图3),从形态学分析这可能是由于细胞腔的存在使溶液与细胞壁内侧接触面积更大,更易渗透而导致的;从化学角度分析,细胞壁次生壁富含直线型S木质素,在碱性条件下木质素之间的β-O-4键更易发生断裂从而被脱除[23]。
Rezende等[24]研究了NaOH预处理过程中甘蔗细胞壁的形态学变化,发现随着处理条件的增强,细胞壁中的大部分木质素被脱除,从而暴露出更多的纤维,由于润胀作用部分纤维束发生弯曲,甚至被剥离。Ben Sghaier等[25]利用SEM及AFM在纳米水平进一步研究了NaOH预处理对龙舌兰Agave americana L. 细胞壁微观结构的影响,SEM结果表明预处理之后,除了细胞壁中的木质素被脱除,纤维束变得疏松被过分暴露之外,随着处理强度的增加,还有部分薄壁细胞被脱除;AFM 研究也证实了预处理过程中细胞表面原有的层状结构被剥离,表面粗糙度降低,这很可能与木质素和半纤维素的移除有关。在相关研究中,经NaOH预处理后的生物质原料,其酶水解效率均有显著提高[26-28],这一结果可以通过以上细胞壁的微观变化得以解释。
Belmokhtar等[19]研究了液氨浸渍 (Soaking in aqueous ammonia, SAA) 预处理对奇岗节间组织的影响,发现预处理过程中,包裹在纤维素微纤丝外侧的木质素与半纤维素被疏松,纤维素之间的氢键被打断,结晶度降低,从而导致奇岗表皮厚壁细胞、维管厚壁细胞和薄壁细胞发生了明显润胀;另外还发现液氨脱木质素作用主要发生在表皮厚壁细胞角隅区域,而阿魏酸与对香豆酸则在各类细胞的角隅区域均被脱除,说明液氨浸渍预处理过程中,同一原料不同细胞组织,以及同一细胞不同亚层之间组分的分离机制不同。然而,Donohoe 等[29]利用液氨浸渍预处理柳枝稷时,发现木质素从细胞各层被均匀脱除,不同细胞类型之间脱木素速率也无明显差异。这说明同一预处理方法作用于不同原料时,其反应机理不同。
2.3 离子液体预处理
离子液体 (Ionic liquid, ILs) 被认为是一种可回收利用的新型绿色介质。它由有机阳离子和无机阴离子组成,不同种类的离子液体可以溶解纤维素、木质素、甚至木质纤维素生物质。通过添加反相溶剂 (水、甲醇、乙醇等) 可再生出木质纤维素生物质,经再生后其纤维素结晶度明显降低,比表面积增加,从而提高后续酶水解效率[30]。
离子液体带有强电负性离子,能够与纤维素大分子上的羟基形成氢键,从而破坏了纤维素分子间与分子内的氢键作用,达到溶解润胀的效果。Lucas等[31]研究了室温条件下离子液体(1-乙基-3-甲基咪唑醋酸盐,EmimAc) 预处理杨木,发现预处理后纤维细胞壁次生壁区域向细胞腔方向发生选择性润胀,纤维素未被溶解,但其晶型结构消失;加反相溶剂水之后,纤维素被再生出来,其晶型结构较对照组未发生明显变化,但含量稍有损失,另外,纤维细胞次生壁区域体积较之前变小。这表明常温下EmimAc预处理过程中杨木纤维细胞壁的润胀和去结晶作用均是可逆的。
Lee等[30]在相关研究中表明,EmimAc可有效溶解木质素,而对纤维素的影响不大。然而,Singh 等[32]研究发现,EmimAc 在加热条件下可实现纤维素与木质素的全溶,并检测了EmimAc预处理过程中柳枝稷节间组织细胞壁的溶解过程:在预处理初期,维管束厚壁细胞和各类细胞的胞间层区域率先溶解,使细胞分离开来;随着预处理时间的延长,可实现组分全溶。Sun等[33]也研究了EmimAc在加热条件下预处理玉米秸秆时,不同细胞组织发生的特异性变化,并解析了离子液体预处理过程中植物细胞壁的润胀、木质素与纤维素溶解的协同关系。
传统的离子液体对水分较为敏感,这就要求在进行离子液体预处理之前必须对样品进行干燥,然而这一过程极大增加了生产成本。为了缓解这一问题,亲水性离子液体的相关研究变得尤为重要[34]。近年来,Liu 等[35]合成了一系列新型的以胆碱为阳离子,氨基酸为阴离子的水溶性离子液体 ([Ch][AA])。与传统的离子液体不同,该水溶性离子液体的主要作用是选择性脱除木质素,而非打破纤维素结晶结构。Hou等[34]研究了[Ch][AA]离子液体对稻杆进行预处理过程中,木质素和半纤维素的溶解机制,发现维管束厚壁细胞胞间层区域的木质素可被率先脱除,而富含纤维素的次生壁区域由于与离子液体交联作用较小,导致木质素不易被除去;另外,随着木质素的大量脱除,从而暴露出更多的纤维,这些微观结构的改变可有效提高后续酶水解效率。
2.4 有机溶剂预处理
有机溶剂预处理能有效脱除木质纤维原料中的木质素,常用的有机溶剂包括:甲醇、乙醇、乙二醇、丙酮等[36-40]。在部分研究中,通过加入无机酸催化剂,可有效提高半纤维素和木质素的脱除速率[40-41]。
Hallac等[42]研究发现,在用乙醇溶剂处理大叶醉鱼草时,细胞壁会发生形变,表面有裂痕出现;同时胞间层区域的木质素被选择性脱除,而细胞壁中纤维素的结晶结构未发生明显变化。将预处理之后的样品进行酶水解,结果显示纤维素向单糖的转化率明显提高。虽然该预处理方法可使样品中的纤维素更易被降解,但该工艺成本及纯组分的潜在价值高,故更适合用于生产高值化产品[2]。
3 物理-化学预处理
3.1 蒸汽爆破预处理
蒸汽爆破 (Steam explosion) 是对物料进行化学分解和机械分裂双重作用的过程,它可通过脱除部分半纤维素和木质素,破坏两者对纤维素的包覆作用,增加原料的孔隙率及比表面积,从而促进后续纤维素酶水解作用的进行。
Kristensen等[43]研究发现,经蒸汽爆破预处理后的麦秸节间组织,细胞壁中的纤维束相互分离松散,光滑的纤维表面有尺寸大小不均一的球状沉淀物形成。根据前人研究,该球状沉淀物的形成机理与在稀酸及热水预处理中是类似的,很可能是木质素在温度高于其玻璃态转化温度时发生凝聚重排的结果[12-13,16]。
3.2 氨气纤维爆破预处理
氨气纤维爆破预处理是通过碱性氨分子与纤维素上的部分羟基形成络合物,从而使纤维发生膨胀,而后快速降压致使纤维结构受到破坏的过程。该方法可有效降低纤维素的结晶度,并打断木质素与碳水化合物之间的键合,从而提高木质纤维生物质向单糖的转化效率。
Donohoe等[29]发现,氨气纤维爆破预处理之后的柳枝稷节间组织,细胞壁变薄,并伴随形变甚至塌陷;另外在细胞腔区域形成了不规则的富含木质素的球状沉淀物。Chundawat等[44]在氨气纤维爆破预处理后的玉米秸秆表面,也发现了类似的球状沉淀物,不同的是,他通过免疫荧光标记技术证实了这些球状物中富含聚阿拉伯糖木糖而非木质素。
4 结论与展望
木质素与半纤维素的包覆、纤维素的结晶度与聚合度、酶对纤维素的可及性,是影响木质纤维素生物质酶水解效率的主要因素。预处理技术是通过改变物料的物理或化学特性,从而克服生物质的难降解性,提高生物质转化效率的关键步骤。全面了解预处理工艺是如何作用于植物细胞壁,改变其微观结构从而提高酶水解效率,是有效提高木质纤维生物质转化的重要途径。本文从细胞及分子水平分析总结了多种预处理方法对植物细胞壁区域化学和超微结构的影响,为优化预处理条件,降低经济成本,实现生物质转化工业化提供了可能。然而,由于不同木质纤维素原料之间细胞类型与结构不同,故其反应性能也存在较大差异,因此在实际应用中,对原料进行预处理开发时,应从微观与宏观角度同时出发,全面分析其反应机理与最终得率,以期获得最大的经济效益。
基于目前的检测技术,超微结构分析主要是在微米水平揭示了预处理前后植物细胞壁结构与化学组成发生的变化,而相关变化是否打开了酶分子的扩散通道,提高了酶分子对不溶性底物的可及性,以及各种变化是如何影响酶对底物的可及性等问题仍然需要进一步深入研究。为了使利用木质生物资源生产乙醇进入工业化,今后我们应借助多种显微技术力争实现细胞壁变化的实时观测,建立有效的预处理模型,研究预处理机理,并且深入探索木质纤维素物料化学组成与理化结构的关系及其对纤维素酶消化的影响。突破木质纤维素生物质预处理的瓶颈问题,将为以木质纤维素为原料的燃料乙醇工业化生产打下坚实的基础。
REFERENCES
[1] Holopainen-Mantila U, Marjamaa K, Merali Z, et al. Impact of hydrothermal pre-treatment to chemical composition, enzymatic digestibility and spatial distribution of cell wall polymers. Bioresour Technol, 2013, 138(1): 156–162.
[2] Chundawat SP, Beckham GT, Himmel ME, et al. Deconstruction of lignocellulosic biomass to fuels and chemicals. Annu Rev Chem Biomol, 2011, 2(1): 21–45.
[3] Zhang Z, Ji Z, Ma J, et al. Anatomy, cell wall ultrastructure and inhomogeneity in lignin distribution of broussonetia papyrifera. Cellul Chem Technol, 2012, 46(3/4): 157–164.
[4] Ma J, Ji Z, Zhou X, et al. Transmission electron microscopy, fluorescence microscopy, and confocal raman microscopic analysis of ultrastructural and compositional heterogeneity of Cornus a lba L. wood cell wall. Microsc Microanal, 2013, 19(1): 243–253.
[5] Agarwal UP. Raman imaging to investigate ultrastructure and composition of plant cell walls: distribution of lignin and cellulose in black spruce wood (Picea mariana). Planta, 2006, 224(5): 1141–1153.
[6] Gierlinger N, Schwanninger M. Chemical imaging of poplar wood cell walls by confocal Raman microscopy. Plant Physiology, 2006, 140(4): 1246–1254.
[7] Alvira P, Tomás-Pejó E, Ballesteros M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: a review. Bioresour Technol, 2010, 101(13): 4851–4861.
[8] Zheng Y, Pan Z, Zhang R. Overview of biomass pretreatment for cellulosic ethanol production. Int J Agr Biol Eng, 2009, 2(3): 51–68.
[9] Panagiotou G, Olsson L. Effect of compounds released during pretreatment of wheat straw on microbial growth and enzymatic hydrolysis rates. Biotechnol Bioeng, 2007, 96(2): 250–258.
[10] Oh SY, Yoo DI, Shin Y, et al. Crystalline structure analysis of cellulose treated with sodium hydroxide and carbon dioxide by means of X-ray diffraction and FTIR spectroscopy. Carbohydr Res, 2005, 340(15): 2376–2391.
[11] Kumar R, Mago G, Balan V, et al. Physical and chemical characterizations of corn stover and poplar solids resulting from leading pretreatment technologies. Bioresour Technol, 2009, 100(17): 3948–3962.
[12] Abud Y, Costa LT, de Souza W, et al. Revealing the microfibrillar arrangement of the cell wall surface and the macromolecular effects of thermochemical pretreatment in sugarcane by atomic force microscopy. Ind Crops Prod, 2013, 51(6): 2–9.
[13] Selig MJ, Viamajala S, Decker SR, et al. Deposition of lignin droplets produced during dilute acid pretreatment of maize stems retards enzymatic hydrolysis of cellulose. Biotechnol Progr, 2007, 23(6): 1333–1339.
[14] Sannigrahi P, Kim DH, Jung S, et al. Pseudo-lignin and pretreatment chemistry. Energy Environ Sci, 2011, 4(4): 1306–1310.
[15] Hu F, Jung S, Ragauskas A. Pseudo-lignin formation and its impact on enzymatic hydrolysis. Bioresour Technol, 2012, 117(1): 7–12.
[16] Donohoe BS, Decker SR, Tucker MP, et al. Visualizing lignin coalescence and migration through maize cell walls following thermochemical pretreatment. Biotechnol Bioeng, 2008, 101(5): 913–925.
[17] Li H, Pu Y, Kumar R, et al. Investigation of lignin deposition on cellulose during hydrothermal pretreatment, its effect on cellulose hydrolysis, and underlying mechanisms. Biotechnol Bioeng, 2013, 9(9): 1–8.
[18] Ralph J, Hatfield RD, Quideau S, et al. Pathway of p-coumaric acid incorporation into maize lignin as revealed by NMR. J Am Chem Soc, 1994, 116(21): 9448–9456.
[19] Belmokhtar N, Habrant A, Ferreira NL, et al. Changes in phenolics distribution after chemical pretreatment and enzymatic conversion of miscanthus × giganteus internode. Bioenerg Res, 2013, 6(2): 506–518.
[20] Brunecky R, Vinzant TB, Porter SE, et al. Redistribution of xylan in maize cell walls during dilute acid pretreatment. Biotechnol Bioeng, 2009, 102(6): 1537–1543.
[21] DeMartini JD, Pattathil S, Avci U, et al. Application of monoclonal antibodies to investigate plant cell wall deconstruction for biofuels production. Energy Environ Sci, 2011, 4(10): 4332–4339.
[22] Chu LQ, Masyuko R, Sweedler JV, et al. Base-induced delignification of miscanthus x giganteus studied by three-dimensional confocal raman imaging. Bioresour Technol, 2010, 101(13): 4919–4925.
[23] Donaldson LA. Lignification and lignin topochemistry—an ultrastructural view. Phytochemistry, 2001, 57(6): 859–873.
[24] Rezende CA, de Lima MA, Maziero P, et al. Chemical and morphological characterization of sugarcane bagasse submitted to a delignification process for enhanced enzymatic digestibility. Biotechnol Biofuels, 2011, 4(1): 1–19.
[25] Ben Sghaier AE, Chaabouni Y, Msahli S, et al. Morphological and crystalline characterization of NaOH and NaOCl treated Agave americana L. fiber. Ind Crops Prod, 2012, 36(1): 257–266.
[26] Persson T, Ren JL, Joelsson E, et al. Fractionation of wheat and barley straw to access high-molecular-mass hemicelluloses prior to ethanol production. Bioresour Technol, 2009, 100(17): 3906–3913.
[27] Saha BC, Cotta MA. Ethanol production from alkaline peroxide pretreated enzymatically saccharified wheat straw. Biotechnol Progr, 2006, 22(2): 449–453.
[28] Varga E, Szengyel Z, Réczey K. Chemical pretreatments of corn stover for enhancing enzymatic digestibility. Appl Biochem Biotechnol, 2002, 98(1/9): 73–87.
[29] Donohoe BS, Vinzant TB, Elander RT, et al. Surface and ultrastructural characterization of raw and pretreated switchgrass. Bioresour Technol, 2011, 102(24): 11097–11104.
[30] Lee SH, Doherty TV, Linhardt RJ, et al. Ionic liquid-mediated selective extraction of lignin from wood leading to enhanced enzymatic cellulose hydrolysis. Biotechnol Bioeng, 2009, 102(5): 1368–1376.
[31] Lucas M, Wagner GL, Nishiyama Y, et al. Reversible swelling of the cell wall of poplar biomass by ionic liquid at room temperature. Bioresour Technol, 2011, 102(6): 4518–4523.
[32] Singh S, Simmons BA, Vogel KP. Visualization of biomass solubilization and cellulose regeneration during ionic liquid pretreatment of switchgrass. Biotechnol Bioeng, 2009, 104(1): 68–75.
[33] Sun L, Li C, Xue Z, et al. Unveiling high-resolution, tissue specific dynamic changes in corn stover during ionic liquid pretreatment. RSC Advances, 2013, 3(6): 2017–2027.
[34] Hou XD, Li N, Zong MH. Renewable bio ionic liquids-water mixtures-mediated selective removal of lignin from rice straw: Visualization of changes in composition and cell wall structure. Biotechnol Bioeng, 2013, 110(7): 1895–1902.
[35] Liu QP, Hou XD, Li N, et al. Ionic liquids from renewable biomaterials: synthesis, characterization and application in the pretreatment of biomass. Green Chemistry, 2012, 14(2): 304–307.
[36] Sun Y, Cheng J. Hydrolysis of lignocellulosic materials for ethanol production: a review. Bioresour Technol, 2002, 83(1): 1–11.
[37] Hsu TA. Pretreatment of biomass[C]//Proceedings of the Fuel and Energy Abstracts. Finland: Elsevier Science, 1997, 38(2): 103.
[38] Duff SJ, Murray WD. Bioconversion of forest products industry waste cellulosics to fuel ethanol: a review. Bioresour Technol, 1996, 55(1): 1–33.
[39] Chang VS, Nagwani M, Kim CH, et al. Oxidative lime pretreatment of high-lignin biomass. Appl Biochem Biotechnol, 2001, 94(1): 1–28.
[40] Zhao X, Cheng K, Liu D. Organosolv pretreatment of lignocellulosic biomass for enzymatic hydrolysis. Appl Microbiol Biotechnol, 2009, 82(5): 815–827.
[41] Paszner L, Cho H. High efficiency conversion of lignocellulosics to sugars for liquid fuel production by the ACOS process. Energy Exploit Explor, 1988, 6(2): 39–60.
[42] Hallac BB, Ray M, Murphy RJ, et al. Correlation between anatomical characteristics of ethanol organosolv pretreated Buddleja dav idii and its enzymatic conversion to glucose. Biotechnol Bioeng, 2010, 107(5): 795–801.
[43] Kristensen JB, Thygesen LG, Felby C, et al. Cell-wall structural changes in wheat straw pretreated for bioethanol production. Biotechnol Biofuels, 2008, 1(5): 1–9.
[44] Chundawat SP, Donohoe BS, da Costa Sousa L, et al. Multi-scale visualization and characterization of lignocellulosic plant cell wall deconstruction during thermochemical pretreatment. Energy Environ Sci, 2011, 4(3): 973–984.
(本文责编 郝丽芳)
Effect of pretreatment on topochemical and ultrastructural changes of lignocellulose plant cell walls: a review
Zhe Ji, Zhe Ling, Xun Zhang, Jianfeng Ma, and Feng Xu
Beijing Key Laboratory of Lignocellulosic Chemistry, Beijing Forestry University, Beijing 100083, China
Deconstruction of lignocellulosic plant cell walls to fermentable sugars by biochemical means is impeded by several poorly understood ultrastructural and chemical barriers. Pretreatment is an essential step by altering the morphological and compositional characteristics of biomass to enhance the sugar release during enzymatic hydrolysis. Therefore, getting insight into this field is necessary to improve the conversion of biomass into biofuels. In this review, we highlight our recent understanding on the impact of various promising pretreatments on biomass, with emphasis on the topochemical andultrastructural changes of plant cell walls that are related to the reduction of recalcitrance and the consequence of saccharification. It will lend support to the scientific research and development with respect to biomass conversion.
biomass pretreatment, compositional distribution, ultrastructure, cellulose, hemicelluloses, lignin, enzymatic hydrolysis
February 13, 2014; Accepted: April 9, 2014
Feng Xu. Tel: +86-10-62336387; E-mail: xfx315@bjfu.edu.cn
吉喆, 凌喆, 张逊, 等. 预处理对木质纤维素生物质细胞壁超微结构的影响. 生物工程学报, 2014, 30(5): 707−715.
Ji Z, Ling Z, Zhang X, et al. Effect of pretreatment on topochemical and ultrastructural changes of lignocellulose plant cell walls: a review. Chin J Biotech, 2014, 30(5): 707−715.
Supported by: National Science and Technology Program of the Twelfth Five-Year Plan Period (No. 2012BAD32B06), National Science Fund for Distinguished Young Scholars (No. 31225005), Chinese Ministry of Education (No. 113014A).
科技部十二五科技支撑计划项目 (No. 2012BAD32B06),国家杰出青年科学基金 (No. 31225005),教育部科技计划项目 (No. 113014A) 资助。
时间:2014-05-07 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140078.html
