8,8′-二苯甲酰胺基联萘硫醚的合成及其催化活性
2014-06-23付直涛,曹锰,陈慧等
硫醚是重要的有机催化剂,它可以单独催化或与铜、铑等过渡金属络合物一起协同催化合成环氧化合物、三元氮杂环等[1-3].五元环的四氢噻吩类硫醚和六元环的樟脑烷类硫醚都有大量的研究和报道,其中一些表现出很好的催化效果[1-5],但具有联萘结构的七元环硫醚的相关报道比较少.Sakae Uemura等报道了最简单的联萘硫醚催化剂1和另一种萘环联有苯基的硫醚[6],它们催化环氧化反应的结果不太理想.我们希望向此类联萘硫醚的芳环引入其他取代基,以改善其催化活性和立体选择性.本文报道了一种新的联萘结构硫醚2的合成方法(图1),并研究了它催化芳醛与溴化苄的环氧化反应(图2).与硫醚1的不同之处是硫醚2萘环的8,8′-位引入了供电子基团NHBz(Bz=COPh).研究发现硫醚2的催化活性明显比未取代的硫醚1的催化活性高.在较短的反应时间,得到较高的产率(74%).说明联萘硫醚芳环上具有供电子基时,有利于提高硫醚的催化活性,这对进一步修饰此类硫醚具有指导意义.
1 实验部分
1.1 仪器与试剂
1.1.1 仪器 红外光谱仪:PE-Spectrum One型红外光谱仪,KBr压片.核磁共振仪:INOVA(600 MHz)核磁共振仪,以CDCl3或氘代丙酮为溶剂,TMS(0.03%)为内标.
1.1.2 试剂处理 二氯甲烷(AR)和乙腈(AR)分别在氢化钙中回流3h以上再收集使用.NBS和AIBN经重结晶提纯.活性锌粉制备:分析纯的锌粉用10%盐酸处理10min,再用丙酮洗涤,干燥至恒重.苯甲醛、对甲基苯甲醛、邻氯苯甲醛都为分析纯试剂,使用前重新蒸馏.其他试剂未经处理,直接使用.
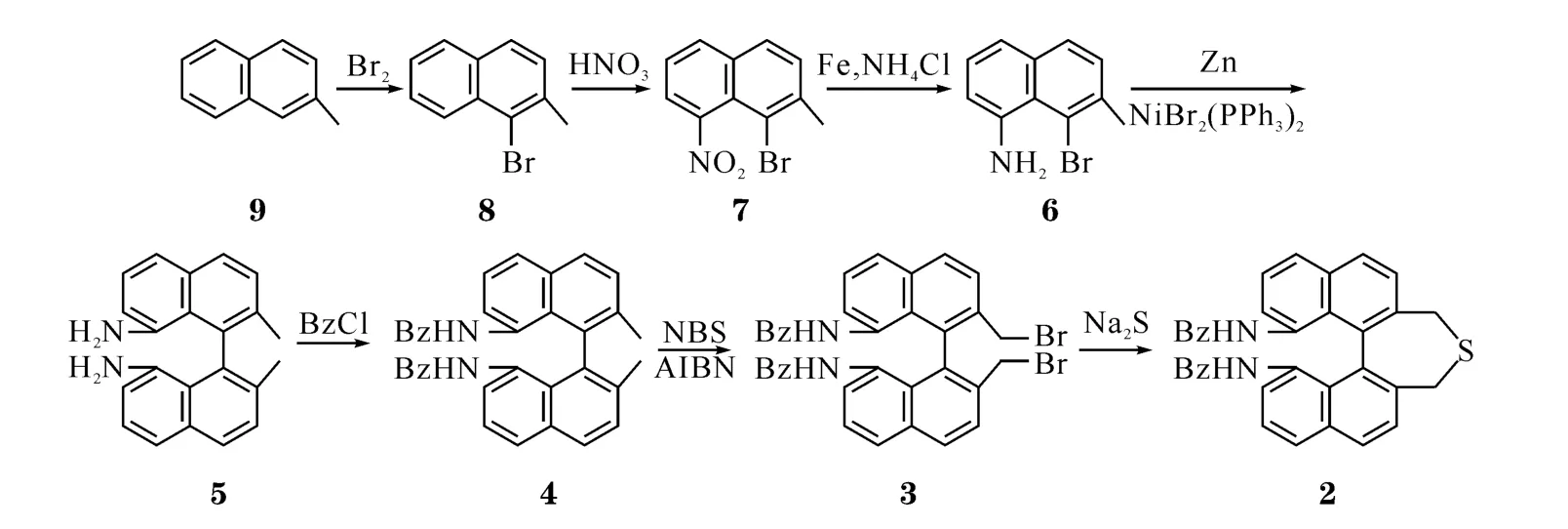
图1 硫醚2的合成路线

图2 硫醚催化的环氧化反应及硫醚1的结构
1.2 实验步骤 硫醚1按照文献[6-7]方法合成,所使用的原料为s-联萘二酚,本文不再详述其合成过程.硫醚2由β-甲基萘9为原料,经7步反应合成,其中由原料9到化合物5按文献[8]合成(图1),各步产物经光谱测定,与文献相符,其他实验步骤如下.所得硫醚2为外消旋体.
1.2.1 化合物4的合成[9]向化合物5(1.8g,5.77mmol)与三乙胺(1.92mL,13.85mmol)的CH2Cl2(50mL)溶液中,逐滴加入苯甲酰氯(1.61mL,13.85mmol)的CH2Cl2(10mL)溶液.滴加完后,混合物搅拌回流过夜.待反应完成后,冷却到室温,用蒸馏水(50mL)洗一次,再用饱和碳酸氢钠溶液(2×50mL)洗涤,用蒸馏水(50mL)洗一次,最后用3mol/L的盐酸(2×50mL)洗涤,无水硫酸镁干燥.产物用柱层析分离(乙酸乙酯∶石油醚∶二氯甲烷=1∶4∶4),得产物4(2.821g,产率94%).1H NMR(600MHz,CDCl3)δ:1.76(s,6H),6.92~6.93(m,4H),7.05~7.07(m,4H),7.21(m,2H),7.30~7.32(m,4H),7.35~7.37(m,2H),7.38~7.47(m,2H),7.48~7.53(m,2H),7.55(s,2H).
1.2.2 化合物3的合成[6,10]将化合物4(2.80g,5.383mmol)溶解在无水苯(50mL)中,在稳定的氩气氛中,加入 NBS(2.30g,12.91mmol)和 AIBN(10mg).反应混合物回流3h,并用一标准的100W电灯泡照射,反应完毕后,趁热过滤.将得到的固体溶解于热水中,用热的四氯化碳萃取,萃取所得有机相和滤液合并,无水硫酸镁干燥.产物用柱层析分离(乙酸乙酯∶石油醚∶二氯甲烷=1∶4∶1).得产物3(2.30g,产率63%).1H NMR(600MHz,CDCl3)δ:3.99(d,J=10.2Hz,2H),4.03(d,J=10.2Hz,2H),7.00~7.02(m,4H),7.07~7.10(m,4H),7.32~7.35(m,2H),7.38~7.50(m,10H),8.22(s,2H).
1.2.3 硫醚2的合成[6]将化合物3(2.30g,3.39mmol)、Na2S·9H2O(1.63g,6.78mmol)与二氧六环(50mL)混合,在70℃下搅拌3h.待反应完成后,经过硅藻土过滤除去无机盐,无水硫酸镁干燥.产物用柱层析分离(乙酸乙酯∶石油醚∶二氯甲烷=1∶2∶0.5).得目标产物硫醚2(1.31g,产率63%).1H NMR(600MHz,CDCl3)δ:3.20(d,J=12.6Hz,2H),3.40(d,J=12.6Hz,2H),6.90~6.91(m,4H),7.13~7.15(m,4H),7.22~7.24(m,2H),7.31~7.42(m,10H),7.49(s,2H).其中3.20和3.40的两组二重峰,归属于两个亚甲基上的4个氢原子,由于亚甲基与手性的萘环相连,因此分裂为两组二重峰.13C NMR(600MHz,CDCl3)δ:33.02,125.46,126.01,126.73,127.45,127.76,128.34,128.42,130.69,131.36,131.84,132.56,132.65,133.78,134.55,165.66.其中165.66是明显的羰基碳特征峰.IR(KBr)ν:3 323,1 645,1 049cm-1.其中3 323cm-1有明显的氨基中N—H 伸缩振动的吸收,1 645cm-1有明显的酰胺羰基峰.
1.2.4 硫醚催化环氧化反应的一般方法[6]在Ar气氛中,将对硝基苄溴、硫醚催化剂(1或2,10%~100%(摩尔比)),添加剂四丁基碘化铵(20%),溶剂(0.5mL),碱(100%),醛(100mol%)置于反应器中,室温搅拌下反应相应时间.待反应完成后,将混合物注入20mL水中,二氯甲烷萃取(3×20mL),无水硫酸镁干燥.产物用柱层析分离(乙酸乙酯∶石油醚=1∶20).得产物10a~10c(R=H,p-CH3,O-Cl;图2).
10a[11](R=H).1H NMR(600MHz,CDCl3)δ:trans:8.26(d,J=8.4Hz,2H),7.53(d,J=8.4 Hz,2H),7.47~7.27(m,5H),3.99(d,J=1.6Hz,1H),3.87(d,J=1.6Hz,1H);cis:8.05(d,J=8.8 Hz,2H),7.36(d,J=8.8Hz,2H),7.20~7.18(m,5H),4.48(d,J=4.8Hz,1H),4.43(d,J=4.8Hz,1H).
10b[11](R=p-CH3).1H NMR(600MHz,CDCl3)δ:trans:7.37(d,J=8.4Hz,2H),7.27~7.06(m,5H),6.98(d,J=8.4Hz,2H),3.86(d,J=1.6Hz,1H),3.74(d,J=1.6Hz,1H),2.35(s,3H);cis:7.30(d,J=8.8Hz,2H),7.22~7.05(m,5H),6.93(d,J=8.8Hz,2H),4.57(d,J=4.2Hz,1H),4.55(d,J=4.2Hz,1H),2.34(s,3H).
10c(R=o-Cl).1H NMR(600MHz,CDCl3)δ:trans:8.27(d,J=8.4Hz,2H),7.38~7.56(d,J=8.4 Hz,2H),7.32~7.37(m,2H),7.26~7.30(m,2H),4.19(d,J=1.8Hz,1H),3.87(d,J=1.8Hz,1H).IR(KBr):3 032,1 270,1 603,1 520,1 440,1 396,1 344,1 106,1 058,903,851,823,756,699,534cm-1.
2 结果与讨论
2.1 环氧化反应条件的优化 首先用硫醚1催化苯甲醛与对硝基苄溴的环氧化反应,通过尝试不同的溶剂、碱、催化剂用量等来优化反应条件,其反应结果见下表1.从下表1中的数据可以看出,硫醚1催化环氧化苯甲醛与对硝基苄溴的反应时,用乙腈作为溶剂,用氢氧化钠作为碱是比较好的(表1中反应7~10),得到产物为反式(trans)10a.其他条件下要么不发生反应,要么副产物多,产物复杂,导致产物无法分离.当用乙腈作溶剂、氢氧化钠作碱时,催化剂硫醚1的用量为10%的时候,环氧化的收率比催化剂的用量为100%的时候的收率低(表1中反应10);当硫醚1的用量为20%时,可以得到较好的产率40%(表1中反应9),进一步增加催化剂的用量,产率未明显提高(表1中反应7~8).
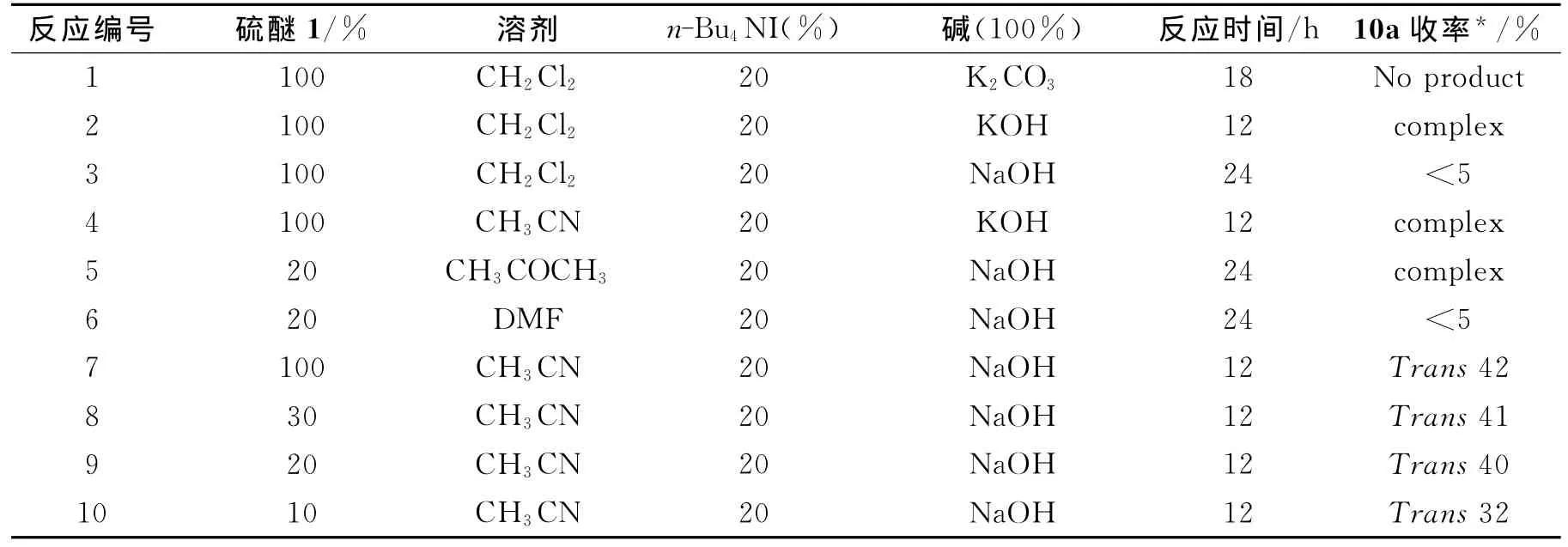
表1 反应条件对环氧化反应产率的影响
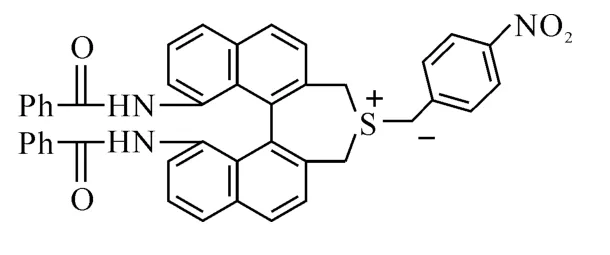
图3 硫叶立德中间体结构
2.2 硫醚催化活性的比较 在以上优化的条件下,我们将硫醚(1和2)分别用于催化不同的醛与对硝基苄溴的反应,通过反应的快慢来比较他们的催化活性,反应结果见表2.从表2可以看出,在不同醛与对硝基苄溴的反应中,硫醚2催化反应所需的时间较短(表2中反应2、4、6),只需要4h以下,而硫醚1催化相应的反应需要12h以上才能完成.虽然硫醚2催化苯甲醛与对硝基苄溴的反应立体选择性较差(Trans/cis=61/39),但其环氧化物总产率最高,达到74%(表2中反应2);它催化对甲基苯甲醛的反应产率也比硫醚1高(表2中反应3、4);硫醚2催化邻氯苯甲醛与对硝基苄溴反应时,生成较多未知副产物,导致反应产率较低,但是反应速度也较快,只需用4h(表2中反应5、6)原料消耗完毕.从反应速度看,硫醚2表现出比硫醚1更高的催化活性,这可能是因为硫醚2中带有较强的供电子基团(NHBz,Bz=COPh),有利于稳定环氧化反应中生成的硫叶立德中间体[6,12](图3),促进了反应进行,从而提高了催化活性.
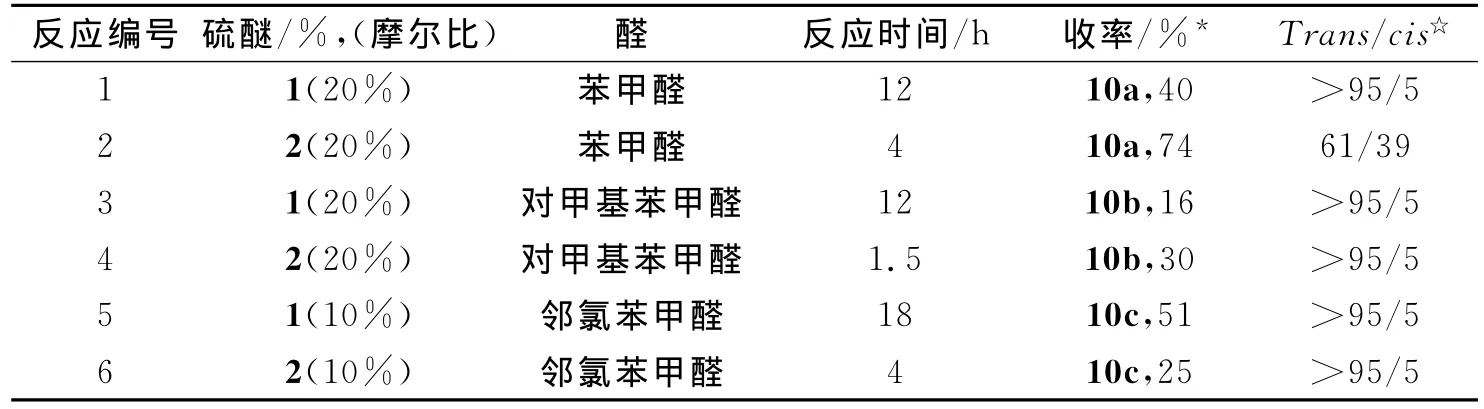
表2 不同催化剂催化环氧化反应情况对比
3 结论
由β-甲基萘出发,合成了一种新的联萘硫醚2,其萘环上8,8′-位联有苯甲酰胺基.此硫醚在催化醛与对硝基苄溴的环氧化的反应之中,表现出较高的催化活性,这可能是其萘环上引入供电子集团引起的.由于此类硫醚对醛的环氧化反应催化性能还不理想,需要进一步提高催化剂的催化活性和立体选择性,所以,这一结果对我们进一步修饰此类硫醚具有指导意义.可以设想,通过在此类联萘硫醚中萘环的3,3′-位(离硫原子更近)引入强的供电子基团(如—NR2),可能会较大地提升此类硫醚催化活性.
[1]Li A H,Dai L X,Aggarwal V K.Asymmetric ylide reactions:epoxidation,cyclopropanation,aziridination,olefination,and rearrangement[J].Chem Rev,1997,97:2341-2372.
[2]Pereira A,Martin C,Maya C,et al.An effective dual copper-and sulfide-catalytic system for the epoxidation of aldehydes with phenyldiazomethane[J].Adv Synth Catal,2013,355:2942-2951.
[3]Aggarwal V K,Winn C L.Catalytic,asymmetric sulfur Ylide-mediated epoxidation of carbonyl compounds:scope,selectivity,and applications in synthesis[J].Acc Chem Res,2004,37:611-620.
[4]McGarrigle E M,Myers E L,Illa O,et al.Chalcogenides as organocatalysts[J].Chem Rev,2007,107:5841-5883.
[5]Wang J,Frings M,Bolm C.Enantioselective nitrene transfer to sulfides catalyzed by a chiral iron complex[J].Angew Chem Int Ed,2013,52(33):8861-8861.
[6]Miyake Y,Oyamada A,Nishibayashi Y,et al.Asymmetric synthesis of epoxides catalyzed by C2symmetric optically active sulfides[J].Heteroatom Chemistry,2002,13:270-275.
[7]Stara I G,Stary P,Tichy M,et al.Nucleophilic attack on 4,5-dihydro-4-alkyl-3H-dinaphtho[2,1-c:1′,2′-e]thiepinium salts:a convenient approach to new 2,2′-bidentate 1,1′-binaphthalene ligands with sulfur donor atoms[J].J Org Chem,1994,59:1326-1332.
[8]Tsubaki K,Hai D T T,Reddy V K,et al.Synthesis of chiral 2,2′-dimethyl-1,1′-binaphthyl-8,8′-diamine and barriers of atropisomerization of the related binaphthyls[J].Tetrahedron:Asymmetry,2007,18:1017-1021.
[9]邱楠楠,黄金程,李晓军,等.N-(4-吡啶基)-2-羟基苯甲酰胺的合成工艺研究[J].化学试剂,2010,32(11):1045-1046.
[10]Ooi T,Kameda M,Maruoka K.Design of N-spiro C2-symmetric chiral quaternary ammonium bromides as novel chiral phase-transfer catalysts:synthesis and application to practical asymmetric synthesis ofα-amino acids[J].J Am Chem Soc,2003,125:5139-5151.
[11]Wang L,Huang Z.Highly stereoselective synthesis of trans-diaryl epoxides via semi-stabilised telluronium ylide[J].J Chem Res(S),2003(2):305-306.
[12]Aggarwal V K,Harvey J N,Richardson J.Unraveling the mechanism of epoxide formation from sulfur ylides and aldehydes[J].J Am Chem Soc,2002,124:5747-5756.
