洛汀新和科素亚对糖尿病肾病大鼠足细胞的保护作用
2014-06-23肖梦云王小丹赵德龙
肖梦云,王小丹,洪 权,赵德龙,喻 陆
(1.南方医科大学研究生学院,广东广州 510515;2.解放军第301医院肾内科,北京 100039;3.解放军第305医院肾内科,北京 100017)
洛汀新和科素亚对糖尿病肾病大鼠足细胞的保护作用
肖梦云1,王小丹2,洪 权2,赵德龙2,喻 陆3
(1.南方医科大学研究生学院,广东广州 510515;2.解放军第301医院肾内科,北京 100039;3.解放军第305医院肾内科,北京 100017)
目的观察血管紧张素(AngiotensinⅡ,AngⅡ)对糖尿病肾病(diabetic nephropathy,DN)大鼠足细胞损伤的作用及血管紧张素转换酶抑制剂(ACEIs)洛汀新和血管紧张素Ⅱ受体拮抗剂(ARBs)科素亚对损伤足细胞的保护作用。方法60只大鼠随机分为正常对照组、单肾切除组、单肾切除+洛汀新组[10 mg/(kg·d)灌胃]、单肾切除+科素亚组[20 mg/(kg·d)灌胃]、糖尿病肾病组、糖尿病肾病+胰岛素注射组(早晚各2U甘精胰岛素皮下注射)、糖尿病肾病+胰岛素注射+洛汀新组和糖尿病肾病+胰岛素注射+科素亚组,共8组。通过右肾切除+STZ 45 mg/kg一次性腹腔注射建立Ⅰ型DN模型,模型建立16周后进行药物干预,期间每4周称量大鼠体质量,药物干预8周后处死动物。留取血清和尿标本,观察血糖、尿糖、尿蛋白/肌酐和AngⅡ的变化;留取肾组织标本,称量肾质量,行光镜检查,提取肾小球,Western blot检测肾小球组织中Nephrin和Podocin的表达。结果①与对照组相比,DN组大鼠血糖、尿糖明显升高、肾质量/体质量明显增加(P<0.01);体质量明显减轻(P<0.01)。与DN组相比,洛汀新和科素亚干预大鼠体质量均明显增加(P<0.05)。②DN组大鼠肾脏病理呈DN早期表现(系膜增殖、系膜基质增加,肾小管上皮细胞肿胀,管腔狭窄,可见蛋白管型)。洛汀新和科素亚干预组大鼠肾脏病理表现明显好转。③与对照组相比,科素亚治疗大鼠血清中AngⅡ水平明显增加(P<0.05)。④DN组与洛汀新治疗组Podocin和Nephrin的蛋白表达量与对照组相比均明显升高(P<0.05)。结论洛汀新和科素亚对糖尿病肾病都具有一定的足细胞保护作用;鉴于科素亚治疗组大鼠血清中的AngⅡ水平明显升高,使得洛汀新在发挥对早期糖尿病肾病足细胞损伤的保护作用方面更具前景。
洛汀新;科素亚;糖尿病肾病;足细胞;血管紧张素Ⅱ
糖尿病肾病(diabetic nephropathy,DN)是最常见的糖尿病并发症,已成为我国终末期肾脏疾病(end stage renal diease,ESRD)的第2大病因[1]。由于早期DN积极治疗后临床症状和病理改变均可恢复正常,因此,治疗早期DN对于防止DN向ESRD转化意义重大。血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)和血管紧张素Ⅱ受体拮抗剂(angiotensinⅡreceptor blockers,ARBs)通过其非血流动力学效应对DN具有独立于降压之外的肾保护作用,但确切的机制目前仍不清楚。足细胞即肾小球脏层上皮细胞,与肾小球内皮细胞(系膜细胞)和肾小球基底膜一起,构成肾小球的滤过屏障。因足细胞为高度分化细胞,再生能力有限,故其损伤被认为是导致DN蛋白尿及DN进展的重要环节。因此,探究导致DN足细胞损伤的机制显得尤为重要。在现有的研究中,已了解到血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)可能是导致足细胞损伤的机制之一[2]。由此我们推测ACEI类药物和ARB类药物是通过抑制DN时足细胞中升高的AngⅡ水平改善足细胞损伤,从而发挥肾脏保护作用。本研究意在观察ACEI类及ARB类药物对DN模型大鼠足细胞nephrin、podocin蛋白表达的影响,探讨其在DN治疗中发挥肾保护作用的机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器12周龄正常雄性Wistar大鼠60只(购自北京维通利华动物实验技术有限公司),清洁级,体质量(420.37±29.02)g。STZ (Sigma-Aldrich);拜耳血糖仪及试纸条。血浆血管紧张素Ⅱ放免药盒(北京原子高科股份有限公司)。盐酸贝那普利片(洛汀新,北京诺华制药有限公司);氯沙坦钾片(科素亚,杭州默沙东制药有限公司)。小鼠抗β-actin抗体(Sigma-Aldrich)、兔抗nephrin抗体(Prosci)和兔抗podocin抗体(Protein Tech Group),辣根过氧化物酶标记的山羊抗兔二抗和山羊抗小鼠IgG二抗(Santa Cruz Biotechnology)。
1.2 动物分组60只大鼠随机分为正常对照组(C,n=4)、单肾切除组(NX,n=4)、单肾切除+洛汀新组(NX+B,n=6)、单肾切除+科素亚组(NX+L,n= 6)、糖尿病肾病组(DN,n=10)、糖尿病肾病+胰岛素注射组(DN+IR,n=10)、糖尿病肾病+胰岛素注射+洛汀新组(DN+IR+B,n=10)和糖尿病肾病+胰岛素注射+科素亚组(DN+IR+L,n=10)。
1.3 糖尿病肾病模型的建立糖尿病肾病模型采用一侧肾脏切除术+链脲佐菌素(STZ)腹腔注射建立[3]。大鼠适应性饲养1周后行单肾切除术,手术均经背部入路切除右侧肾脏,大鼠术后恢复1周,采用单次腹腔注射STZ 45 mg/kg(临用前以p H 4.2的0.1 mol/L柠檬酸-柠檬酸三钠缓冲液新鲜配制)。STZ注射72 h后尾静脉采血并测定随机血糖,7 d后复测随机血糖,以2次随机血糖≥16.7 mmol/L确定为糖尿病造模成功。正常对照大鼠予以等体积溶剂(柠檬酸缓冲液)腹腔注射。造模后每4周测量大鼠体质量,实时监测糖尿病大鼠血糖及一般情况。
1.4 药物干预糖尿病模型建立后第16周开始药物干预。NX+B、DN+B组给予洛汀新10 mg/(kg·d)[4];NX+L、DN+L组给予氯沙坦20 mg/(kg·d)[5];对照组均给予等量生理盐水;各组大鼠灌胃给药。IR注射大鼠均给予4 U/d甘精胰岛素注射液皮下注射(早晚各2 U)。
1.5 取材和病理观察药物干预8周。处死大鼠前1 d称量体质量、收集尿液、测量血糖等。予戊巴比妥钠45 mg/kg腹腔注射,迅速分离肾脏,取肾皮质,40 m L/L甲醛固定24 h,乙醇梯度脱水,氯仿透明,石蜡包埋,切片机切片,石蜡切片行PAS染色,显微镜下观察肾小球结构。
1.6 放免法检测大鼠血中AngⅡ水平腹主动脉采血收集于1.5 m L EP管,室温下静置1 h,3 000 r/min离心10 min,取上清,-80℃保存,AngⅡ放射免疫分析药盒,按说明书步骤混匀试剂和样本,4℃放置15 min,3 500 r/min离心15 min,吸上清液,测定沉淀数[c/min,放免仪器(北京原子高科股份有限公司):r-911全自动放免计数仪]。按说明书提供的公式计算检测结果。
1.7 Western blot检测肾小球podocin和nephrin的蛋白表达提取肾小球[6]:取肾脏组织,4℃生理盐水冲洗,剥离肾包膜,用剪刀把肾皮质剪成碎块。将研磨组织放入重叠不锈钢筛网(孔径为250、106、75μm)。在最上层(250μm)筛网上用消毒针筒内蕊轻压肾皮质,同时用4℃生理盐水轻轻冲洗,滤入第2层筛网中(106μm)。继续用生理盐水冲洗第2层筛网,同时轻研组织,滤过第3层筛网中(75μm)。在第3层滤器上吸出少许组织,镜下观察,若只有纯净小球而几乎不含小管即可停止冲洗,(肾小球纯度>95%),收集此层组织移入离心管,离心后弃去上清,沉淀冻存于-80℃。由于本实验中提取的肾小球组织较少,故将各组组内大鼠肾小球组织混匀一并提取肾小球总蛋白。
用8 mmol/L UREA Buffer提取肾小球总蛋白并测定蛋白浓度[7]。取100μg蛋白变性后加入预制的SDS-聚丙烯酰胺凝胶电泳分离,半干法转入NC膜,1∶100 casin封闭1 h后加入一抗(nephrin、podocin按1∶500稀释;β-actin按1∶5 000稀释),4℃孵育过夜。TBST洗膜5 min×3,分别加入辣根过氧化物酶标记的山羊抗兔IgG二抗(nephrin和podocin)和山羊抗小鼠IgG二抗(β-actin)(1∶2 000),室温孵育2 h,TBST洗膜,5 min×3,ECL化学发光法曝光。以βactin为内参照,通过计算目的蛋白与内参蛋白的灰度比进行半定量分析,每个蛋白指标重复6次实验。
1.8 统计学处理应用SPSS 13.0软件包进行统计分析。计量资料以表示,采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 糖尿病肾病动物模型建立情况成模大鼠出现典型的多饮、多尿、多食、体质量减轻等糖尿病症状,精神萎靡,毛色暗淡,无光泽,易脱落。经洛汀新和科素亚干预后,糖尿病大鼠反应灵敏,毛发光泽度有所增加,多饮多尿症状有所减轻,体质量较DN组明显增加(P<0.05,表1),但各治疗组间大鼠体质量无统计学意义。C组大鼠饮食、饮水、尿量正常,毛发光亮,体质量自然增加。NX组大鼠与C组大鼠外观及一般情况均无明显差异,药物干预没有明显影响。
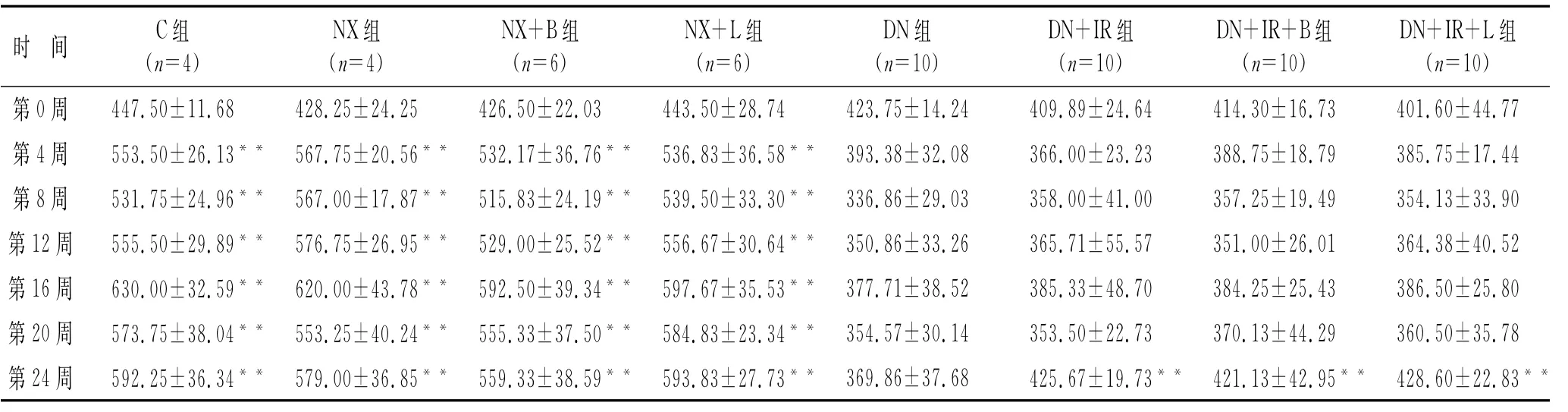
表1 各组大鼠体质量变化情况的比较Tab.1 Changes of body mass of the rats(g,x¯±s)
与C组相比,NX组、NX+B组、NX+L组、DN组、DN+IR组、DN+IR+B组、DN+IR+L组大鼠肾质量/体质重比值均升高(P均<0.01),其中DN组、DN+IR组、DN+IR+B组、DN+IR+L组比NX各组增加更明显(P<0.01),经药物治疗后各组肾质量/体质重比值均下降(P<0.01),但各治疗组间差异无统计学意义(P>0.05)。与C组相比,DN各组大鼠在接受胰岛素治疗前血糖明显增加(P<0.01),NX各组与C组相比血糖差别无统计学意义(P>0.05),接受胰岛素治疗各组大鼠血糖控制在10.0~20.0 mmol/L之间,较DN组血糖下降明显(P<0.01);与C组相比,DN各组尿糖明显升高(P<0.01),药物治疗对DN各组大鼠尿糖的改善差异无统计学意义(P>0.05);NX各组尿糖较C组无明显差异。DN各组尿蛋白/肌酐与C组相比,差异无统计学意义(P>0.05,表2)。
表2 各组大鼠血糖、尿糖、肾质量/体质量及尿蛋白/肌酐值Tab.2 Blood glucose,urine glucose,kidney mass/body mass ratio,and urine protein/creatinine value of the rats()
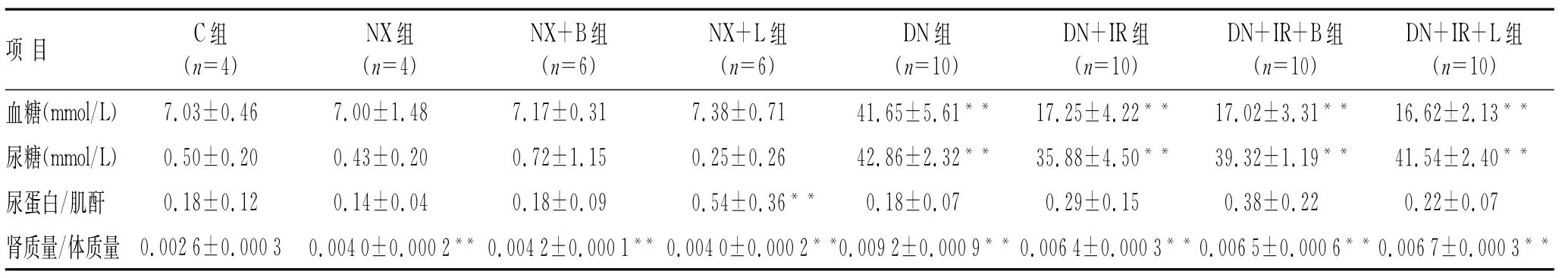
表2 各组大鼠血糖、尿糖、肾质量/体质量及尿蛋白/肌酐值Tab.2 Blood glucose,urine glucose,kidney mass/body mass ratio,and urine protein/creatinine value of the rats()
与C组相比,**P<0.01。C:正常对照组;NX:单肾切除组;NX+B:单肾切除+洛汀新组;NX+L:单肾切除+科素亚组;DN:糖尿病肾病组;DN +IR:糖尿病肾病+胰岛素注射组;DN+IR+B:糖尿病肾病+胰岛素注射+洛汀新组;DN+IR+L:糖尿病肾病+胰岛素注射+科素亚组。
项目C组(n=4) NX组(n=4) NX+B组(n=6) NX+L组(n=6) DN组(n=10) DN+IR组(n=10) DN+IR+B组(n=10) DN+IR+L组(n=10)血糖(mmol/L)7.03±0.46 7.00±1.48 7.17±0.31 7.38±0.71 41.65±5.61**17.25±4.22**17.02±3.31**16.62±2.13**尿糖(mmol/L)0.50±0.20 0.43±0.20 0.72±1.15 0.25±0.26 42.86±2.32**35.88±4.50**39.32±1.19**41.54±2.40**尿蛋白/肌酐0.18±0.12 0.14±0.04 0.18±0.09 0.54±0.36**0.18±0.07 0.29±0.15 0.38±0.22 0.22±0.07肾质量/体质量0.0026±0.000 3 0.0040±0.0002**0.0042±0.0001**0.0040±0.0002**0.0092±0.0009**0.0064±0.0003**0.0065±0.0006**0.0067±0.0003**
2.2 各组大鼠肾脏的病理表现NX各组大鼠肾小球轻度增大,未见明显系膜增殖,小管形态和结构均正常。DN组大鼠肾小球增大,肾小球系膜基质明显增多,系膜细胞数目增加,可见糖尿病肾病的典型病理改变——肾小囊脂滴形成[8](图1E),囊腔变窄,部分毛细血管腔狭窄;可见硬化的肾小球,小管细胞肥大、肿胀,管腔变窄,可见蛋白管型。DN+IR组DN病理改变未见明显好转。而DN+IR+B及DN+IR +L组大鼠肾小球增大、肾小囊腔变窄和小管管腔变窄等病理损伤程度减弱(图1)。

图1 各组大鼠肾脏病理显微图像Fig.1 Microscopic images of renal pathology of the rats(PAS-stained,×400)
2.3 各组大鼠血清中AngⅡ水平的比较NX+L组和DN+IR+L组大鼠血清中AngⅡ水平较C组明显增加(P<0.05),其余各组差异无统计学意义(图2)。
2.4 各组大鼠肾小球足细胞足突标志蛋白的表达情况 利用Western blot方法检测8组大鼠肾小球中足细胞标志物podocin及nephrin的表达水平。nephrin是裂孔隔膜的主要成分[9],特异性表达于裂孔隔膜上,为免疫球蛋白超家族的跨膜蛋白,参与细胞的信号转导、维持足细胞的正常形态和功能。podocin通过其C末端与nephrin及CD2AP的胞内段相互作用,可促进nephrin诱导的信号传导。本实验结果显示,与C组相比,DN组与DN+IR+B组podocin和nephrin的蛋白表达量均明显增加(P<0.05);而其余各组较C组podocin和nephrin的蛋白表达水平无统计学差异。DN组podocin和nephrin蛋白表达量与其他组相比,除DN+IR+B组无统计学差异外均明显增加(P<0.05,图3)。
3 讨 论
足细胞(肾小球脏层上皮细胞)是肾小球滤过屏障的重要组成部分。足细胞损伤可导致蛋白尿和肾小球硬化,而这正是DN的主要表现。目前,越来越多的研究显示足细胞损伤是DN发生发展的中心环节[10]。足细胞由胞体、主突和足突3部分组成[11]。足突是足细胞的标志性特征[12],相邻足突之间的桥接结构称之为裂孔隔膜,由nephrin、podocin、P钙调素蛋白和相关的细胞内蛋白如CD2AP等蛋白构成,裂孔隔膜及其相关蛋白和足突组成了防止蛋白尿滤过的重要分子屏障[13],其表达量的异常(高或低)均对足细胞的病理情况有一定的启示。故本实验中用nephrin及podocin蛋白作为足细胞标志物以评估足细胞损伤情况。
DN足细胞损伤可能的机制有:AngⅡ、氧化应激、高血糖、脂质代谢紊乱、炎症因子等[14]。其中AngⅡ增强可能是糖尿病肾病的病因之一。而AngⅡ导致足细胞损伤的可能机制为:①DN时,肾脏组织中肾素-血管紧张素系统(renin-angiotensin system,RAS)激活,足细胞中的AngⅡ浓度升高,而高浓度的AngⅡ则导致足细胞中氧化蛋白聚积及线粒体损伤[15];②高水平的AngⅡ通过增加足细胞内Ca2+活性,引起Rac-依赖的及活性氧族介导的F-actin细胞骨架重排,而导致足细胞损伤[16];③AngⅡ(协同TGF-B1)可通过p38 MAPK和caspase-3途径诱导足细胞凋亡[17]。有研究证实,在高糖环境下的体外足细胞和糖尿病动物模型中,血管紧张素原和AngⅡⅠ型受体(angiotensin type 1 receptor,AT1R)的m RNA和蛋白表达量显著增加,而适应性的AT1R增多又可进一步增强AngⅡ活性[18]。
因此,抑制AngⅡ很大程度上能阻止对足细胞有害的进程,减少足细胞损伤范围。一项大型的人体试验证明抑制AngⅡ可以减轻蛋白尿和慢性肾脏病进展[19]。
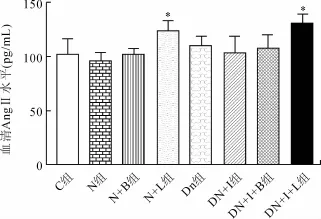
图2 各组大鼠血中AngⅡ水平的比较Fig.2 Comparison of serum AngⅡlevel in rats(pg/mL,)

图3 各组大鼠肾小球组织中podocin和nephrin蛋白表达变化(A)及半定量分析结果(B、C)Fig.3 Changes of podocin and nephrin protein expressions in glomeruli tissue of rats(A)and semi-quantitative analysis(B,C)
ACEI和ARBs药物都可以有效抑制AngⅡ收缩血管、升高血压、促进醛固酮分泌、水钠潴留、交感神经兴奋等的生理学效应,但其作用机制不同。ACEI药物通过抑制ACE的活性,使AngⅠ无法生成AngⅡ,抑制了AngⅡ的经典生成途径,从而使体内的AngⅡ水平下降。而ARBs药物则是通过选择性阻断血管紧张素受体1,与血管平滑肌、肾上腺、肾、心等组织的细胞膜上的AT1受体相结合,导致血管阻力降低,醛固酮分泌减少,而血清中AngⅡ水平反而增高。洛汀新和科素亚分别为ACEI类和ARB类的代表药物,也经常被用于治疗DN,其能有效改善蛋白尿、具有一定的肾脏保护作用也已广为人知。
本实验利用单肾切除+中低剂量(45 mg/kg) STZ注射成功建立了早期1型糖尿病肾病模型。经洛汀新和科素亚治疗后DN大鼠的肾脏病理明显好转,肾脏体积明显减小(肾质量/体质量明显减轻),足细胞标志物podocin和nephrin的蛋白表达接近正常水平(虽然本实验中podocin蛋白表达的半定量分析显示组内测量误差较大,但是每次测量整体趋势一致,且podocin的蛋白表达趋势与nephrin一致,故可以作为评估足细胞损伤情况的佐证)。另外,通过观察足细胞标志物podocin和nephrin的蛋白表达水平发现,早期DN大鼠由于肾小球体积增加导致的足细胞相应肥大,足细胞标志蛋白的表达不降反升,但经降糖干预后podocin和nephrin的蛋白表达水平明显下降(接近正常水平),而经洛汀新治疗大鼠,两种足细胞标志蛋白的表达水平又明显升高,则可能是修复受损足细胞的一种表现。本实验中我们还观察到,给予科素亚治疗的大鼠(包括单肾切除组和糖尿病肾病模型组)血中AngⅡ水平均明显升高。其机制可能为,一方面由于科素亚没有非竞争性阻断所有AT1受体[20],肾小球旁器对肾素产生的反馈抑制作用消失所致;另一方面,由于DN情况下RAS系统激活,循环中不断产生AngⅡ,而科素亚与AT1受体结合后这些AngⅡ不能与AT1受体结合故而堆积于循环中。而不断积累的AngⅡ一旦与不能被科素亚所阻断的AT1受体结合,则可能将进一步导致肾小球足细胞损伤。
综上所述,DN情况下肾脏组织中RAS活跃,足细胞中AngⅡ水平升高,高水平的AngⅡ通过激活氧化应激、Ca2+活性异常及p38 MAPK和caspase-3途径诱导足细胞凋亡等途径导致足细胞损伤。而洛汀新和科素亚均可以通过阻断RAS系统,阻止AngⅡ在足细胞中发挥作用而起到一定的足细胞保护作用。而相对科素亚具有升高AngⅡ水平的作用而言,洛汀新能从源头上抑制血管紧张素原向AngⅡ的转化,有效地降低循环中AngⅡ水平,从而展示出更好的足细胞保护作用潜力。
[1]YANG WY,LU JM,WENG JP,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362 (25):2425-2426.
[2]李慧秀.糖尿病肾病发病机制及治疗进展[J].重庆医学,2013,42(21):2545-2568.
[3]雷作熹,罗仁,董晓蕾,等.STZ诱导糖尿病肾病大鼠模型的建立[J].中国实验动物学报,2005,13(3):163-170.
[4]LIU CX,HU Q,WANG Y,et al.Angiotensin-converting enzyme(ACE)2 overexpression ameliorates glomerular injury in a rat model of diabetic nephropathy:a comparison with ACE inhibition[J].Mol Med,2011,17(1-2):59-69.
[5]LEE MY,SHIM MS,KIM BH,et al.Effects of spironolactone and Losartan on diabetic nephropathy in a type 2 diabetic rat model[J].Diabetes Metab J,2011,35(2):130-137.
[6]WU LL,ZHE F,CUI SY,et al.Rapamycin upregulates autophagy by inhibiting the m TOR-ULK1 pathway,resulting in reduced podocyte injury[J].PLOS ONE,2013,8(5):e63799.
[7]WANG XD,LAPI E,SULLIAN A,et al.SUMO-modified nuclear cyclin D1 bypasses Ras-induced senescence[J].Cell Death Differ,2011,18(2):304-314.
[8]邹万忠.肾活检病理学[M].第2版.北京:北京大学医学出版社,2009:129-143.
[9]SHANKLAND SJ.The podocytes response to injury:role in proteinuria and glomerulosclerosis[J].Kidney Int,2006,69 (12):2131-21471.
[10]DALLA-VESTRA M,MASERIO A,ROITER AM,et al.Is podocyte injury relevant in diabetic nephropathy?Studies in patients with type 2 diabetes[J].Diabetes,2003,52(4):1031-1035.
[11]戴厚永.足细胞损伤与糖尿病肾病关系的研究进展[J].医学综述,2013,19(17):3173-3175.
[12]ZANONE MM,FAVARO E.Expression of nephrin by human pancreatic islet endothelial cells[J].Diabetologia,2005,48 (9):1789-1797.
[13]李金红,陶建瓴,李航.足细胞损伤与糖尿病肾病的研究现状[J].中国医学科学院学报,2010,32(5):590-596.
[14]DURVASULA RV,PETERMANN AT,HIROMURA K,et al.Activation of a local tissue angiotensin system in podocytes by mechanical strain[J].Kidney Int,2004,65(1):30-39.
[15]HSU HH,HOFFMANN S,ENDLICH N,et al.Mechanisms of angiotensin II signaling on cytoskeleton of podocytes[J]. Mol Med,2008,86(12):1379-1394.
[16]HOFFMANN S,PODLICH D,HAHNEL B,et al.Angiotensin II type 1 receptor overexpression in podocytes induces glomerulosclerosis in transgenic rats[J].J Am Soc Nephrol,2004,15(6):1475-1487.
[17]KIM SH,JANG YW,HWANG P,et al.The reno-protective effect of aphosphoinositide 3-kinase inhibitor wortmannin on streptozotocin-induced proteinuric renal disease rats[J].Exp Mol Med,2012,44(1):45-51.
[18]YOO TH,LI JJ.Activation of the renin-angio-tensin system within podocytes in diabetes[J].Kidney Int,2007,71(10):1019-1027.
[19]YADAV A,VALLABU S,ARORA S,et al.ANG II promotes autophagy in podocytes[J].Am J Physiol Cell Physiol,2010,299(2):C488-496.
[20]孙红亮.血管紧张素转换酶抑制剂联合血管紧张素受体拮抗剂治疗早期糖尿病肾病的疗效分析[J].检验医学与临床,2013,10(6):713-715.
(编辑 韩维栋)
The protective effects of Lotensin and Cozaar on podocytes in diabetic nephropathy rats
XIAO Meng-yun1,WANG Xiao-dan2,HONG Quan2,ZHAO De-long2,YU Lu3(1.Graduate School,Southern Medical University,Guangzhou 510515;2.Department of Nephrology,PLA General Hospital,Beijing 100039;3.Department of Nephrology,No.305 Hospital of PLA,Beijing 100017,China)
ObjectiveTo investigate the effects of angiotensin Ⅱ(AngⅡ)on podocytes in diabetic
nephropathy(DN)rats and observe the protective effects of Lotensin,angiotensin-converting enzyme inhibitor,and Cozaar,angiotensinⅡreceptor blocker,on podocytes in DN rat models.MethodsWe divided 60 rats randomly into 8 groups:normal control group,unilateral nephrectomy group,unilateral nephrectomy+Lotensin group[10 mg/(kg·d),intragastric administration],unilateral nephrectomy+Cozaar group[20 mg/(kg·d),intragastric administration],diabetic nephropathy group,diabetic nephropathy+insulin injection group(4 U glargine subcutaneous injection twice daily),diabetic nephropathy+insulin injection+Lotensin group,and diabetic nephropathy+insulin injection+Cozaar group.We modeled the typeⅠDN rats through unilateral(right) nephrectomy+intraperitoneal injection once at a dose of 45 mg/kg STZ.Intervention with Lotensin and Cozaar started after 16 weeks of the rat model construction.The rats were weighed every 4 weeks during the experiment.They were sacrificed at week 8 after the treatment;serum and urine were collected and the kidneys were harvested and weighed.Blood glucose,urine glucose,urine protein/creatinine and angiotensin II were detected.Glomeruli were isolated from one portion of the kidney,while the remaining kidney was prepared for histological study.The expressions of podocin and nephrin in the glomeruli were detected by Western blot analysis.Results①Compared with those in normal control group,blood glucose,urine glucose,and kidney weight/body weight significantly increased(P<0.01);weight loss was significant(P<0.01)in DN groups.Compared with that in DN group,weight increase was significant after treatment with Lotensin and Cozaar(P<0.05).②In DN group,renal pathology showed early-stage manifestations of DN(mesangial proliferation,increased mesangial matrix,swelling of renal tubular epithelial cells,tubular stenosis,and protein cast).These damages were improved in both Lotensin groups and Cozaar groups.③In Cozaar groups serum Ang II level was raised significantly compared with that in normal control group(P<0.05).④Protein expressions of podocin and nephrin were up-regulated in both DN group and Lotensin groups compared with those in normal control group(P<0.05).ConclusionBoth Lotensin and Cozaar can protect podocytes from damage by DN.Cozaar significantly increases serum AngⅡlevel,which makes Lotensin a promising drug in protecting podocytes in early DN.
Lotensin;Cozaar;diabetic nephropathy;podocyte;angiotensinⅡ
R587.1
A
1671-8259(2014)05-0659-06
10.7652/jdyxb201405018
2013-11-27
2014-04-17
国家自然科学基金资助项目(No.81370452) Supported by the National Natural Science Foundation of China(No.81370452)
喻陆,教授,博士生导师.E-mail:glczcwl@163.com
肖梦云(1988-),女(汉族),在读硕士.研究方向:自噬在糖尿病肾病足细胞损伤中的作用机制.E-mail:glcaizic@163.com
时间:2014-07-22 17∶17 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1717.015.html
