Ghrelin对大鼠小肠转运的作用及对中枢和胃肠道c-Fos表达的影响
2014-06-23史海涛赵菊辉赵红莉
王 燕,史海涛,秦 斌,姜 炅,赵菊辉,赵红莉
(西安交通大学医学院第二附属医院消化内科,陕西西安 710004)
Ghrelin对大鼠小肠转运的作用及对中枢和胃肠道c-Fos表达的影响
王 燕,史海涛,秦 斌,姜 炅,赵菊辉,赵红莉
(西安交通大学医学院第二附属医院消化内科,陕西西安 710004)
目的观察静脉注射ghrelin对大鼠小肠转运的作用及对中枢和胃肠道c-Fos表达的影响。方法大鼠禁食24 h,静脉注射ghrelin(2、5、10、20μg/kg),经预先埋置在十二指肠内的导管注入伊文氏蓝溶液,观察不同剂量ghrelin对大鼠小肠转运的影响及ghrelin受体拮抗剂(D-Lys3)GHRP-6对其作用的影响。采用免疫组织化学和图像分析方法观察静脉给予ghrelin对大鼠中枢和胃肠道的c-Fos蛋白的激活情况;观察(D-Lys3)GHRP-6对ghrelin作用的影响。结果①静脉给予ghrelin 2μg/kg对大鼠小肠转运无显著影响,给予ghrelin 5、10、20μg/kg可剂量依赖性促进小肠转运,此作用可被(D-Lys3)GHRP-6阻断。②静脉注射ghrelin可激活中枢多个部位的c-Fos表达,包括下丘脑室旁核、弓状核、杏仁内侧核、迷走神经背核、孤束核、延髓最后区和胸腰段脊髓背角c-Fos均有表达;胃、十二指肠、空肠和近端结肠肠神经丛的c-Fos有不同程度的表达,其中以胃和近端结肠的c-Fos表达最为显著。应用ghrelin受体拮抗剂(D-Lys3)GHRP-6可抑制ghrelin激活的c-Fos表达。结论Ghrelin可促进小肠转运,其促动力作用由其受体GHS-R所介导;静脉给予ghrelin可通过肠神经系统和中枢神经系统调节小肠运动。
ghrelin;小肠转运;生长激素促分泌素受体;胃肠动力;c-Fos
Ghrelin是生长激素促分泌素受体(growth hormone secretagogue receptor,GHS-R)的内源性配体[1],是由28个氨基酸组成的小分子多肽,在胃肠道和中枢神经系统均有分布。Ghrelin受体的激活可发挥多种生理学作用,可刺激胃酸分泌和胃排空,加快小肠蠕动,改善术后肠梗阻症状[2-5]。我们近来研究也发现,ghrelin可促进大鼠消化间期复合肌电活动[6],但关于ghrelin对小肠转运的影响很少有研究。中枢神经系统(central nervous system,CNS)和肠神经系统(enteric nervous system,ENS)在胃肠运动中起着重要作用。以往研究发现,ghrelin可通过中枢和外周机制促进胃肠运动,然而关于其具体作用机制的研究很少见报道。新近研究发现,腹腔注射ghrelin导致大鼠摄食增加,下丘脑弓状核、室旁核的c-Fos表达增加[7]。脑室和室旁核注入ghrelin可促进大鼠摄食,增加与摄食相关核团,如下丘脑室旁核、背内侧核、弓状核、延髓孤束核和最后区的c-Fos表达[8-10]。然而静脉注射ghrelin还可以增加哪些脑区的c-Fos表达,是否可增加与促消化道动力相关的核团的c-Fos表达,是否能增加脊髓的c-Fos表达,目前尚不清楚。静脉注射ghrelin对完整消化道c-Fos表达的影响尚未见报道。我们的实验观察了静脉给予ghrelin对大鼠消化道和上述脑区c-Fos表达的影响,重点分析了与促消化道运动相关核团的c-Fos表达的变化,并观察了受体拮抗剂对ghrelin作用的影响,为阐明并进一步研究ghrelin的促动力机制提供实验依据和理论基础。
1 材料与方法
1.1 实验动物成年健康SD大鼠,雌雄不拘,体质量220~240 g,由西安交通大学医学院实验动物中心提供。
1.2 仪器和试剂Ghrelin受体拮抗剂(D-Lys3) GHRP-6由美国Anaspec公司提供,兔抗鼠c-Fos抗体由美国Santa Cruz公司提供,Ghrelin由美国凤凰生物制品有限公司提供。
1.3 小肠转运试验①埋置十二指肠导管。大鼠禁食18 h,腹腔注射100 g/L水合氯醛400 mg/kg麻醉,外科无菌操作下沿腹正中线剪开腹壁肌肉以及腹膜,用18 G针头在十二指肠距幽门1 cm处刺入肠腔,将一根聚乙烯导管(外径1.0 mm,内径0.7 mm)经穿刺孔置入十二指肠腔内,导管在肠腔内留置约1cm,用丝线将导管缝合固定。在右上腹和肩胛间区之间做皮下隧道,将导管固定于体外,以防鼠咬损坏。用大头针封住导管的露出端。术后大鼠分笼单独清洁饲养,恢复1周可用于实验。②小肠转运的测量。实验大鼠随即分为5组(n=8),禁食24 h,分别经尾静脉给予ghrelin(2、5、10、20μg/kg,溶于0.3 m L生理盐水)。对照组给予0.3 m L生理盐水。经静脉给予药物或生理盐水后,经十二指肠导管注入0.1 mL伊文氏蓝溶液(50 mg/mL溶于生理盐水中)。用0.1 mL生理盐水冲洗导管,以保证导管内的染料均进入十二指肠。20 min后,脱颈椎处死大鼠,立即打开腹腔,用丝线扎紧幽门和回盲瓣,剪取上端自幽门、下端至回盲瓣的肠管。仔细分离肠系膜,将小肠摆放成直线。避免拉伸小肠,以防止肠内容物流动。测量从幽门到回盲瓣的肠管长度为“小肠总长度”,从幽门至染料移行的前沿为“染料移行长度”,计算小肠转运率(%)=[染料移行长度(cm)/小肠总长度(cm)]×100%。
为观察ghrelin受体拮抗剂(D-Lys3)GHRP-6在ghrelin促小肠转运中的作用,经尾静脉给予(DLys3)GHRP-6(0.37 mg/kg),10 min后再给予ghrelin(20μg/kg),观察小肠转运变化,方法同上。
1.4 染色标本制备大鼠每组6只,分别经颈静脉注入ghrelin,生理盐水,生理盐水+ghrelin,(D-Lys3) GHRP-6+ghrelin。上述药物剂量为ghrelin 20μg/kg,ghrelin受体拮抗剂(D-Lys3)GHRP-6 0.37 mg/kg。注射药物后大鼠禁食,自由饮水,90 min后用100 g/L水合氯醛(400 mg/kg)腹腔注射麻醉。经左心室穿刺至主动脉,用生理盐水快速冲血管,用40 g/L多聚甲醛缓冲液经升主动脉灌注。开颅取脑和胸腰段脊髓,分别剪取胃、十二指肠、空肠、回肠、盲肠、近端结肠和远端结肠,生理盐水冲净,经多聚甲醛缓冲液后固定8 h,20~30 g/L蔗糖溶液梯度脱水,液氮速冻后,组织包埋剂包埋,恒冷冰冻切片机切片。
1.5 c-Fos染色采用SABC法进行c-Fos免疫组织化学染色。脑片采用漂染法,胃肠组织切片采用片染法。胃肠组织切片在PBS中浸泡5 min,采用微波修复(高火3 min,再小火10 min),晾至室温。脑片在PBS中浸泡5 min,再和修复后的切片一起用稀盐酸泡30 min,以使细胞核形态清楚。PBS洗10 min×3次,30 m L/L Triton X-100室温孵育40 min,PBS漂洗5 min×3次,30 m L/L H2O2室温孵育30 min,PBS漂洗10 min×3次。正常山羊血清封闭(37℃,90 min),兔抗鼠c-Fos抗体孵育(1∶500,4℃42 h)。PBS漂洗20 min×3次,生物素标记羊抗兔IgG孵育(4℃18 h),PBS漂洗20 min×3次。ABC复合物孵育(37℃30 min),PBS漂洗20 min×3次,DAB显色,PBS冲洗终止反应。脑片进行裱片、晾干,再和胃肠组织切片一起脱水、透明、封片。用0.01 mol/LPBS代替第一抗体做阴性对照。
1.6c-Fos阳性细胞记数共选取14个中枢核团或亚核进行分析,其中包括GHS-R分布较多的部位以及对消化道功能有重要调控作用的核团。对每只大鼠每个核团的c-Fos阳性细胞记数时,必须在相同平面选择6张脑片,胸腰段脊髓选取20张脊髓片计数,在高倍镜下结合Paxinos-Waston图谱分别数两侧核团,算出平均值(在室旁核给药时数一侧室旁核)。胃肠道c-Fos阳性细胞的记数采用每只大鼠选取6张切片,每张切片在高倍镜下随机数5个视野,算出平均值。
1.7统计学处理结果采用表示,统计学分析采用t检验及单因素方差分析(SPSS 13.0软件),组间比较采用LSD-t检验,数据经过方差齐性检验,方差齐同,P<0.05表示差异有统计学意义。
2 结 果
2.1 静脉注射ghrelin对小肠转运的影响对照组大鼠小肠转运率为(62.7±6.2)%。与对照组相比,静脉给予ghrelin 2μg/kg时小肠转运率无统计学差异[(70.2±6.4)%,P>0.05],给予ghrelin 5μg/kg[小肠转运率(73.7±7.1)%,P<0.05],10μg/kg[小肠转运率为(75.5±6.9)%,P<0.01]和20μg/kg[小肠转运率为(80.9±8.5)%,P<0.001]呈剂量依赖性地促进小肠转运。Ghrelin受体拮抗剂(DLys3)GHRP-6单独应用对小肠转运有抑制作用[小肠转运率为(52.6±7.6)%,P<0.05],与ghrelin联合应用则显著阻断了其促动力作用[转运率为(65.7 ±7.2)%,P<0.05,图1]。

图1 静脉注射ghrelin对禁食24 h大鼠小肠转运的影响Fig.1 Effects of ghrelin on small intestinal transit in 24 h fasted rats()
2.2 静脉注射ghrelin对中枢c-Fos表达的影响c-Fos的免疫反应阳性为胞核呈黄色或深棕色,胞质无表达。我们的研究发现,生理盐水对照组大鼠的c-Fos表达很少,而给大鼠静脉注射ghrelin后可诱导CNS内广泛部位的c-Fos表达,最突出的部位是下丘脑室旁核(periventricular nucleus,PVN)、弓状核(arcuate nucleus,ARC)、杏仁内侧核(medial amygdaloid nucleus,Me)、迷走神经背核(dorsal motor nucleus of vagus,DMN)、孤束核(nucleus of solitary tract,NTS)、延髓最后区(area postrema,AP)及胸腰段脊髓背角(cornu dorsale medullae spinalis,CDMS)(图2、图3)。然而,下丘脑腹内侧核(ventromedial hypothalamic nucleus,VMH)、下丘脑背内侧核(dorsomedial hypothalamic nucleus,DMH)、外侧区(lateral hypothalamic area,LH)、海马(hippocamp,HIP)、杏仁中央核(central amygdaloid nucleus,Ce A)、杏仁基底外侧核(basolateral nucleus of the amygdala,BL)及脑桥臂旁核(parabrachial nucleus,PBN)均未见表达。
2.3 静脉注射ghrelin对胃肠道c-Fos表达的影响盐水对照组大鼠的胃肠道肠神经丛c-Fos表达很少,甚至没有表达。静脉注射ghrelin不同程度地增加了大鼠胃、十二指肠、空肠和近端结肠的肠神经丛的c-Fos表达,其中以胃和近端结肠的c-Fos表达最为显著(图4、图5)。回肠、盲肠和远端结肠的c-Fos表达与对照组相比无显著差异。
2.4 Ghrelin受体拮抗剂(D-Lys3)GHRP-6对ghrelin激活中枢c-Fos的影响静脉给予ghrelin受体拮抗剂(D-Lys3)GHRP-6后再给予ghrelin,观察脑内各核团的c-Fos表达的变化。实验所选取的核团为静脉给予ghrelin后c-Fos表达增加的核团,包括下丘脑室旁核、弓状核、迷走神经背核,孤束核、延髓最后区,胸腰段脊髓背角、杏仁内侧核。结果发现,ghrelin受体拮抗剂(D-Lys3)GHRP-6不同程度地抑制了ghrelin激活的中枢各核团c-Fos的表达,即c-Fos表达明显减少(表1)。
2.5 Ghrelin受体拮抗剂(D-Lys3)GHRP-6对ghrelin激活胃肠道c-Fos表达的影响静脉给予(DLys3)GHRP-6后再给予ghrelin,观察肠神经丛的c-Fos表达的变化。实验选取的肠神经丛为静脉给予ghrelin后c-Fos表达增加的肠神经丛,包括胃、十二指肠、空肠和近端结肠肠神经丛。结果发现,ghrelin受体拮抗剂(D-Lys3)GHRP-6不同程度地抑制了ghrelin激活的胃肠神经丛c-Fos表达,即c-Fos表达均明显减少(表2)。
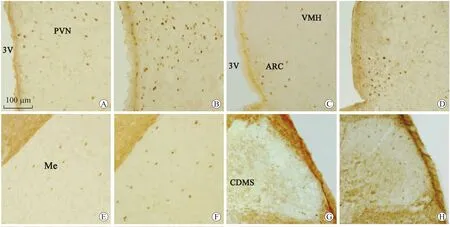

图2 静脉注射ghrelin对中枢c-Fos表达的影响Fig.2 Expression of c-Fos in the CNS after intravenous injection of ghrelin

图3 静脉注射ghrelin后中枢各核团c-Fos表达的比较Fig.3 Comparison of c-Fos expression in various nucleus clusters in the CNS after intravenous injection of ghrelin

图4 静脉注射ghrelin对胃肠道c-Fos表达的影响Fig.4 Expression of c-Fos in the digestive tract after intravenous injection of ghrelin
表1 Ghrelin受体拮抗剂(D-Lys3)GHRP-6对ghrelin激活中枢c-Fos的影响Tab.1 Expression of c-Fos in the CNS after injection of(D-Lys3)GHRP-6(n=6,)

表1 Ghrelin受体拮抗剂(D-Lys3)GHRP-6对ghrelin激活中枢c-Fos的影响Tab.1 Expression of c-Fos in the CNS after injection of(D-Lys3)GHRP-6(n=6,)
与生理盐水+ghrelin组比较,*P<0.05,**P<0.01,***P<0.001。
hrelin 40.85±4.67 94.28±9.00 41.14±4.21 60.65±7.51 54.17±8.27 35.38±4.09 28.07±2.57 (D-Lys3)GHRP-6+ghrelin 19.67±1.73**41.85±3.64***25.58±4.40*30.32±4.15**19.21±2.89**16.24±2.10**13.17±0.96组别弓状核室旁核杏仁内侧核延髓最后区孤束核迷走神经背核胸腰段脊髓背角生理盐水+g ***
表2 Ghrelin受体拮抗剂(D-Lys3)GHRP-6对ghrelin激活胃肠道c-Fos表达的影响Tab.2 Expression of c-Fos in the digestive tract after injection of(D-Lys3)GHRP-6(n=6,)

表2 Ghrelin受体拮抗剂(D-Lys3)GHRP-6对ghrelin激活胃肠道c-Fos表达的影响Tab.2 Expression of c-Fos in the digestive tract after injection of(D-Lys3)GHRP-6(n=6,)
与生理盐水+ghrelin组比较,*P<0.05,**P<0.01。
hrelin 7.62±0.86 7.16±0.77 4.84±0.73 8.54±1.03 (D-Lys3)GHRP-6+ghrelin 3.00±0.49**3.21±0.47**2.61±0.45*4.36±0.55组别胃十二指肠空肠近端结肠生理盐水+g **

图5 静脉注射ghrelin后胃肠道c-Fos表达的比较Fig.5 Comparison of c-Fos expression in the digestive tract after intravenous injection of ghrelin
3 讨 论
Ghrelin作为新近发现的脑肠肽,其生理作用及其机制也越来越受到重视。新近研究发现,ghrelin可加速胃排空、增加胃酸分泌及促进结肠运动[11-14]。目前,关于ghrelin对小肠转运的影响很少有研究。FUKUDA等[15]通过观察ghrelin对大鼠胃排空和小肠转运的影响,提出ghrelin可能通过内在的神经通路和对辣椒辣素敏感的感觉传入神经系统促进胃肠运动,但没有研究量效关系和ghrelin受体拮抗剂的作用。并且FUKUDA等采用将Na51CrO4灌入大鼠胃中的方法来观察小肠转运,这受到胃排空的影响,并不是单独的小肠转运。我们的实验通过在大鼠十二指肠埋置导管,经导管注入伊文氏蓝来观察ghrelin对小肠转运的影响,并建立量效曲线,观察了ghrelin受体拮抗剂的作用。结果发现,静脉注射ghrelin可促进大鼠小肠转运,并呈剂量依赖性关系,ghrelin受体拮抗剂(D-Lys3)GHRP-6显著阻断ghrelin的促动力作用。
BRON等[2]通过原位杂交等方法证实ghrelin受体GHS-R存在于大鼠的下丘脑、延髓、心脏、胃肠道等处。DASS和XU等[3-5]利用荧光免疫组织化学方法在人、大鼠和豚鼠的胃和结肠也发现ghrelin及其受体。然而,ghrelin调控胃肠运动的具体机制尚不明确,研究其对神经元的作用则十分必要。C-Fos基因是一种即刻早期基因,被称为核内“第三信使”。在生理情况下,大多数细胞中有很低水平的c-Fos表达。在药物、电刺激及缺血等情况下,c-Fos表达可在数分钟或数十分钟内显著增多。因此,c-Fos的表达可作为神经元受刺激后激活的标志。MASUDA等[16]发现静脉注射ghrelin 0.8~20μg/kg可刺激胃酸分泌和胃排空。FUJINO等[17]证实静脉注射ghrelin 4~40μg/kg均可促进禁食期间的胃肠动力。我们以往的研究也发现,ghrelin 20μg/kg可显著增强消化间期胃肠的肌电活动[6]。因此,本实验选定20μg/kg为观察ghrelin对胃肠道c-Fos表达变化的静脉给药量,认为其为促进胃肠动力的有效剂量。实验结果显示,静脉注射ghrelin可增加下丘脑室旁核、弓状核和杏仁内侧核的c-Fos表达,同时增加迷走神经背侧复合体(dorsal vagal complex,DVC)(包括迷走神经背核、孤束核及最后区)、胸腰段脊髓背角的c-Fos表达;臂旁核、下丘脑腹内侧核、背内侧核及海马等处的c-Fos表达也有增加,但与对照组相比,无统计学差异。应用ghrelin受体拮抗剂显著减弱了ghrelin的作用。然而,RUTER等[7]研究发现,腹腔注射ghrelin不能增加DVC的c-Fos表达。我们的研究与此有差异,这可能是由于静脉和腹腔两种给药途径不同所致,或由于尚不明确的其他因素(如给药剂量不同或大鼠种属不同)。
下丘脑和脑干是调节机体功能的两个重要结构。下丘脑与其他脑区有复杂而广泛的纤维联系,它不仅通过神经和血管途径调节脑垂体前、后叶激素的分泌和释放,而且还参与调节自主神经系统,如控制水盐代谢、调节体温、摄食、睡眠等内脏活动以及情绪等。已有研究证实下丘脑的弓状核和室旁核参与CNS对胃肠道功能的调节[18-20]。脑干的主要功能是维持个体生命,包括心跳、呼吸、消化、体温、睡眠等重要生理功能。脑干与下丘脑有密切联系,脑干的孤束核神经元可发出纤维直接投射到达下丘脑,同时也可接受下丘脑的下行投射。脑干的DVC,可将来自脊髓的神经冲动传至大脑,是脑肠轴的中枢整合部位。本研究发现,静脉注射ghrelin使下丘脑核团和脑干DVC的c-Fos表达增加,提示下丘脑核团参与了ghrelin的生物学作用,脑干参与ghrelin的信息传递。
然而,c-Fos阳性细胞在一些核团的分布与GHS-R的分布并不完全一致。例如,在下丘脑外侧区、海马CA3和CA4区和杏仁基底内侧核的GHS-R分布很丰富,但却缺乏c-Fos表达。我们推测ghrelin对这些核团c-Fos的激活可能需要其他因子的参与(至少对c-Fos来说),或者通过除GHS-R之外的受体发挥其功能。
静脉注射ghrelin使下丘脑室旁核和弓状核的c-Fos表达显著增多。以往研究表明,GHS-R在室旁核和弓状核上均有广泛表达,ghrlein在弓状核也有较多表达[1,21]。弓状核是表达许多摄食相关神经肽的感受器,如瘦素及ghrelin。弓状核神经纤维联系十分广泛,与室旁核、腹内侧核、孤束核等都有丰富的纤维投射,除了在摄食调节和能量平衡中起重要作用外,还直接参加消化道运动功能的调节[20-22]。室旁核接受来自弓状核的神经纤维,两者共同参与中枢对摄食、能量代谢、胃肠活动等的调控。由于弓状核位于血脑屏障之外,可以直接接受来自外周的传入信号,我们推测静脉注射的ghrelin还有可能直接作用于弓状核上的GHS-R,通过弓状核发出的神经纤维投射到室旁核,间接激活室旁核的c-Fos,通过受体后的信号传导作用于下丘脑及低位脑干,最后经过迷走神经将神经冲动传至胃肠平滑肌,调节大鼠的胃肠运动。
ENS是存在于胃肠壁内一个独立于大脑之外的完整神经网络,其释放的神经递质和神经调质种类很多,控制胃肠道的运动、分泌、血流及水、电解质转运等活动,并把胃肠与CNS及ANS联系起来。大量研究表明,ENS有其独立性,它包括控制胃肠运动的反射回路[23-24]。本实验发现静脉注射ghrelin不同程度地增加了大鼠胃、十二指肠、空肠和近端结肠肠神经丛的c-Fos表达,其中以胃和近端结肠的c-Fos表达增加最为显著,这可能是由于胃和近端结肠中的GHS-R含量最为丰富所致。回肠、盲肠和远端结肠的c-Fos表达与对照组相比无统计学差异。这可能是因为GHS-R在这些部位的分布相对较少所致。消化系统受ANS和ENS的双重支配,ENS(黏膜下神经丛和肌间神经丛网络)既包括传入神经元、传出神经元,也包括中间神经元,能完成局部反射。本研究结果提示,静脉给予ghrelin可能直接作用于ENS,通过局部反射调节胃肠运动。由于ENS中的第一级传入神经元胞体的轴突可深入到腰骶髓的后角,或经由迷走神经到达脑干和下丘脑。因此,进一步提示静脉给予ghrelin也可能通过激活脊髓的c-Fos,通过脊髓-脑干DVC-下丘脑通路,将信号传至中枢,调节胃肠活动。
综上所述,ghrelin可剂量依赖性地促进大鼠小肠转运,其受体拮抗剂则抑制小肠转运。静脉给予ghrelin可通过ENS和CNS调节小肠运动。这些或许为阐明ghrelin的生理学作用及其机制提供依据,为治疗胃肠动力障碍性疾病提供一定的理论基础。
[1]KOJIMA M,HOSODA H,DATE Y,et al.Ghrelin is a growthhormone-releasing acylated peptide from stomach[J].Nature,1999,402(6762):656-660.
[2]BRON R,YIN L,RUSSO D,et al.Expression of the ghrelin receptor gene in neurons of the medulla oblongata of the rat[J].J Comp Neurol,2013,521(12):2680-2702.
[3]DASS NB,MUNONYARA M,BASSIL AK,et al.Growth hormone secretagogue receptors in rat and human gastrointestinal tract and the effects of ghrelin[J].Neuroscience,2003,120(2):443-453.
[4]XU L,DEPOORTERE I,TOMASETTO C,et al.Evidence for the presence of motilin,ghrelin,and the motilin and ghrelin receptor in neurons of the myenteric plexus[J].Regul Pept,2005,124(1-3):119-125.
[5]RUCHALA M,RAFINSKA L,KOSOWICZ J,et al.The analysis of exogenous ghrelin plasma activity and tissue distribution[J].Neuro Endocrinol Lett,2012,33(2):191-195.
[6]王燕,董蕾,邹百仓,等.Ghrelin对大鼠消化间期胃肠肌电活动的影响及其受体在消化道的分布特征[J].西安交通大学学报:医学版,2014,35(2):186-190.
[7]RUTER J,KOBELT P,TEBBE JJ,et al.Intraperitoneal injection of ghrelin induces Fos expression in the paraventricular nucleus of the hypothalamus in rats[J].Brain Res,2003,991 (1-2):26-33.
[8]OLSZEWSKI PK,GRACE MK,BILLINGTON CJ,et al.Hypothalamic paraventricular injections of ghrelin:effect on feeding and c-Fos immunoreactivity[J].Peptides,2003,24(6):919-923.
[9]SAKURAZAWA N,MANO-OTAGIRI A,NEMOTO T,et al. Effects of intracerebroventricular ghrelin on food intake and Fos expression in the arcuate nucleus of the hypothalamus in female rats vary with estrous cycle phase[J].Neurosci Lett,2013,541:204-208.
[10]CONE JJ,MCCUTCHEON JE,ROITMAN MF.Ghrelin acts as an interface between physiological state and phasic dopamine signaling[J].J Neurosci,2014,34(14):4905-4913.
[11]CHEUNG CK,WU JC.Role of ghrelin in the pathophysiology of gastrointestinal disease[J].Gut Liver,2013,7(5):505-512.
[12]FUJIMIYA M,ATAKA K,ASAKAWA A,et al.Ghrelin,desacyl ghrelin and obestatin on the gastrointestinal motility[J].Peptides,2011,32(11):2348-2351.
[13]MONDAL A,XIE Z,MIYANO Y,et al.Coordination of motilin and ghrelin regulates the migrating motor complex of gastrointestinal motility in Suncus murinus[J].Am J Physiol Gastrointest Liver Physiol,2012,302(10):G1207-G1215.
[14]信芳杰,徐珞.Ghrelin对豚鼠胃窦平滑肌细胞钙离子浓度的影响及与NO关系研究[J].现代生物医学进展,2010,10(2):216-220.
[15]FUKUDA H,MIZUTA Y,ISOMOTO H,et al.Ghrelin enhances gastric motility through direct stimulation of intrinsic neural pathways and capsaicin-sensitive afferent neurones in rats[J].Scand J Gastroenterol,2004,39(12):1209-1214.
[16]MASUDA Y,TANAKA T,INOMATA N,et al.Ghrelin stimulates gastric acid secretion and motility in rats[J].Biochem Biophys Res Commun,2000,276(3):905-908.
[17]FUJINO K,INUI A,ASAKAWA A,et al.Ghrelin induces fasted motor activity of the gastrointestinal tract in conscious fed rats[J].J Physiol,2003,550(Pt 1):227-240.
[8]LOPEZ M,LELLIOTT CJ,VIDAL-PUIG A.Hypothalamic fatty acid metabolism:A housekeeping pathway that regulates food intake[J].Bioessays,2007,29(3):248-261.
[19]FUJIMIYA M,ATAKA K,ASAKAWA A,et al.Regulation of gastroduodenal motility:acyl ghrelin,des-acyl ghrelin and obestatin and hypothalamic peptides[J].Digestion,2012,85 (2):90-94.
[20]XU L,GAO S,GUO F,et al.Effect of motilin on gastric distension sensitive neurons in arcuate nucleus and gastric motility in rat[J].Neurogastroenterol Motil,2011,23(3):265-270.
[21]WANG Q,LIU C,UCHIDA A,et al.Arcuate Ag RP neurons mediate orexigenic and glucoregulatory actions of ghrelin[J]. Mol Metab,2013,3(1):64-72.
[22]GONG Y,XU L,GUO F,et al.Effects of ghrelin on gastric distension sensitive neurons and gastric motility in the lateral septum andarcuate nucleus regulation[J].J Gastroenterol,2014,49(2):219-230.
[23]周吕.肠神经系统及其研究进展[J].生物学通报,1996,31 (11):4-7.
[24]FERRINI F,SALIO C,LOSSI L,et al.Ghrelin in central neurons[J].Curr Neuropharmacol,2009,7(1):37-49.
(编辑 韩维栋)
Effects of ghrelin on small intestinal transit and c-Fos expression in the central and digestive tracts in rats
WANG Yan,SHI Hai-tao,QIN Bin,JIANG Jiong,ZHAO Ju-hui,ZHAO-Hongli
(Department of Gastroenterology,the Second Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710004,China)
ObjectiveTo investigate the effects and mechanism of ghrelin injected intravenously on small intestinal transit and c-Fos expression in the central nervous system(CNS)and the enteric nervous system(ENS).MethodsRats were supplied with an intraduodenal catheter.After fasted for 24 h,rats
intravenous injection of ghrelin(2,5,10 or 20μg/kg)respectively.The small intestinal transit was measured after instillation of Evans blue through the intraduodenal catheter.Another group of rats were pretreated with ghrelin receptor antagonist(D-Lys3)GHRP-6 10 min before ghrelin administration.The c-Fos activation on the CNS and ENS through intravenous injection of ghrelin was studied by the immunohistochemistry and imaging analysis.Results①Ghrelin 2μg/kg had little influence on small intestinal transit;however,ghrelin 5,10 or 20μg/kg enhanced small intestinal transit dose-dependently.This effect was inhibited by its receptor antagonist.②In the CNS,the c-Fos expression of several nuclei such as the arcuate nucleus and paraventricular nucleus was increased by intravenous injection of ghrelin.And the c-Fos expression in the duodenum,jejunum,and proximate colon was also activated by ghrelin.The receptor antagonist inhibited the effects of ghrelin.ConclusionGhrelin appears to be closely related to small intestinal motility.Its receptor GHS-R regulates its activity.Intravenous administration of ghrelin can regulate the intestinal motility through the ENS and CNS.
ghrelin;small intestinal transit;growth hormone secretagogue receptor(GHS-R);digestive tracts;motility;
R333.3
A
1671-8259(2014)05-0611-07
10.7652/jdyxb201405009c-Fos
2014-04-21
2014-05-18
国家自然科学基金资助项目(No.81100258) Supported by the National Natural Science Foundation of China(No.81100258)
王燕(1978-),女(汉族),博士,主治医师.研究方向:消化道运动和胃肠激素.E-mail:miss.wangyan@gmail.com
时间:2014-07-22 18∶17 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1817.019.html
