木质纤维素水解液副产物对东方伊萨酵母乙醇发酵的影响
2014-06-19王风芹刘亚琼张瑞汪媛媛谢慧宋安东
王风芹,刘亚琼,张瑞,汪媛媛,谢慧,宋安东
河南农业大学生命科学学院 农业部农业微生物酶工程重点实验室,河南 郑州 450002
能源问题是当今世界面临的关系国家安全和社会经济可持续发展的焦点,纤维乙醇因其原料来源广泛、清洁、可再生的特点被认为是21世纪发展循环经济的有效途径[1-2]。纤维乙醇同步糖化发酵 (Simultaneous saccharification and fermentation,SSF) 将木质纤维素水解与乙醇发酵同步进行,理论上可解除水解得到的葡萄糖等产物对纤维素酶的反馈抑制,提高酶解效率,缩短发酵周期,降低生产成本[3]。然而传统乙醇发酵菌株的最适发酵温度在28−32 ℃之间,一般不超过35 ℃[4],而木质纤维素的最适糖化温度为 45−50 ℃,发酵温度与糖化温度不协调是限制 SSF顺利进行的关键问题之一,耐高温乙醇发酵菌株的选育是解决该问题的有效途径。
木质纤维素资源主要由纤维素、半纤维素和木质素组成,通过预处理技术可以使木质纤维素结构松散,将更多的纤维素和半纤维素暴露在表面,促进后期的水解糖化[5]。预处理后的木质纤维素经水解糖化后形成以葡萄糖和木糖为主的单糖水解液,高效利用葡萄糖等单糖是纤维质原料乙醇发酵的关键。但是葡萄糖等糖类物质以及木质素降解的多种单环芳香族化合物在高温下会进一步发生多种形式的分解和氧化反应,产生有机酸 (甲酸、乙酸和少量的乙酰丙酸等)、醛类 (糠醛、羟甲基糠醛等) 和芳香族化合物等对微生物生长和代谢具有抑制作用的副产物,这些副产物通过抑制酵母菌的有氧呼吸、增加细胞膜的透性、破坏酶活性等抑制微生物菌体生长和产物生成[6-7]。
课题组从烟叶腐解物中分离筛选出一株东方伊萨酵母Issatchenkia orientalisHN-1菌株,该菌株具有发酵温度高 (38−45 ℃)、耐高糖(150 g/L葡萄糖) 等特点,利用含43.08 g/L葡萄糖的玉米秸秆水解液发酵,乙醇产量达20.74 g/L,为理论转化率的91.6%[8]。本文研究了木质纤维素水解液主要副产物甲酸钠、乙酸钠、糠醛、5-HMF和香草醛等对东方伊萨酵母菌体生长和乙醇生成的影响,以进一步客观评判该菌株用于纤维乙醇发酵的潜力,并为提高东方伊萨酵母纤维水解液乙醇发酵的生产效率奠定理论基础。
1 材料与方法
1.1 菌种
东方伊萨酵母Issatchenkia orientalisHN-1,由河南农业大学微生物能源工程研究室分离保存。
1.2 培养基
1.2.1 菌种活化培养基
葡萄糖20 g,酵母浸粉10 g,蛋白胨20 g,固体培养基加入琼脂粉20 g,蒸馏水定容至1 L,115 ℃灭菌15 min。
1.2.2 发酵培养基
葡萄糖50 g,酵母粉3 g,蛋白胨5 g,尿素0.2 g,磷酸氢二铵0.1 g,蒸馏水定容至1 L,pH值5.5,115 ℃灭菌15 min。
1.3 试验设计
1.3.1 抑制物对乙醇发酵单因素影响试验设计
选取甲酸钠、乙酸钠、糠醛、5-羟甲基糠醛 (5-hydroxymethylfurfural, 5-HMF) 和香草醛作为考察因素,其添加浓度分别为:甲酸钠:0、1、2、3、5 g/L;乙酸钠:0、2.5、4、6、8 g/L;糠醛:0、0.2、0.4、1、2 g/L;5-HMF:0、0.1、0.3、1 g/L;香草醛:0、0.5、0.75、1、2 g/L。
1.3.2 抑制物对乙醇发酵交互影响试验设计
选取甲酸钠、糠醛、5-HMF和香草醛4种抑制物为自变量考察因素,以发酵36 h时乙醇浓度为响应值,运用中心组合试验设计 (The Central Composite experimental Design, CCD),考察抑制物交互作用对乙醇发酵的影响。中心组合试验设计因素和水平如表1所示。
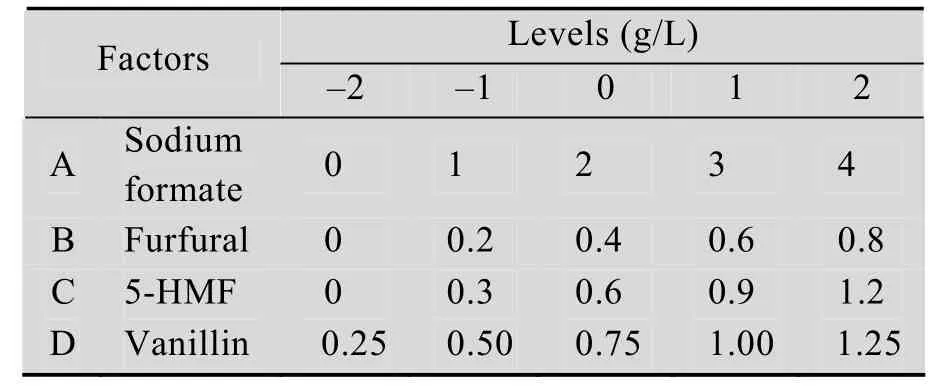
表1 中心组合试验设计因素水平表Table 1 Factors and levels of CCD test
1.4 菌种活化与扩大培养
取斜面保藏菌种接种至菌种活化固体斜面培养基,38 ℃培养48 h后,接3环斜面活化菌种至装有50 mL液体活化培养基的250 mL三角瓶中,38 ℃、180 r/min摇床培养10 h。
1.5 发酵试验
按照试验设计在300 mL三角瓶中配制添加不同浓度抑制物的发酵培养基,115 ℃灭菌15 min,按体积分数为10%接种量接入活化好的种子液,控制最终装液量240 mL,38 ℃静置发酵。
1.6 测定方法
取发酵液2 mL,9 000 r/min离心10 min,液体部分留样测定乙醇和葡萄糖浓度,细胞沉淀用质量分数0.85% NaCl水洗2次后重悬浮,用分光光度计测定660 nm处吸光值,利用吸光值与菌体细胞干重标准曲线 (y=1.493 8x+0.009 8,R2=0.9 9 9 3) 换算细胞干质量。
乙醇浓度采用气相色谱仪 (Agilent technologies 7890A GC System) 进行测定,色谱柱:DB-FFAP (30 m×0.32 mm×1 µm);检测器:FID (250 ℃);进样温度:200 ℃;柱温:60 ℃;氮气:25 mL/min;氢气:40 mL/min;空气:45 mL/min。
葡萄糖浓度采用 P680高效液相色谱仪(Diodex) 进行测定, RI 101示差折光 (Shodex)检测器;色谱柱:Xbridge Amide 3.5 (4.6 mm×250 mm,Waters);流动相:V乙腈: V水=8∶2(V∶V),流速:0.8 mL/min;柱温:35 ℃。
甲酸钠和乙酸钠浓度采用高效液相色谱仪(HPLC, Shimadzu, Kyoto, Japan) 进行测定,色谱柱:Rezex ROA-Organic Acid H+,紫外检测器 (SPD-15C UV-210 nm),柱温45 ℃,流动相:0.005 mol/L H2SO4(pH 2),流速:0.6 mL/min,进样量:20 μL。
糠醛、5-羟甲基糠醛和香草醛浓度采用Waters 2695高效液相色谱仪,Waters Sunfire C18色谱柱 (250 mm×4.6 mm),Waters 2996二极管矩阵检测器。流动相:A:1%乙酸,B:甲醇,梯度洗脱:0−15 min,72% A;15−35 min,53% A。流速:0.6 mL/min,柱温:30 ℃,检测波长:280 nm,进样量:10 μL。
2 结果与分析
2.1 木质纤维素水解液副产物对乙醇发酵的单因素影响试验
2.1.1 甲酸钠和乙酸钠对乙醇发酵的影响
甲酸钠和乙酸钠对东方伊萨酵母 HN-1菌株的菌体生长具有显著抑制作用,添加1–5 g/L甲酸钠或2.5−8.0 g/L乙酸钠,发酵36 h时菌体细胞干重分别较对照下降了 25.04%−37.02%和28.83%−43.82% (图1)。添加1 g/L甲酸钠可以提高菌体对葡萄糖的利用速率和发酵前期(24 h前) 乙醇的生成速率,然而培养基中添加1−5 g/L甲酸钠对乙醇的最终产量影响不大 (图1A)。低于8 g/L乙酸钠添加量对葡萄糖利用速率影响不明显;4 g/L乙酸钠添加能显著促进发酵前期乙醇产生速率,当乙酸钠添加量达到8 g/L时,乙醇产量提高10.23% (图1B)。东方伊萨酵母不具有降解转化甲酸钠和乙酸钠的能力。
2.1.2 糠醛和5-HMF对乙醇发酵的影响
糠醛和5-HMF是木质纤维素水解液中主要的醛类抑制物。由图 2可以看出,糠醛主要抑制菌体的生长,培养基中添加0.4−2 g/L糠醛,发酵 36 h时菌体细胞干重较对照下降了20.06%−37.60%。培养基中添加0.2−2 g/L糠醛对乙醇产量和乙醇产生速率没有显著影响 (图2A)。添加0.1−1 g/L 5-HMF对菌体生长影响不显著。培养基中5-HMF浓度< 1 g/L时,对乙醇产量没有显著影响;添加1 g/L 5-HMF,乙醇产量较对照降低了11.2%,达到显著水平 (图2B)。在发酵12 h和24 h时,2 g/L糠醛和1 g/L 5-HMF可被东方伊萨酵母HN-1完全转化利用。
2.1.3 香草醛对乙醇发酵的影响
香草醛可以显著抑制微生物菌体的生长,添加0.5−2 g/L香草醛,发酵36 h时菌体细胞干重较对照下降了26.39%−52.64%。与对照相比,添加2 g/L香草醛,乙醇产生速率和乙醇产量均显著降低,发酵 36 h时乙醇产量较对照降低20.38% (图 3)。

图1 甲酸钠 (A) 和乙酸钠 (B) 对东方伊萨酵母乙醇发酵的影响Fig. 1 The influence of sodium formate (A) and sodium acetic (B) on ethanol fermentation of Issatchenkia orientalis HN-1.

图2 糠醛 (A) 和5-HMF (B) 对东方伊萨酵母乙醇发酵的影响Fig. 2 The influence of furfural (A) and 5-HMF (B) on ethanol fermentation of Issatchenkia orientalis HN-1.

图3 香草醛对东方伊萨酵母乙醇发酵的影响Fig. 3 The influence of Vanillin on ethanol fermentation of Issatchenkia orientalis HN-1.
2.2 抑制物交互作用对乙醇发酵的影响
根据单因素试验结果及已有的文献报道,选取甲酸钠、糠醛、5-HMF和香草醛4个因素,运用响应面中心组合试验设计研究抑制物交互作用对乙醇发酵的影响。根据设计结果,共安排30组试验,发酵36 h的乙醇产量结果见表2,其方差分析结果如表3所示。甲酸、糠醛、5-HMF和香草醛 4种抑制物交互作用对乙醇发酵影响不显著,但香草醛对乙醇产量影响的P值为0.038 9,达到显著水平。
3 讨论
木质纤维素预处理过程中产生的有机酸、醛类和芳香族化合物等副产物对微生物生长和代谢的抑制作用是影响木质纤维素原料乙醇转化过程的重要因素之一。其中有机酸分子如甲酸、乙酸、乙酰丙酸等通过简单扩散进入细胞内并发生解离,使细胞膜内H+浓度增加,通过破坏膜电位使ATP不能正常生成,最终引起细胞生长代谢缓慢或死亡[9];纤维水解液中以糠醛和 5-HMF为主的醛类物质能在一定程度上增加细胞膜的通透性,破坏酶活性,直接或间接影响糖代谢途径[10-11];香草醛、丁香醛等酚类物质是木质素的主要降解物,这类物质能够破坏细胞膜的完整性,影响膜的选择透过性,从而影响菌体生长,其中,低分子量的香草醛负作用更明显,1 g/L香草醛即开始抑制菌体生长[12]。

表2 中心组合试验设计方案和发酵36 h时乙醇产量试验结果Table 2 Design of CCD test and results of ethanol production fermented at 36 h

表3 CCD结果方差分析表Table 3 Uviariate analysis of variance of CCD test
覃香香等研究发现,东方伊萨酵母S-7对半纤维素水解液中的微生物代谢抑制物乙酸、糠醛、香草醛、阿魏酸等具有较强的生物降解能力,可用于半纤维素水解液发酵生产木糖醇的生物脱毒[13]。本文研究了从烟叶腐解物中分离筛选出的耐高温东方伊萨酵母 HN-1菌株对木质纤维素水解液副产物甲酸钠、乙酸钠、糠醛、5-羟甲基糠醛和香草醛的耐受能力,结果表明,木质纤维素水解液中含有的有毒物质对东方伊萨酵母菌体生长具有显著抑制作用,添加1−5 g/L甲酸钠、2.5−8.0g/L乙酸钠、0.2−2 g/L糠醛或0.5−2 g/L香草醛,发酵36 h时菌体细胞干重分别较对照下降了25.04%−37.02%、28.83%−43.82%、20.06%−37.60%和 26.39%−52.64%。试验浓度范围内,甲酸钠、乙酸钠、糠醛和5-HMF对乙醇发酵影响较小,但添加2 g/L香草醛或1 g/L 5-HMF可使乙醇产量分别降低20.38%和11.2% (图2和3)。中心组合试验结果表明,各抑制物对乙醇发酵影响的交互作用不显著。表 4总结了木质纤维素水解液有毒物质对东方伊萨酵母 HN-1及其他微生物乙醇发酵影响的起始浓度。由表 4可以看出,东方伊萨酵母HN-1对甲酸、乙酸、糠醛、5-HMF和香草醛的耐受能力与酿酒酵母相当,对糠醛、5-HMF和香草醛的耐受能力高于I. orientalisIPE 100。
表 5总结了近年来文献报道的木质纤维素酶水解液中各有毒副产物的含量,除采用酸热预处理得到的水解液中5-HMF含量及Alriksson利用蒸汽爆破和补料酶解得到的高糖水解液中甲酸和乙酸的含量较高外,其他水解液中5种有毒物质的含量均低于对东方伊萨酵母乙醇发酵产生抑制作用的起始浓度。本课题组建立了玉米秸秆的稀酸预处理和酶水解技术体系,采用补料酶解得到的水解液中葡萄糖和木糖的浓度分别为43.08和27.13 g/L,东方伊萨酵母HN-1利用该水解液发酵乙醇产量为20.74 g/L,乙醇产率为0.468 g/g,达到理论转化率的91.6%[8]。该水解液中甲酸、乙酸、糠醛、5-HMF和香草醛的含量分别为:550、1 940、72.89、18、1.78 mg/L(表5),水解液浓缩3倍后,各抑制物浓度将达到1 650、5 820、219、54和5.34 g/L,仍低于对东方伊萨酵母 HN-1乙醇发酵产生抑制的起始浓度。以上研究结果表明东方伊萨酵母具有较强的耐毒能力,可适用于木质纤维素水解液乙醇发酵。

表4 木质纤维素水解液有毒副产物影响乙醇发酵的起始抑制浓度Table 4 The initial inhibiting concentration of inhibitory compounds in lignocellulosic hydrolysate on ethanol production

表5 木质纤维素酶水解液中各有毒抑制物含量Table 5 The content of inhibitory compounds in lignocellulosic enzyme hydrlysates
4 结论
东方伊萨酵母 HN-1对木质纤维素水解液有毒副产物甲酸钠、乙酸钠、糠醛、5-HMF和香草醛具有较强的耐受能力,除添加2 g/L香草醛或添加1 g/L 5-HMF可使乙醇产量分别降低
20.38%和11.2%外,其他抑制物的添加对乙醇的生成未有显著影响。但是,当副产物浓度较高时,可以显著抑制菌体生长。中心组合试验结果表明各抑制物交互作用对乙醇的生成影响不显著。
[1]Wu YJ. Model and analytic framework for fuel project development under constraint conditions.Trans Chin Soc Agric Eng, 2011, 27(1): 261–267(in Chinese).
吴彦俊. 约束条件下燃料项目发展的模型及分析框架. 农业工程学报, 2011, 27(1): 261–267.
[2]Wei M, Zhao J, Liu JL, et al. Research progress of ethanol production from plant fiber material.Biomass Chem Eng, 2013, 47(3): 48–51 (in Chinese).
卫民, 赵剑, 刘军利, 等. 植物纤维原料水解生产乙醇的研究进展. 生物质化学工程, 2013,47(3): 48–51.
[3]Zhang DJ, Huang ZY, Zhang ZY. Advances on conversion of lignocellulosic biomass to ethanol by SSF process. J Beijing Forestry Univ, 2001, 23(6):52–55 (in Chinese).
张德江, 黄镇亚, 张志毅. 木质纤维素生物量一步法 (SSF) 转化成乙醇的研究进展. 北京林业大学学报, 2001, 23(6): 52–55.
[4]Zhang L, Jin YL, Chen Q, et al. Optimization of ethanol production by thermotolerant and high alcohol producing yeast using response surface analysis. Chin J Appl Environ Biol, 2011, 17(3):311–316 (in Chinese).
张良, 靳艳玲, 陈谦, 等. 耐高温酵母高浓度发酵生产燃料乙醇工艺优化. 应用与环境生物学报, 2011, 17(3): 311–316.
[5]Wang NN, Xie XL, Yang XH. Research on the pretreatment of corn stalks by diluted acid at low temperature. Sci Technol Eng, 2011, 11(11):2607–2609 (in Chinese).
王娜娜, 谢小莉, 杨翔华. 低温稀酸预处理玉米秸秆的研究. 科学技术与工程, 2011, 11(11):2607–2609.
[6]Zhuang JP, Lin L, Pang CS, et al. Research advances in detoxification of lignocellulose hydrolysates making. Mod Chem Ind, 2009, 29(2):19–23 (in Chinese).
庄军平, 林鹿, 庞春生, 等. 木质纤维素稀水解液脱毒研究进展. 现代化工, 2009, 29(2): 19–23.
[7]Lin ZL, Slininger PJ, Dien BS, et al. Adaptive response of yeasts to furfural and 5-hydroxymethylfurfrural and new chemical evidence for HMF conversion to 2,5-bis-hydroxymethlfuran. J Ind Microbiol Biotechnol, 2004, 31(8): 354–352.
[8]Wang FQ, Wang YY, Tao X, et al. Ethanol fermentation characteristics of thermotolerantIssatchenkia orientalis. Trans Chin Soc Agric Eng,2014, 30(3): 180–187 (in Chinese).
王风芹, 汪媛媛, 陶西, 等. 耐高温东方伊萨酵母乙醇发酵特性. 农业工程学报, 2014, 30(3):180–187.
[9]Palmqvist E, Grage H. Main and interaction effects of acetic acid, furfural and P-hydroxybenzoic acid on growth and ethanol productivity of yeasts.Biotechnol Bioeng, 1999, 63(1): 446–551.
[10]Helle S, Cameron D, Lam Janet, et al. Effect of inhibitory compounds found in biomasss hydrolysates on growth and xylose fermentation by a genetically engineered strain ofS. cerecisiae.Enzyme Microb Technol, 2003, 33(6): 786–792.
[11]Li BZ, Yuan YJ. Transcriptome shifts in response to furfural and acetic acid inSaccharomyces cervisiae. Appl Microbiol Biotechnol, 2010, 86(6):1915–1924.
[12]Almeida JR, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates bySaccharomyces cerevisiae. J Chem Technol Biotechnol, 2007,82(4): 340–349.
[13]Qin XX, Zhang HR, Cai AH, et al. Biodegradation of xylitol fermentation inhibitors byIssatchenkia orientalis. Guangxi Sci, 2010, 17(4): 358–362 (in Chinese).
覃香香, 张厚瑞, 蔡爱华, 等. 东方伊萨酵母降解木糖醇发酵抑制物研究. 广西科学, 2010,17(4) : 358–362.
[14]Lin B, Zhao XQ, Ge XM, et al. The effects of dilute acid hydrolysate by-products of corn stover on ethanol fermentation of xylose-utilisingSaccharomycescerevisiae6508-127. Chin Biotechnol, 2007, 27(7): 61–67 (in Chinese).
林贝, 赵心清, 葛旭萌, 等. 玉米秸秆酸解副产物对重组酿酒酵母6508-127发酵的影响. 中国生物工程杂志, 2007, 27(7) : 61–67.
[15]Zeng FZ, Wei M, Chen YR, et al. Effects of by-products from acid hydrolysis of biomass on fuel ethanol fermentation of thermotolerantSaccharomyces cerevisiae. Chem Ind Forest Prod,2011, 31(1): 115–118 (in Chinese).
曾凡洲, 卫民, 陈育如, 等. 生物质酸水解副产物对糖液酵母发酵制备燃料乙醇的影响. 林产化学与工业, 2011, 31(1): 115–118.
[16]Huang H, Guo X, Li D, et al. Identification of crucial yeast inhibitors in bio-ethanol and improvement of fermentation at high pH and high total solids. Bioresour Technol, 2011, 102(16):7486–7493.
[17]Maiorella B, Blanch HW, Wilke CR. By-product inhibition effects on ethanolic fermentation bySaccharomyces cerevisiae. Biotechnol Bioeng,1983, 25(1): 103–121.
[18]Rumbold K, van Buijsen HJJ, Overkamp KM, et al.Microbial production host selection for converting second-generation feedstocks into bioproducts.Microb Cell Fact, 2009, 8: 64.
[19]Keating JD, Panganiban C, Mansfield SD.Tolerance and adaptation of ethanologenic yeasts to lignocellulosic inhibitory compounds. Biotechnol Bioeng, 2006, 93(6): 1196–1206.
[20]Kwon YJ, Ma AZ, Li Q, et al. Effect of lignocellulosic inhibitory compounds on growth and ethanol fermentation of newly-isolated thermotolerantIssatchenkia orientalis. Bioresour Technol, 2011, 102(17): 8099–8104.
[21]Du JF, Zhang WZ, Wang YS, et al. Effects of different pretreatment on enzymatic hydrolysis and ethanol fermentation in maize straw. J Shenyang Agric Univ, 2011, 42(2): 195–199 (in Chinese).
杜金峰, 张万忠, 王云山, 等. 不同预处理方法对玉米秸秆酶解和乙醇发酵的影响. 沈阳农业大学学报, 2011, 42(2): 195–199.
[22]Zha Y, Muilwijk B, Coulier L, et al. Inhibitory compounds in lignocellulosic biomass hydrolysates during hydrolysate fermentation processes. J Bioprocess Biotechniq, 2012, 2: 112.
[23]Alriksson B, Cavka A, Jönsson LJ. Improving the fermentability of enzymatic hydrolysates of lignocelluloses through chemicalin-situdetoxification with reducing agents. Bioresour Technol, 2011, 102(2): 1254–1263.
