Fe3O4-H2O2类Fenton体系催化降解苯酚
2014-06-15杨基先郭海娟城市水资源与水环境国家重点实验室哈尔滨工业大学50090哈尔滨哈尔滨工业大学宜兴环保研究院24205江苏宜兴台州学院38000浙江台州
杨基先,王 蕾,2,郭海娟,3,马 放,2(.城市水资源与水环境国家重点实验室(哈尔滨工业大学),50090哈尔滨;2.哈尔滨工业大学宜兴环保研究院,24205江苏宜兴;3.台州学院,38000浙江台州)
Fe3O4-H2O2类Fenton体系催化降解苯酚
杨基先1,王 蕾1,2,郭海娟1,3,马 放1,2
(1.城市水资源与水环境国家重点实验室(哈尔滨工业大学),150090哈尔滨;2.哈尔滨工业大学宜兴环保研究院,214205江苏宜兴;3.台州学院,318000浙江台州)
为提出基于新型磁纳米Fe3O4催化剂的类Fenton体系,采用化学共沉淀法制备磁纳米Fe3O4,用四甲基氢氧化铵(TMAH)对所制备的磁纳米Fe3O4进行表面改性,就Fe3O4-H2O2类Fenton体系对苯酚废水的处理效果进行探讨,考察催化剂投量、H2O2浓度、pH、反应时间等因素对COD和挥发酚去除率的影响.结果表明:磁纳米颗粒平均粒径为30 nm,并在20~100 nm内呈现良好的粒度分布.不同剂量TMAH包覆的3种催化剂经超声预处理后,在室温(13℃)下对50mg/L苯酚(相当于112mg/LCOD)的降解效果基本一致.当催化剂投量为0.8mmol/L、H2O2浓度为2.0mmol/L、pH为4.5、反应时间180min时,COD去除率最高可达72%;催化剂投量为0.4 mmol/L、H2O2浓度为2.0 mmol/L、pH为4.5、反应时间为90 min时,挥发酚的去除率接近100%.而在重复使用方面,3#Fe3O4-TMAH(2mL)催化剂的回用性最好,4次反应COD的去除率分别为73%、29%、28%、26%,挥发酚去除率分别为100%、84%、67%、54%.该类Fenton体系具有不产生多余泥量的优点,且磁纳米催化剂在外磁场作用下可实现快速分离回收.
磁纳米Fe3O4;类Fenton体系;催化降解;苯酚
Fenton法是一种不需高温、高压且工艺设备简单的化学氧化水处理技术.Fe2+与H2O2反应产生氧化能力很强的羟基自由基(·OH),其氧化电位仅次于氟,高达2.8 V,可无选择地氧化水中的大多数有机物,目前广泛应用于废水处理中[1-4].Fenton工艺以其较强的氧化能力在水处理中表现出一定的优势,但仍存在一些问题,如产生大量含铁污泥、适用pH范围窄(2~4)、H2O2利用率低等[5].因此,制备新型催化剂拓宽Fenton氧化体系的pH适应范围、减少系统产泥量、开展Fe2+/Fe3+固定化技术等,是对传统Fenton体系进行改进的研究方向之一.近十年来,纳米功能材料及纳米技术的发展在水处理领域表现出巨大的应用空间.磁纳米Fe3O4颗粒因具有高反应活性、高磁感率、易于制备和改性、低毒性、在外磁场作用下易回收再利用等优点[6-7],在材料学领域受到广泛关注.Fe3O4磁纳米颗粒中同时含有Fe2+和Fe3+,研究表明,Fe3O4可以作为催化剂激发H2O2产生·OH,从而将不同类型的有机污染物氧化成CO2和H2O[8-10].Wang N等[11-12]认为磁纳米Fe3O4可在较大的pH范围内(pH 3~9)催化H2O2氧化水中的有机污染物.目前,国内外材料学领域对该方面的研究比较多,主要关注磁纳米颗粒的制备以及材料的改性,但在水处理领域,利用Fe3O4磁纳米催化剂对传统Fenton体系进行改进的深入研究还比较少.
针对传统Fenton法存在的产泥量大、调节pH药剂用量大等问题,提出基于新型磁纳米Fe3O4催化剂的类Fenton体系.探讨该体系对苯酚的处理效果,为其在特种工业废水中的实际应用提供基础.磁纳米Fe3O4的合成采用化学共沉淀法,并使用不同剂量的TMAH对其进行表面改性,探索催化剂与H2O2构成的类Fenton体系在不同运行参数条件下降解苯酚的效果,并考察了催化剂的重复利用效果.
1 实 验
1.1 实验试剂
六水合三氯化铁(FeCl3·6 H2O)、四水合氯化亚铁(FeCl2·4H2O)、氨水、四甲基氢氧化铵25%水溶液(TMAH)、双氧水、苯酚,以上试剂均为分析纯,购于上海展云化工有限公司.实验用水为高纯水.
1.2 实验方法
1.2.1 磁纳米Fe3O4的制备
采用化学共沉淀法制备Fe3O4.取摩尔比为2∶1的FeCl3及FeCl2溶液于烧杯中,磁力搅拌的同时缓慢逐滴加入1.0 mol/L氨水作为沉淀剂,之后将烧杯静置于钕铁硼磁铁(φ=50 mm,h= 10 mm)上,用高纯水冲洗至上清液为中性.最后分别加入0,1.0,2.0 mL TMAH,超声后移入样品瓶中密封保存.编号为1#Fe3O4、2#Fe3O4-TMAH(1 mL)、3#Fe3O4-TMAH(2 mL).
1.2.2 磁纳米Fe3O4类Fenton反应降解苯酚
在室温(13℃)条件下,取200 mL 50 mg/L苯酚(相当于112mg/LCOD)于烧杯中,置于六联磁力搅拌机上搅拌,控制转速2 r/s,用0.5mol/L硫酸和0.5 mol/L氢氧化钠调节pH,投加催化剂和H2O2开始反应.反应结束后将烧杯置于钕铁硼磁铁(φ=50 mm,h=10 mm)上沉淀10 min,通过测定上清液中COD和挥发酚的质量浓度确定相应的去除率,考察催化剂投量、H2O2浓度、pH、反应时间对苯酚降解效果的影响.
催化剂在使用前均超声10 min,使其在反应体系中充分分散,减少纳米颗粒团聚现象的发生.
1.2.3 催化剂的重复使用效果
如上操作进行Fe3O4-H2O2类Fenton体系降解苯酚的实验,每一周期反应结束时,将烧杯置于钕铁硼磁铁上进行磁纳米催化剂的分离回收,撇尽上清液,进行下一周期反应.催化剂重复使用4次,通过测定每个周期COD及挥发酚的去除率考察催化剂的重复使用效果.
1.3 分析项目及方法
磁纳米Fe3O4颗粒的粒径分布采用Malven粒度分析仪(ZEN 1600 Nano S,Malvern Instrument,UK)进行表征.颗粒的形貌采用场发射扫描电子显微镜FESEM(Zeiss Neon 40EsB FIB-SEM)进行表征.纳米颗粒的晶体参数采用X射线粉末衍射仪(XRD Bruker D8-Advance,Karlsruhe,Germany)进行表征,Cu-Kα,波长λ= 0.154 178 nm,管电压40 kV,电流30 mA,扫描范围20~80°,扫描速度1.29°/min.
COD采用快速消解分光光度法(HJ/T 399—2007)测定,挥发酚采用4-氨基安替比林分光光度法(HJ 503—2009)测定,仪器为16新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司).
2 结果与讨论
2.1 催化剂的表征
2.1.1 催化剂的粒度分布
如图1所示,所制备的Fe3O4磁纳米颗粒在20~100 nm内呈现良好的粒度分布,平均粒径为30 nm.图2为纳米颗粒的FESEM图,可以看出,纳米颗粒的形貌趋近球形,平均粒径为30 nm,与粒度分布的表征结果基本一致.
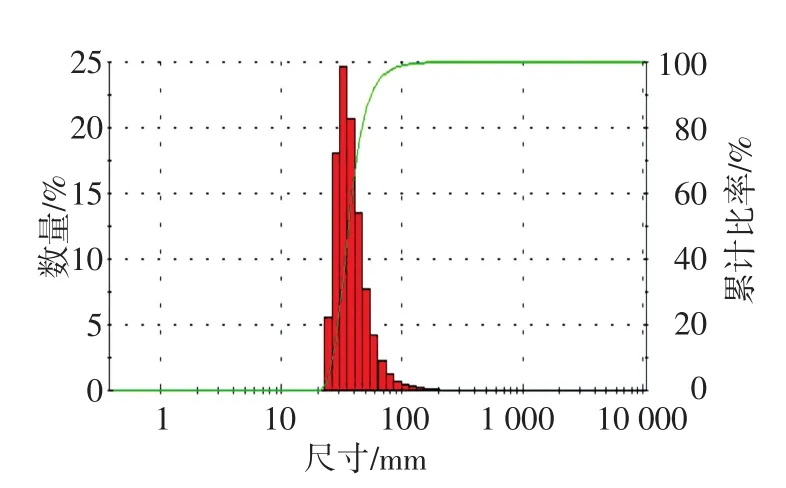
图1 纳米颗粒粒度分布

图2 纳米颗粒FESEM图
2.1.2 催化剂晶体参数
图3为纳米颗粒的XRD图,颗粒的衍射谱峰出现在2θ=30.39°,35.71°,43.38°,57.15°和62.81°处,与Fe3O4的X射线衍射标准卡JCPDS(19-0629)的图谱特征峰基本一致,产物为纯立方相的Fe3O4.

图3 纳米颗粒XRD图
2.2 苯酚降解效果分析
2.2.1 催化剂投量的影响
在H2O2浓度2.0 mmol/L、pH 4.5、反应时间180min时,考察不同催化剂投量(0.05,0.1,0.2,0.4,0.6,0.8,1.0,1.2 mmol/L)对COD、挥发酚去除率的影响,结果如图4所示.目前普遍认为H2O2与磁纳米Fe3O4反应产生·OH的机理为:H2O2吸附到催化剂表面形成络合物,电子由过渡态金属迁移到配体上,处于激发态的表面络合物解离至反应体系中,同时释放·OH[13-14].催化剂表面同时发生多种反应,竞争表面活性位点.当催化剂投量很少时,表面的活性位点达到饱和,无法进一步产生·OH,使COD和挥发酚的去除率较低.这解释了图中低催化剂用量(0.05~0.80 mmol/L)时,COD及挥发酚去除率低的现象.从图4可以看出,3种催化剂用量呈现基本相同的规律,在0.8 mmol/L时对COD的去除率达到最高,稳定在70%左右,继续增加催化剂的用量不能提高COD的去除率,这是由于H2O2已经被全部消耗;当催化剂用量为0.4 mmol/L时,挥发酚去除率接近100%.去除COD和挥发酚所需催化剂用量不同的原因在于:苯酚首先被氧化为醌类物质,即可表征为挥发酚的去除,随着有机物的进一步开环、降解,COD会进一步降低,这需要更多·OH的参与.
需要指出的是,不同剂量TMAH包覆的3种催化剂,在投量对苯酚去除效果的影响上未体现出较大差别,这是由于催化剂在使用前已充分超声处理,使其处于良好的分散状态,纳米颗粒的团聚性差异不大.
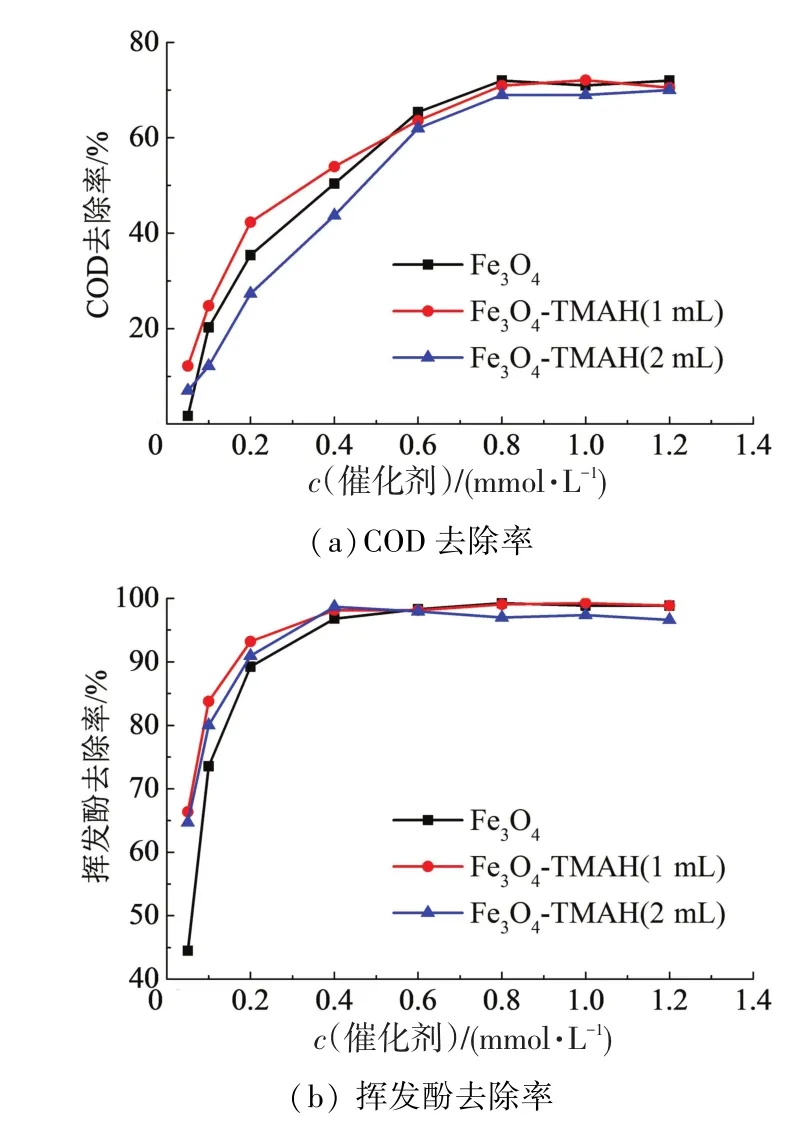
图4 催化剂用量对COD及挥发酚去除率的影响
2.2.2 H2O2投量的影响
在催化剂浓度0.8 mmol/L、pH 4.5、反应时间180min时,考察不同H2O2投量(0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0 mmol/L),对COD、挥发酚去除率的影响.如图5所示,H2O2用量在2.0mmol/L时,对COD的去除率达到最高,继续增加H2O2的用量,COD的去除率降低.H2O2用量在2.0 mmol/L时,挥发酚去除率接近100%,增加H2O2用量不会对挥发酚的去除造成影响.反应体系中生成的·OH(ORP=2.8 V)可以参与多种反应,如氧化苯酚、与Fe3O4表面反应、与H2O2反应等.H2O2过少时,不能产生足够多的·OH来降解有机物;而H2O2过量时,会与·OH反应生成氧化能力较弱的HO2·(ORP=1.7 V),无法进一步矿化中间产物.此外,H2O2的还原性一定程度上增加了COD值,导致COD去除率下降.
综上,催化剂浓度0.8 mmol/L、H2O2浓度2.0mmol/L、Fe3O4与H2O2比为0.4时,对50 mg/L苯酚(相当于112 mg/L COD)降解效果最好.
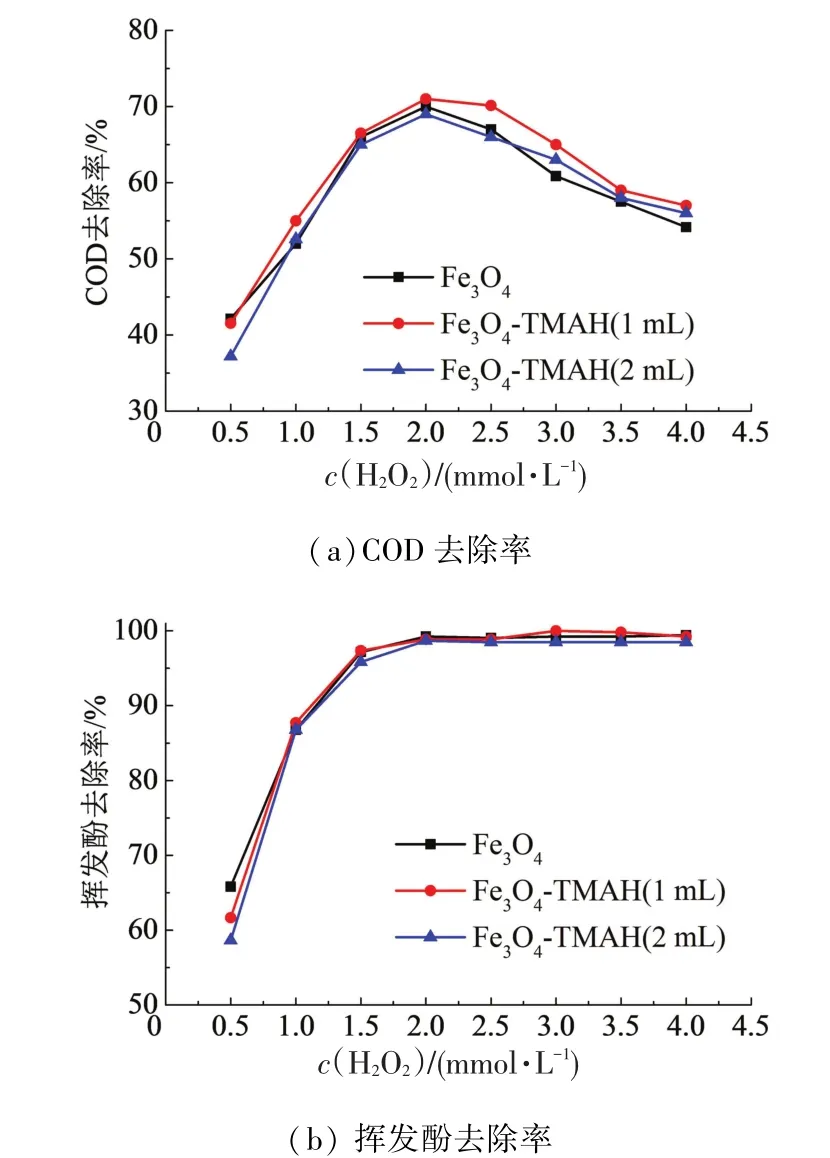
图5 H2O2用量对COD及挥发酚去除率的影响
图6 为50mg/L苯酚中投加2mmol/LH2O2、0.8 mmol/L Fe3O4、pH 4.5、反应180 min后,在外磁场作用下纳米Fe3O4的沉淀效果图.混合液中的纳米Fe3O4在钕铁硼磁铁的作用下会迅速沉到底部,10 min后溶液基本澄清,沉淀效果良好.

图6 外磁场作用下纳米Fe3O4沉淀效果
2.2.3 pH的影响
在H2O2浓度2.0 mmol/L、催化剂用量0.8 mmol/L、反应时间180 min时,考察不同pH(1.0,2.0,3.0,4.0,4.5,5.0,6.0,7.0,8.0)对COD、挥发酚去除率的影响.如图7所示,3种催化剂与H2O2组成的类Fenton体系的最适pH均为3.0~4.5,pH过低或过高均对COD、挥发酚的去除不利.pH过低时,H+消耗·OH生成H2O,同时可能酸溶了一部分磁纳米Fe3O4;pH过高时,可能抑制了催化剂表面[Fe(OH)6]3-对H2O2的吸附[15],H2O2快速分解为H2O和O2[12],抑制了·OH的产生.
一般认为,传统Fenton法最佳的初始pH为2~4[16-18].本实验中,该类Fenton体系有效降解苯酚的最大pH为4.5,对拓宽最适pH范围方面只是稍有改善,但和Wang N等[11-12]提出的Fe3O4在pH 3~9内均能有效催化H2O2降解染料等有机物的结果不一致.由于本实验与Wang N等实验中所降解的污染物种类不同,该类Fenton体系的最适pH范围是否与污染物种类相关还需进一步考证.
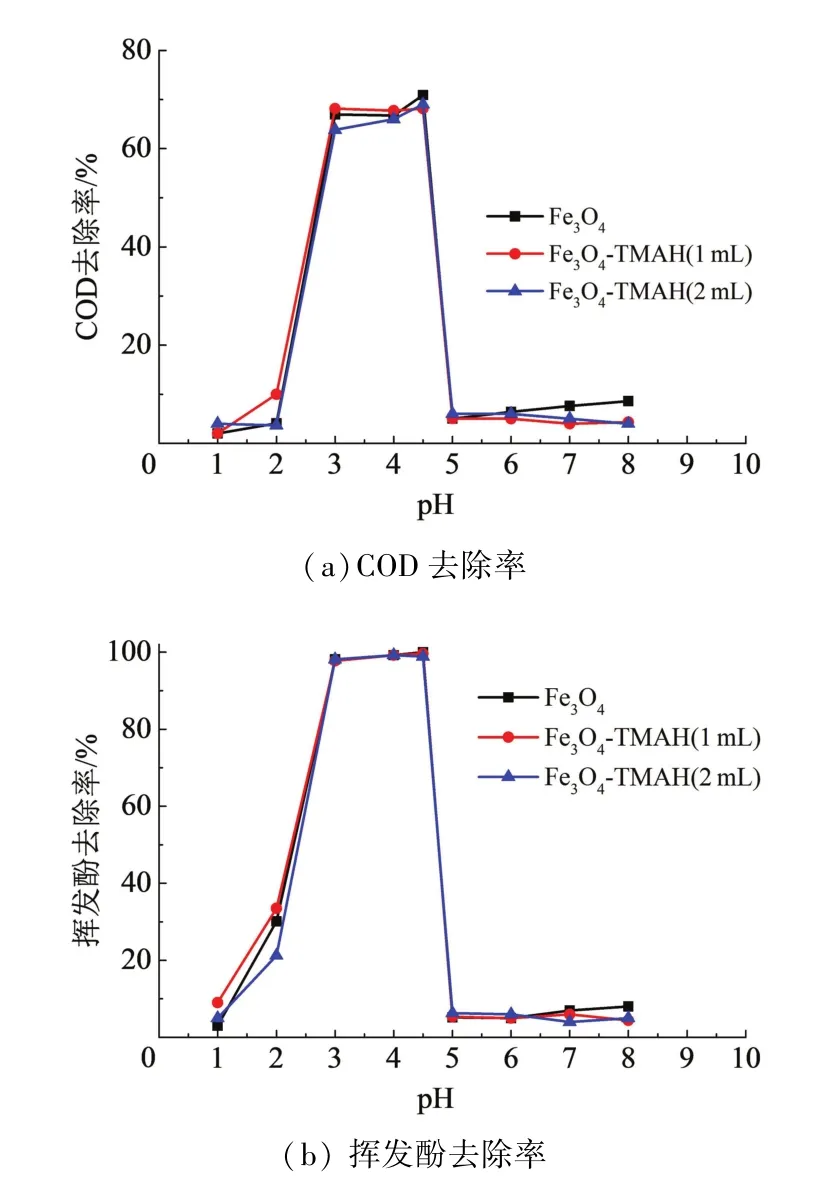
图7 pH对COD及挥发酚去除率的影响
2.2.4 反应时间的影响
在催化剂浓度0.8 mmol/L、H2O2浓度2.0 mmol/L、pH 4.5时,考察反应时间(5,15,30,60,90,120,180,240,300min)对COD、挥发酚去除率的影响.如图8所示,反应时间在180 min时对COD的去除率达到最高且稳定,反应时间在90min时便能去除全部的挥发酚.单独投加H2O2或催化剂几乎不能去除COD及挥发酚,这说明没有催化剂则不能构成催化氧化体系,苯酚的降解主要依靠·OH的氧化作用而不是吸附作用.反应在开始阶段速率很快,随着反应的进行,Fenton试剂被逐渐消耗,产生·OH的速度和量均降低,反应速率逐渐减慢,最终去除率逐渐趋于稳定. 1#Fe3O4催化剂在反应开始阶段的反应速率最慢,这可能是由于包覆了TMAH的催化剂的分散性相对更好,在反应开始时提供了更多的活性位点,催化H2O2产生·OH的速度更快.反应过程中苯酚首先被氧化成醌类,然后开环,在反应30 min时能检测到的挥发酚已很少,之后进一步断链,部分小分子有机物被氧化为CO2和H2O,COD去除率最高为70%左右,在反应结束时并没有实现有机物的完全矿化.
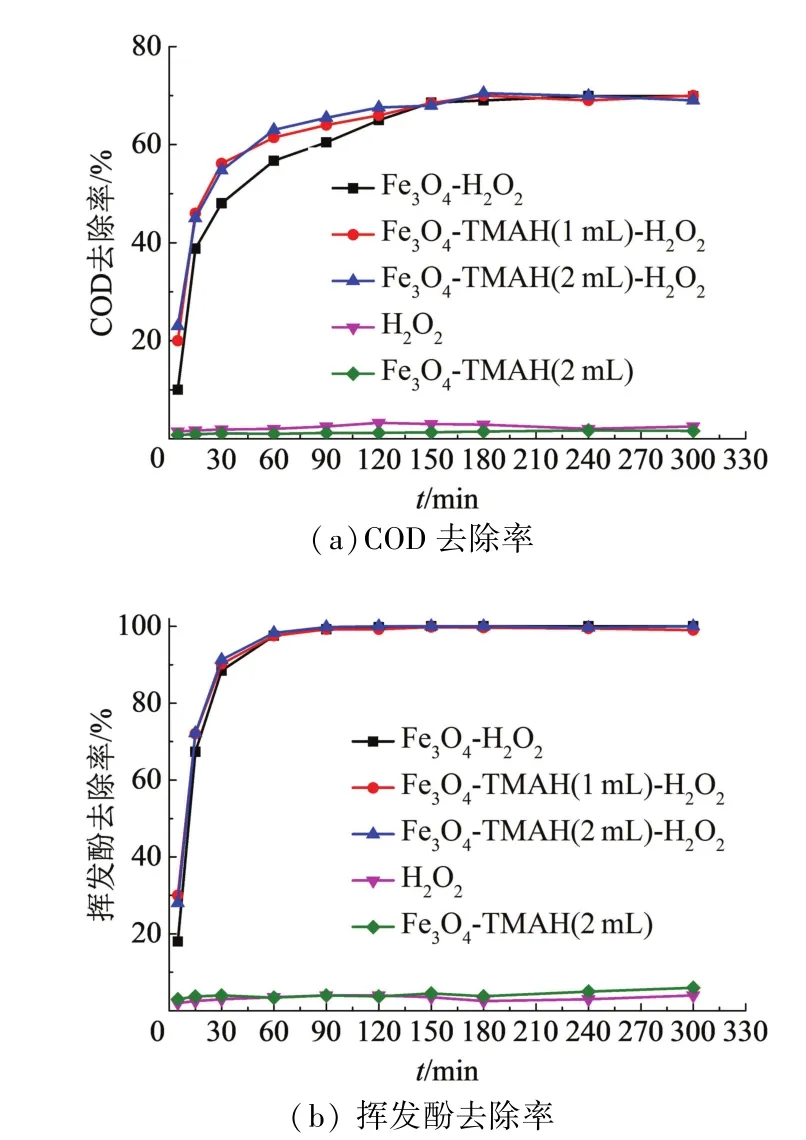
图8 反应时间对COD及挥发酚去除率的影响
2.3 催化剂重复利用效果
催化剂浓度0.8 mmol/L、H2O2浓度2.0 mmol/L、pH 4.5、反应时间180 min,催化剂在此条件下重复使用4次,考察其重复利用效果,结果如图9所示.3种催化剂从总体上看:COD的去除率在催化剂第2次使用时就降低了很多,在之后的第3次和第4次反应中,COD去除率比之前稍有降低,仅维持在20%~30%;而对于挥发酚的去除,3种催化剂在4次反应中能维持较好的效果,分别为100%,70%~80%,60%~70%和50%~54%.而在重复使用方面,3#Fe3O4-TMAH(2 mL)催化剂的回用性明显优于1#和2#,4次反应COD的去除率分别为73%,29%,28%,26%;挥发酚去除率分别为100%,84%,67%,54%.说明TMAH的包覆对纳米Fe3O4催化剂的稳定使用是有利的.在催化剂多次使用后,上清液色度稍有增加,可能有少量的Fe3+溶出,亦有一部分Fe3O4被氧化为γ-Fe2O3,纳米颗粒中Fe2+与Fe3+的比例对催化效果有影响.
传统Fenton法是均相催化反应,在反应结束后需调节pH至中性或碱性来去除混合液中的Fe3+,因此,会产生大量的氢氧化铁污泥[19],这也是Fenton法亟待解决的问题之一.本实验中的Fe3O4-H2O2类Fenton体系为非均相催化反应体系,Fe3O4催化剂可在外磁场作用下与混合液分离.图10给出该类Fenton体系反应前后将Fe3O4用磁铁聚集起来的对比图,可见反应前后催化剂投加量与沉淀量基本平衡,体系的铁泥量不会额外增加.另外,由于催化剂可以重复利用,该Fe3O4类Fenton体系与传统Fenton体系相比,在减少铁泥产生量方面有明显优势.
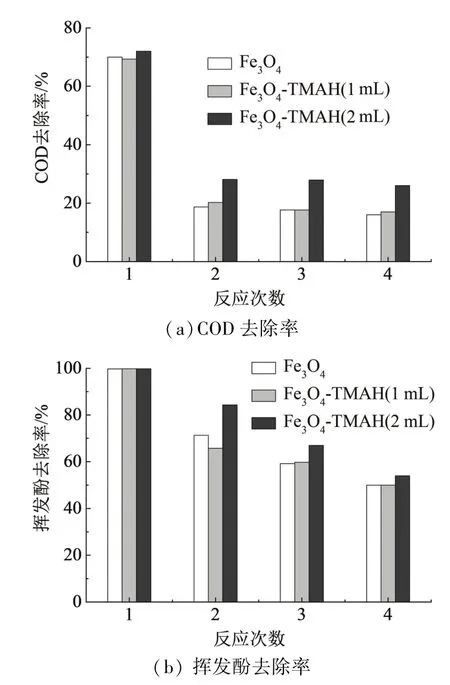
图9 催化剂使用次数对COD及挥发酚去除率的影响

图10 反应前后催化剂含量对比
综上,不同剂量TMAH包覆的3种催化剂,在一次使用中对苯酚去除效果几无差别,但重复利用效果有明显差异.考虑催化剂较好的回用性能可降低经济成本,采用TMAH进行改性是必要的,推荐的包覆剂量是2 mL TMAH.为了进一步提高催化剂的处理效能及重复利用效果,有必要对催化剂进行进一步的改性研究,如在纳米Fe3O4粒子表面包覆能强化催化性能的过渡金属元素等.
3 结 论
1)经化学共沉淀法合成的Fe3O4磁纳米颗粒平均粒径为30 nm,在20~100 nm呈现良好的粒度分布.
2)不同剂量TMAH包覆的3种催化剂经超声预处理,与H2O2构成的类Fenton体系在室温(13℃)下对苯酚的降解效果基本一致.当催化剂投量为0.8 mmol/L、H2O2浓度为2.0 mmol/L、pH为4.5、反应时间180 min时,对50 mg/L苯酚(相当于112 mg/L COD)降解效果最好,COD去除率可达72%;催化剂投量为0.4 mmol/L、H2O2浓度为2.0 mmol/L、pH为4.5、反应时间90 min时,挥发酚的去除率接近100%.
3)3#Fe3O4-TMAH(2 mL)催化剂的回用性最好,4次循环利用COD去除率分别为73%,29%,28%,26%,挥发酚去除率分别为100%,84%,67%,54%.
4)与传统Fenton法相比,本类Fenton体系在铁泥产生量方面有较好的改善,反应结束后,磁纳米Fe3O4在外磁场作用下可实现快速分离回收,体系中铁泥量不会额外增加,并且催化剂可以重复利用;但针对苯酚的有效降解,该类Fenton体系在拓宽最适pH范围方面并没有体现出明显的优势.为提高该类Fenton体系的处理效果,还需在催化剂的改性方面做进一步深入探讨.
[1]邓小晖,张海涛,曹国民,等.芬顿试剂处理废水的研究与应用进展[J].上海化工,2007,32(8):1-5.
[2]陈忠林,朱洪平,邹洪波,等.Fenton试剂处理水中有机物的特性及其应用[J].黑龙江大学自然科学学报,2005,22(2):204-207.
[3]赵冰清,陈胜,孙德智,等.Fenton工艺深度处理垃圾渗滤液中难降解有机物[J].哈尔滨工业大学学报,2007,39(8):1285-1288.
[4]DENG Y,ENGLEHARDT J D.Treatment of landfill leachate by the Fenton process[J].Water Research,2006,40(20):3683-3694.
[5]赵晓亮,魏宏斌,陈良才,等.Fenton试剂氧化法深度处理焦化废水的研究[J].中国给水排水,2010,26(3):93-95.
[6]李冬梅,徐光亮.制备超顺磁性Fe3O4纳米粒子的研究进展[J].中国粉体技术,2008,14(4):55-58.
[7]文德,刘妙丽,李强林.超顺磁性Fe3O4纳米粒子的制备和表征[J].四川师范大学学报:自然科学版,2011,34(3):385-387.
[8]GUO H,MA F,FENG X,et al.Application of iron oxide based nanomaterials(NMs)in magnetic assisted chemical separation(MACS)processes for water/wastewater treatment[J].Advanced Materials Research,2013,610:1242-1251.
[9]XU L J,WANG J L.Fenton-like degradation of 2,4-dichlorophenol using Fe3O4magnetic nanoparticles[J]. Applied Catalysis B-Environmental,2012,123:117-126.
[10]SUN S P,ZENG X,LEMLEY A T.Nano-magnetite catalyzed heterogeneous Fenton-like degradation of emerging contaminants carbamazepine and ibuprofen in aqueous suspensions and montmorillonite clay slurries at neutral pH[J].Journal of Molecular Catalysis a-Chemical,2013,371:94-103.
[11]WANG N,ZHU LH,WANG D L,etal.Sono-assisted preparation of highly-efficient peroxidase-like Fe3O4magnetic nanoparticles for catalytic removal of organic pollutants with H2O2[J].Ultrasonics Sonochemistry,2010,17(3):526-533.
[12]WANG N,ZHU L H,WANG M Q,et al.Sonoenhanced degradation of dye pollutants with the use of H2O2activated by Fe3O4magnetic nanoparticles as peroxidase mimetic[J].Ultrasonics Sonochemistry,2010,17(1):78-83.
[13]XUE X,HANNA K,ABDELMOULA M,et al. Adsorption and oxidation of PCP on the surface of magnetite:kinetic experiments and spectroscopic investigations[J].Applied Catalysis B:Environmental,2009,89(3/4):432-440.
[14]LIN S S,GUROL M D.Catalytic decomposition of hydrogen peroxide on iron oxide:kinetics,mechanism,and implications[J].Environmental Science&Technology,1998,32(10):1417-1423.
[15]ZHANG J,ZHUANG J,GAO L,et al.Decomposing phenol by the hidden talent of ferromagnetic nanoparticles[J].Chemosphere,2008,73(9):1524-1528.
[16]YANG D,ENGLEHARDT J D.Treatment of landfill leachate by the Fenton process[J].Water Research,2006,40(20):3683-3694.
[17]KAVITHA V,PALANIVELU K.Destruction of cresols by Fenton oxidation process[J].Water Research,2005,39(13):3062-3072.
[18]KANG YW,HWANG K Y.Effects of reaction conditions on the oxidation efficiency in the Fenton process[J]. Water Research,2000,34(10):2786-2790.
[19]沈吉敏,朱佳裔,陈忠林,等.Fe0/H2O2类Fenton体系降解水中对氯硝基苯[J].哈尔滨工业大学学报,2011(12):86-90.
(编辑 刘 彤)
Catalyzed degradation of phenol by Fe3O4-H2O2Fenton-like system
YANG Jixian1,WANG Lei1,2,GUO Haijuan1,3,MA Fang1,2
(1.State Key Laboratory of UrbanWater Resource and Environment(Harbin Institute of Technology),150090Harbin,China;2.HITYixing Academy of Environmental Protection,214205 Yixing,Jiangsu,China;3.Taizhou University,318000 Taizhou,Zhejiang,China)
To put forward a Fenton-like system based on a new type of Fe3O4magnetic nanoparticles catalyst,Fe3O4magnetic nanoparticleswere prepared using chemical co-precipitation,and their surface wasmodified with tetramethyl ammonium hydroxide(TMAH).The catalyzed degradation of phenol by Fe3O4-H2O2Fenton-like system was investigated,including the effect of catalyst dosage,H2O2dosage,pH value and reaction time on the removal of COD and volatile phenol.The results showed that themean size of the Fe3O4nanoparticles is 30 nm and they show a good disparity between 20 and 100 nm.Three different doses of TMAH coated catalysts after ultrasonic pretreatment,revealed almost the same treatmentefficiency of50mg/L phenol(112mg/L COD equivalent)under the room temperature(13℃).Under the condition of 0.8 mmol/L catalyst dosage,2.0 mmol/L H2O2dosage,pH 4.5 and the reaction time of 180 minutes,the highest COD removal efficiency was 72%;while under the condition of 0.4mmol/L catalyst dosage,2.0mmol/L H2O2dosage,pH 4.5 and the reaction time of 90minutes,the removal rate of volatile phenol was close to 100%.3#Fe3O4-TMAH(2 mL)catalysts revealed optimal reuse efficiency,the removal rate of COD were 73%,29%,28%,26%,the removal rate of volatile phenol were 100%,84%,67%,54%.The Fenton-like system has the advantage of no redundant excess sludge producing,and the magnetic catalyst can realize quick separation and recycling under the action of outsidemagnetic field.
Fe3O4magnetic nanoparticles;Fenton-like system;catalyzed degradation;phenol
X703
A
0367-6234(2014)12-0039-06
2014-04-02.
水专项:阿什河流域水污染综合治理技术及工程示范(2012ZX07201-003);城市水资源与水环境国家重点实验室(哈尔滨工业大学)开放课题(QA201319).
杨基先(1964—),男,教授,博士生导师;马 放(1963—),男,教授,博士生导师.
郭海娟,guohaijuan@163.com.
