乳腺病变剪切波弹性模量与胶原纤维的相关性
2014-06-05王知力,孙璐,胡亚卓等
超声弹性成像作为一种全新的成像技术应用于乳腺良恶性肿瘤的诊断,在与传统的二维灰阶超声及彩色多普勒超声等方法相比显示出其独特的优越性。本课题组前期应用剪切波弹性成像技术对乳腺实性病灶的弹性模量进行了定量研究,当弹性模量最大值采用60.12 kPa作为参考值诊断时,诊断敏感度为90.5%,特异度为88.3%,证实了弹性模量对乳腺癌的诊断具有非常重要的意义[1]。尽管乳腺恶性病灶的硬度明显高于良性病灶[2],但其具体原因还不清楚。胶原纤维是细胞外基质中的框架结构,并形成组织的伸展力,可由成纤维细胞、软骨细胞、成骨细胞及某些上皮细胞合成并分泌到细胞外。乳腺基质中起支撑作用的胶原成分主要为I型胶原纤维[3,4]。本研究将深入探讨乳腺良恶性病变剪切波弹性模量及胶原纤维含量的差异,分析乳腺病变剪切波弹性模量与胶原纤维的相关性,为提高乳腺癌弹性成像的正确诊断率奠定基础。
1 资料与方法
1.1 研究对象 2012-05~2013-05对解放军总医院的116例拟进行手术或穿刺活检的乳腺病变患者进行剪切波弹性检查。其中,60例经手术病理证实有乳腺病变,56例经穿刺活检病理证实有乳腺病变。病灶最大长径0.7~4.6 cm,平均(2.1±1.3)cm。116例患者均为女性,年龄22~82岁,平均(51.8±28.3)岁。
1.2 仪器与方法 采用SuperSonic Imagine公司AixPlorer实时剪切波弹性成像超声诊断仪,探头频率为4~15 MHz。首先行感兴趣区的常规超声检查,然后切换至弹性成像模式,平缓移动探头,不施压,找到靶目标后,静置3 s,使图像稳定后,定帧,存图。利用超声仪器提供的测量方法,选取感兴趣区测量弹性值。感兴趣区的选取方法:因仪器的测量取样框默认为圆形,则取尽可能覆盖病灶大小的取样框面积。同一病灶采用不同的方向重复5次定位,测量,得到弹性模量值最大方向的5组数据,每一组数据都包括病灶弹性模量值的最大值、最小值和平均值。记录数值并计算这3组数据中最大、最小和平均弹性模量值的平均值。将实时组织弹性成像检查图像存入仪器及电脑硬盘。
1.3 胶原纤维含量检测 Van Gieson(VG)染色:切片脱蜡至水;Weigert铁苏木素染10 min,水洗,1%盐酸酒精迅速分化,流水冲洗数分钟,VG染液染2 min,倾去染液,用95%酒精急速分化数秒,无水酒精脱水,二甲苯透明,中性树胶封固,镜下观察。胶原纤维的定量分析:采用Image-Pro Plus 5.1软件进行定量分析,以高倍镜(×400)在每张切片上随机选取5个视野,计算每一视野中胶原纤维累加面积,计算平均值。
1.4 统计学方法 采用SPSS 11.0软件,恶性组及良性组病灶的弹性模量及胶原纤维面积比较采用t检验,不同病理类型病变之间弹性模量及胶原纤维面积比较采用F检验,弹性模量与胶原纤维含量的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 116例乳腺病变中,恶性病变75例(64.7%),其中,浸润性导管癌51例,导管内癌19例,浸润性小叶癌5例;良性病变41例(35.3%),纤维腺瘤19例,腺病12例,导管内乳头状瘤6例,炎性病变4例。2.2 乳腺良性及恶性病变的超声弹性特征及弹性模量比较 良性病变的弹性模量最大值、平均值及病灶与周围组织弹性模量比值与恶性病变比较,差异均有统计学意义(t=5.329、4.382、4.487,P<0.01)。良性病变和恶性病变的弹性模量最小值差异无统计学意义(t=0.567,P>0.05)。见表 1。

表1 乳腺良性及恶性病变弹性模量最大值、平均值、最小值、病灶与周围组织弹性模量比值比较
恶性病变中,各组病理类型的乳腺癌弹性模量最大值、平均值、最小值、病灶与周围组织弹性模量比值差异无统计学意义(F=0.683,P>0.05)。良性病变中,各组病理类型的乳腺病变弹性模量最大值、平均值、最小值、病灶与周围组织弹性模量比值差异无统计学意义(F=0.765,P>0.05)。见表2。

表2 乳腺不同病理类型病变的弹性模量最大值、平均值、最小值、病灶与周围组织弹性模量比值比较
2.3 乳腺良性及恶性病变的胶原纤维含量比较 乳腺良性及恶性病变胶原纤维面积分别为(7625.14±5321.28)μm2及(11 782.26±8627.54)μm2,恶性病变胶原纤维面积明显大于良性病变,差异有统计学意义(t=8.437,P<0.01)(图1、2)。恶性病变及良性病变中,各种病理类型的乳腺病变胶原纤维含量差异均无统计学意义(F=5.83、4.23,P>0.05),见表3。

图1 女,48岁,乳腺癌。乳腺癌弹性模量及胶原纤维含量分析,右乳外上象限低回声肿块,手术病理证实为浸润性导管癌(箭,A);剪切波弹性成像可见其内硬度较高,最大弹性模量值达145.71 kPa(B);镜下见红色染色部分为胶原纤维(VG, ×400, C);胶原纤维的定量分析,平均面积为(12 313.80±4625.25)μm2(D)
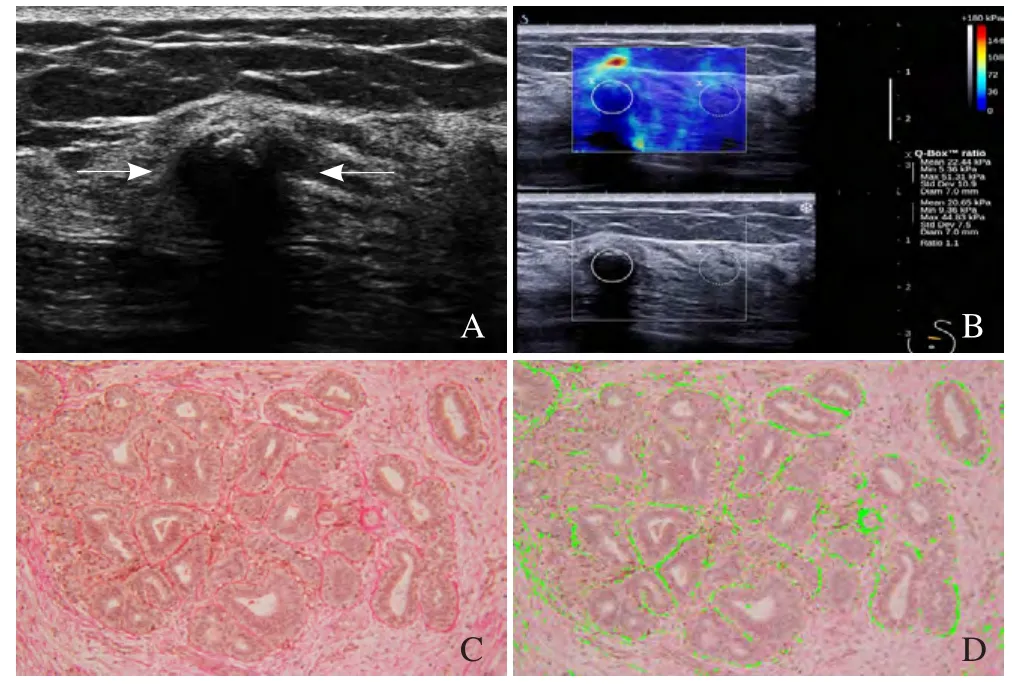
图2 女,36岁,乳腺纤维腺病。乳腺纤维腺病弹性模量及胶原纤维含量分析,左乳外上象限低回声结节,手术病理证实为乳腺腺病(箭,A);剪切波弹性成像检查,最大弹性模量值为51.31 kPa(B);镜下见红色染色部分为胶原纤维(VG, ×400, C);胶原纤维的定量分析,平均面积为(7528.43±4625.25)μm2(D)
表3 乳腺不同病理类型病变的胶原纤维含量
2.4 乳腺病变弹性模量与胶原纤维含量相关性分析乳腺病变的弹性模量最大值随胶原纤维含量的增加而增大,两者间呈线性正相关(r=0.746,P<0.05)。见图3。

图3 乳腺病变的弹性模量最大值与胶原纤维含量的相关性(r=0.746)
3 讨论
组织基质硬度的增加是肿瘤的特性之一,组织的硬度已经用于癌症的检测[5,6]。剪切波弹性成像是一种新的弹性成像模式,其可测量反映组织硬度的数值——杨氏模量的绝对值。其核心专利技术采用“马赫锥”原理,可在组织中产生足够强度的剪切波;通过超高速成像技术(获取剪切波信息速度可达20 000 Hz)探测剪切波,使探测剪切波速度的精确度达到1 mm/s,以彩色编码技术实时显示出组织弹性图;通过系统的定量分析系统(Q-BOXTM)测量组织的杨氏模量值。本课题组前期的研究表明,剪切波弹性成像在乳腺肿块型病变的鉴别诊断中发挥了重要作用[1]。
本研究表明,乳腺恶性病变的弹性模量最大值、平均值、病灶与周围组织弹性模量比值均明显高于良性病变,且各种病理类型的恶性病变的弹性模量参数均高于各种病理类型的良性病变,进一步证实弹性模量在乳腺良恶性病变的鉴别诊断中发挥着重要作用。
细胞外基质不仅为实质细胞的骨架结构,其在乳腺癌实质细胞的生长、侵袭过程中发挥重要作用,细胞外基质硬度可以促进细胞生长及转移[7],且细胞外基质变硬可以通过增加细胞的张力来破坏组织的形态[8]。
胶原是细胞外基质中含量最丰富的结构蛋白,构成组织和细胞的骨架结构,与组织的抗张强度直接相关[9]。肿瘤进展过程中,基质中可发生胶原表达增加、胶原沉积、结构改变等变化[10]。还有研究表明,胶原表达的增加与肿瘤转移相关[11]。事实上,钼靶高密度的基础就是I型胶原纤维增加,从而增加了乳腺癌的风险[12]。Levental等[13]发现乳腺癌形成过程中伴随着胶原交联,从而使细胞外基质的硬度从正常组织到癌前病变到肿瘤逐步增加。
既往研究结果表明,胶原纤维在乳腺癌的发生发展过程中发挥重要作用[14-16]。本研究表明,乳腺恶性病变的胶原纤维含量明显高于良性病变,且胶原纤维含量在各种病理类型的恶性病变之间及各种病理类型的良性病变之间均无显著性差异,进一步证实胶原纤维在乳腺癌的发生发展过程中发挥重要作用。
本研究采用Pearson相关分析对乳腺病变的弹性模量最大值与胶原纤维含量进行了相关比较,结果表明,两者呈线性正相关,证实乳腺恶性病变硬度增高与胶原纤维含量增加密切相关。
总之,本研究表明乳腺病变的弹性模量与胶原纤维含量密切相关,胶原纤维在乳腺癌的发生发展过程中可能发挥重要作用,为进一步深入探讨乳腺癌弹性模量的病理机制奠定了基础。
[1]Wang ZL, Li JL, Li M, et al. Study of quantitative elastography with supersonic shear imaging in the diagnosis of breast tumours. Radiol Med, 2013, 118(4): 583-590.
[2]黄炎, 李俊来, 王知力, 等. 实时剪切波弹性成像定量评价乳腺良恶性病变. 中国医学影像技术, 2011, 27(3): 561-564.
[3]Modesti A, D'orazi G, Scarpa S, et al. Ultrastructural and immunoelectron microscopic study of the desmoplastic stroma in carcinoma of the breast. G Chir, 1989, 10(5): 245-249.
[4]Clavel C, Birembaut P, Adnet JJ, et al. Breast carcinomas and the extracellular matrix. Ann Pathol, 1988, 8: 107-113.
[5]Butcher DT, Alliston T, Weaver VM. A tense situation: forcing tumour progression. Nat Rev Cancer, 2009, 9(2): 108-122.
[6]Sinkus R, Lorenzen J, Schrader D, et al. High-resolution tensor MR elastography for breast tumour detection. Phys Med Biol,2000, 45(6): 1649-1664.
[7]Lo CM, Wang HB, Dembo M, et al. Cell movement is guided by the rigidity of the substrate. Biophys J, 2000, 79(1): 144-152.
[8]Paszek MJ, Zahir N, Johnson KR, et al. Tensional homeostasis and the malignant phenotype. Cancer Cell, 2005, 8(3): 241-254.
[9]Kolácná L, Bakesová J, Varga F, et al. Biochemical and biophysical aspects of collagen nanostructure in the extracellular matrix. Physiol Res, 2007, 56(Suppl 1): S51-S60.
[10]Jodele S, Blavier L, Yoon JM, et al. Modifying the soil to affect the seed: role of stromal-derived matrix metalloproteinases in cancer progression. Cancer Metastasis Rev, 2006, 25(1): 35-43.
[11]Ramaswamy S, Ross KN, Lander ES, et al. A molecular signature of metastasis in primary solid tumors. Nat Genet,2003, 33(1): 49-54.
[12]Martin LJ, Boyd NF. Mammographic density. Potential mechanisms of breast cancer risk associated with mammographic density: hypotheses based on epidemiological evidence. Breast Cancer Res, 2008, 10(1): 201.
[13]Levental KR, Yu Hongmei, Kass L, et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell,2009, 139(5): 891-906.
[14]Provenzano PP, Eliceiri KW, Campbell JM, et al. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Med, 2006, 4(1): 38.
[15]Provenzano PP, Inman DR, Eliceiri KW. Collagen density promotes mammary tumor initiation and progression. BMC Med, 2008, 6(1): 11.
[16]Thrasivoulou C, Virich G, Krenacs T, et al. Optical delineation of human malignant melanoma using second harmonic imaging of collagen. Biomed Opt Express, 2011, 2(5): 1282-1295.
