“鲆优1号”牙鲆和亲本群体的表型及遗传性状变异分析
2014-06-01田永胜齐文山姜静王磊张英平刘万军陈红林陈松林
田永胜,齐文山,2,姜静,2,王磊,3,张英平,2,刘万军,3,陈红林,2,陈松林*
(1.中国水产科学研究院黄海水产研究所,海洋渔业可持续发展重点实验室,山东青岛 266071;2.上海海洋大学水产与生命学院,上海,201306;3.中国海洋大学海洋生命学院,山东青岛 266003)
“鲆优1号”牙鲆和亲本群体的表型及遗传性状变异分析
田永胜1,齐文山1,2,姜静1,2,王磊1,3,张英平1,2,刘万军1,3,陈红林1,2,陈松林1*
(1.中国水产科学研究院黄海水产研究所,海洋渔业可持续发展重点实验室,山东青岛 266071;2.上海海洋大学水产与生命学院,上海,201306;3.中国海洋大学海洋生命学院,山东青岛 266003)
牙鲆是我国及大西洋沿岸天然捕捞和养殖的主导品种,对其遗传资源保护及养殖新品种开发具有重要的意义。本文对人工培育的牙鲆养殖新品种“鲆优1号”(ZJ)、其父本韩国牙鲆群体(KS)、母本F0750家系(JX)的18个表型性状进行测量,利用SSPS程序进行方差分析和多重比较,发现体长/体宽,头长/眼径,头长/眼间距、眼径/眼间距,侧线鳞和尾鳍条6个性状与父本或母本具有显著性差异(p<0.05),可做为鉴别“鲆优1号”的标志性表型性状。“鲆优1号”与母本无显著差异(p>0.05)性状占50%。与父本无显著性差异(p>0.05)性状占33.33%。筛选了24个多态性微卫星引物对KS、JX、ZJ和FJ的遗传多样性进行分析,总共扩增出143个等位基因。4个群体的平均等位基因数(Na)大于平均有效等位基因数(Nae),平均观测杂合度大于平均期望杂合度,多态信息含量(PICa)分析显示:KS>JX>FJ>ZJ,说明人工选育导致了遗传杂合度的降低。24个微卫星位点在4个牙鲆群体中的遗传偏离指数(D)在-0.759 7到0.188 4之间,在KS、JX、ZJ和FJ群体中分别有10、16、11和17个位点显著(p<0.05)或极显著(p<0.01)偏离Hardy-Weinberg平衡。24个基因位点的遗传分化系数(Fst)在0.076 7~0.258 6之间,平均为0.146 8,表明14.68%的变异来自种群间,85.32%的变异来自种群内。Nei's遗传距离显著,KS和FJ遗传距离最近(0.282 5),遗传相似系数最大(0.753 9);ZJ 与JX遗传距离最大(0.420 5),遗传相似系数最小(0.656 7)。本文研究表明:“鲆优1号”具有明显的表型和遗传特征,与父母本及反交群体比较发生了一定程度的种内和种群间遗传分化,为“鲆优1号”的种质鉴别提供了理论依据。
牙鲆,鲆优1号,表型性状,卫微星标记,遗传多样性
1 引言
牙鲆Paralichthys olivaceus是我国主要养殖和捕捞鱼类,年产量达到26 477.5 t(2009年),排在鲆鲽鱼类产量第二位[1]。但是由于牙鲆苗种养殖成活率低、病害多,极大的限制了养殖产业的发展。为了改善牙鲆的养殖现状,培育生长快、抗病力强的牙鲆新品种,从21世纪初开始不断从黄渤海海域收集了当地野生牙鲆群体,利用人工选择方法筛选出抗鳗弧菌牙鲆群体[2],并从日本、韩国引进了牙鲆群体,构建了牙鲆育种基础群体。通过家系建立和筛选、抗病力测定、后裔鉴定、家系间杂交等方法[3],于2010年培育出一个生长快、成活率高的牙鲆新品种“鲆优1号”[4]。但是对“鲆优1号”牙鲆的生物学性状及分子遗传性状的研究至今还未有研究,为了查明“鲆优1号”标志性表型特征,以及与其父母本的遗传区别,本文对“鲆优1号”群体、韩国牙鲆群体、优良家系F0750群体及其反交后代群体的表型性状和微卫星标记遗传性状进行了研究。
表型性状被大量应用于鱼类传统分类,但近年来相关研究报告极少,在牙鲆形态性状研究方面,刘永新和刘金海对牙鲆家系早期形态性状进行了分析[5],在鱼类分类和种质鉴别方面,近年来人们大都倾向于利用分子标记对鱼类种群进行鉴定和分析。其中微卫星标记被广泛应用于遗传图谱构建、QTL定位、亲子鉴定、群体遗传结构分析等方面,赵莹莹等利用微卫星标记对6个虹鳟群体的遗传多样性进行了分析[6],全迎春等利用微卫星标记对4个鲤鱼群体的遗传多样性进行了分析[7],Kang等利用180个微卫星标记和31个EST分子标记构建了牙鲆遗传连锁图谱[8],Song等利用1 624个微卫星标记构建了高密度的牙鲆遗传连锁图谱[9]。Fuji等利用微卫星标记选育出一个抗淋巴囊肿病的牙鲆新品种[10]。可见微卫星标记在鱼类种质鉴别、遗传分析和新品种辅助选育方面具有重要的应用价值,本文试图将牙鲆育种群体的表型性状与微卫星标记性状结合起来,对牙鲆育种群体进行分析,为牙鲆新品种的培育和鉴定探索新的技术途径。
2 材料和方法
2.1 样本来源
实验用牙鲆4个群体样本均取自山东海阳黄海水产有限公司,“鲆优1号”样本(ZJ)为2010年建立的优良家系,其父本为韩国牙鲆群体(KS),母本为F0750家系群体(JX);“鲆优1号”具有生长快、成活率高的优点,近年来已经在山东威海、海阳,福建东山等地大面积推广养殖。韩国群体(KS)为2008年从韩国济州岛收集的牙鲆群体。F0750家系群体(JX)为2007年建立和筛选出的生长快优良家系。鲆优1号反交家系(FJ)是利用KS为母本,F0750为父本建立的全同胞家系。
2.2 牙鲆群体表型性状测量和分析
2010年10月对生长到2龄的F0750、4龄的韩国牙鲆及当年的“鲆优1号”群体的18个生物学性状进行了测定,生物学性状如表2。利用SSPS统计软件对获得的表型性状数据进行单因素方差分析(One-Way ANOVA),采用Student-Newman-Keuls进行多重比较和差异显著性分析,p<0.05表示具有显著性差异,p>0.05表示差异不显著,表型性状值为平均值±标准差。
2.3 4个牙鲆群体遗传材料的收集和DNA的提取
以上4个群体各随机选取30个个体,剪取鳍条后,分别保存于无水乙醇中,-20℃下保存备用。基因组DNA提取按常规酚/氯仿提取方法,将提取的DNA调整浓度至100 ng/μL备用。
2.4 牙鲆基因组DNA的微卫星分析
从牙鲆微卫星引物中挑选24条多态性较高的引物(见表1),由华大基因合成。采用15μL反应体系,含1μL模板DNA,上下游引物各0.4μL,其中1.5 μL 10×PCR缓冲液(TIANGEN,含Mg2+),0.5μL dNTP(CWBIO,2.5 mmol/L),0.1μLTaq DNA聚合酶(TIANGEN,5 U/μL),用灭菌的双蒸水补充至15 μL。在PCR仪(AB,Alpha-SE)上进行PCR反应,反应程序为:95℃预变性5 min,35个循环(95℃变性30 s,按每对引物的实际退火温度反应30~40 s,72℃延伸40 s),72℃延伸10 min,4℃保温。PCR产物经6%的聚丙烯酰胺凝胶电泳后,银染显色。
2.5 遗传数据分析与处理
对照PBR322分子量标准确定每个个体的基因型,利用Popgene软件计算4个群体的等位基因数(No)、有效等位基因数(Ne)、平均等位基因数(Na)、平均有效等位基因数(Nae)、观测杂合度(Ho)和期望杂合度(He)。同时计算了各群体的遗传相似指数、遗传距离、近交系数(Fis)、遗传分化指数(Fst)和基因流(Nm)、香农指数(I)和多态信息含量(PIC),并进行Hardy-Weinberg遗传偏离指数(D)的计算。采取UPGMA方法构建进化树。
3 结果
3.1 牙鲆不同群体生物学性状比较
在测量的18个生物学性状中“鲆优1号”体长/体宽显著大于父母本,头长/眼径显著小于父母本(p<0.05),头长/眼间距和眼径/眼间距显著大于父母本(p<0.05),侧线鳞和尾鳍条显著多于父母本(p<0.05)。可以将这几个性状做为鲆优1号的特征性状(表2)。
“鲆优1号”的体长/尾柄长、尾柄长/尾柄宽、背鳍条3个性状与母本F0750无显著性差异(p> 0.05),但与父本韩国牙鲆有显著性差异(p<0.05)。其他性状与父母本都无显著性差异,“鲆优1号”有9个性状与母本无显著差异(p>0.05),占全部性状的50%。“鲆优1号”有6个性状与父本无显著性差异(p>0.05),占全部性状的33.33%。说明“鲆优1号”与母本的相似性大于父本。
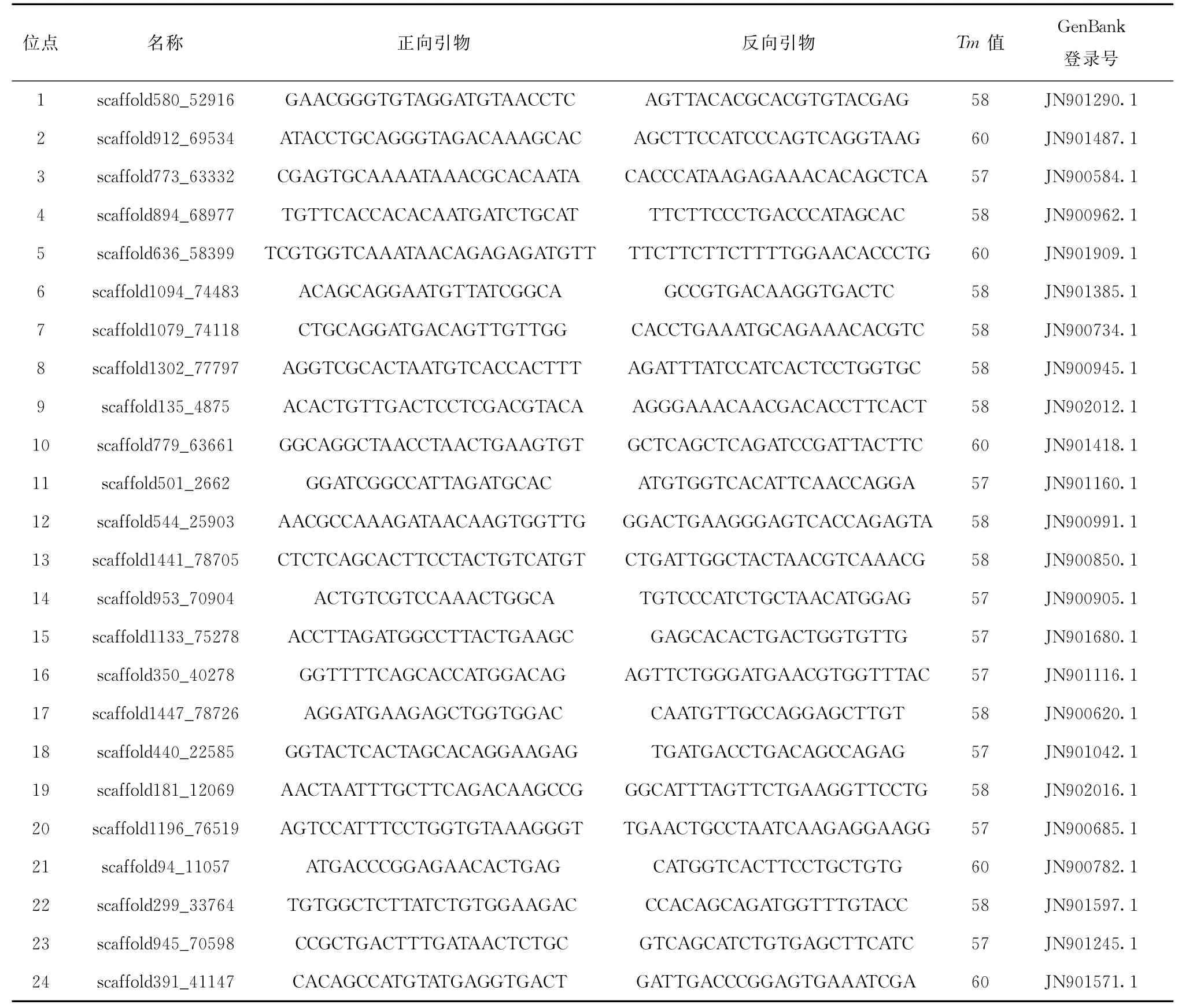
表1 本文中24对SSR位点信息

表2 鲆优1号(ZJ)与F0750家系(JX)、韩国牙鲆(KS)群体生物学性状比较

续表2

续表2
3.2 微卫星位点的多态性
试验所用24对微卫星引物均能在的DNA样品能稳定地扩增出相应条带,引物scaffold773_63332在4个牙鲆群体中的扩增结果见图1。各微卫星引物在24个微卫星位点中有19个在4个牙鲆群体中均显示出了多态性(见表3),而位点5和21在ZJ群、位点9 和19在FJ群、位点15在JX群中仅有1个等位基因,主要原因是由于采集样本中大部分为全同胞家系个体造成的。24个微卫星位点在KS群中均表现出多态性。24对微卫星标记总共扩增出143个等位基因,等位基因最多的是位点10和21,有9个等位基因,而位点19等位基因最少,有2个等位基因,KS群、JX群、ZJ群和FJ群平均等位基因数(Na)分别为5.833 3、3.583 3、3.291 7和2.791 7;平均有效等位基因数(Nae)分别为3.693 0、2.738 3、2.276 4和2.428 9(见表4),所有位点的有效等位基因数都不大于观察到的等位基因数。

图1 位点3(scaffold773_63332)在4个群体中的扩增结果
3.3 牙鲆4个群体遗传多样性
在24个微卫星位点中,平均观测杂合度在0.189 2~1.000 0之间,平均期望杂合度在0.241 6~0.841 5之间(见表5)。KS、JX、ZJ和FJ群体平均观测杂合度分别为3.693 0、2.738 3、2.276 4和2.428 9,平均期望杂合度分别为0.690 4、0.577 3、0.490 0 和0.527 2。4个群体的Shannon's多样性指数Ia分别为3.693 0、1.000 0、0.827 0和0.859 9(见表4);24个位点在4个牙鲆群体中大部分表现为中度或高度多态,只有位点19在KS群体,2、7、18位点在ZJ群中表现为低度多态。4个群体的平均多态信息含量PICa分别为0.637 0、0.525 9、0.460 1和0.487 9(见表4),4个群体都属于高度多态,但“鲆优1号”多态性相对较低。以上数据表明,经过人工选择后的3个群体(JX,ZJ和FJ)基因多样性要远低于韩国群体(KS),且正交和反交群体的基因多样性要低于父母本群体。
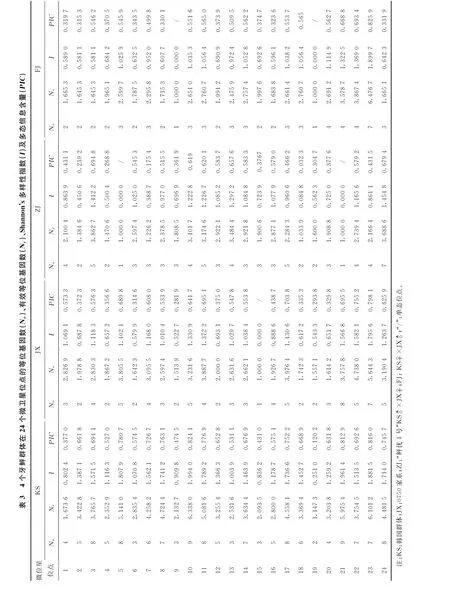

表4 4个牙鲆群体在24个微卫星基因座上的平均等位基因数(Na)、平均有效等位基因数(Nae)、观测杂合度(Hao)、期望杂合度(Hae)、Nei氏期望杂合度(Nei)、Shannon's多样性指数(Ia)以及多态信息含量(PICa)
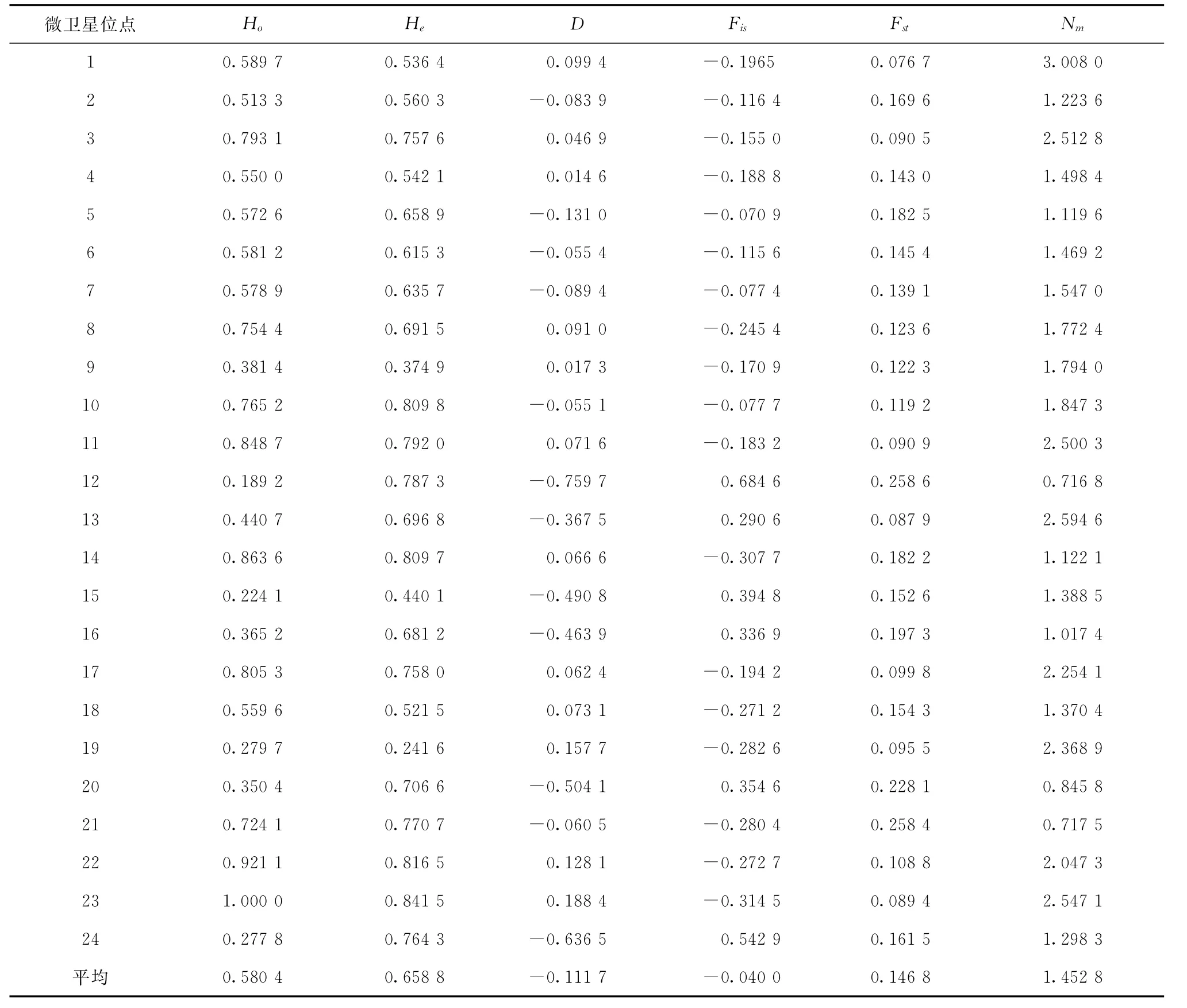
表5 24个微卫星位点在4个牙鲆群体的观测杂合度(Ho)、期望杂合度(He)、Hardy-Weinberg遗传偏离指数(D)、遗传分化信息(Fis,Fst,Nm)
3.4 基因位点遗传变异
24个基因位点的遗传分化系数(Fst)和基因流(Nm)分析结果显示(表5),Fst在0.076 7~0.258 6之间,表明群体间遗传分化在中等水平以上,其中在位点1遗传分化最低,在位点12和21遗传分化最高,各位点的平均遗传分化指数为0.146 8,表明仅有14.68%的变异由种群间分化导致,而85.32%的变异来自种群内分化。各位点的Nm在0.716 8~3.008 0之间,其数值越大,表明遗传分化程度越低,因此,这同样说明位点1在各群体间的遗传分化程度最低,在位点12和21遗传分化最高。
3.5 Hardy-Weinberg平衡分析
对24个微卫星位点分别进行等位基因频率Hardy-Weinberg平衡卡方检验和遗传偏离指数(D)计算。在KS、JX、ZJ和FJ群体中分别有10、16、11和 17个位点显著(p<0.05)或极显著(p<0.01)偏离Hardy-Weinberg平衡,F0750(JX)和反交群体(FJ)偏离位点最多。只有位点2(scaffold912_69534)在各群体中符合Hardy-Weinberg平衡(表6)。24个微卫星位点在4个牙鲆群体中的遗传偏离指数(D)在-0.759 7到0.188 4之间,其中12个位点表现为杂合子过剩(d>0),其余位点均表现为杂合子缺失(d<0)(见表5)。
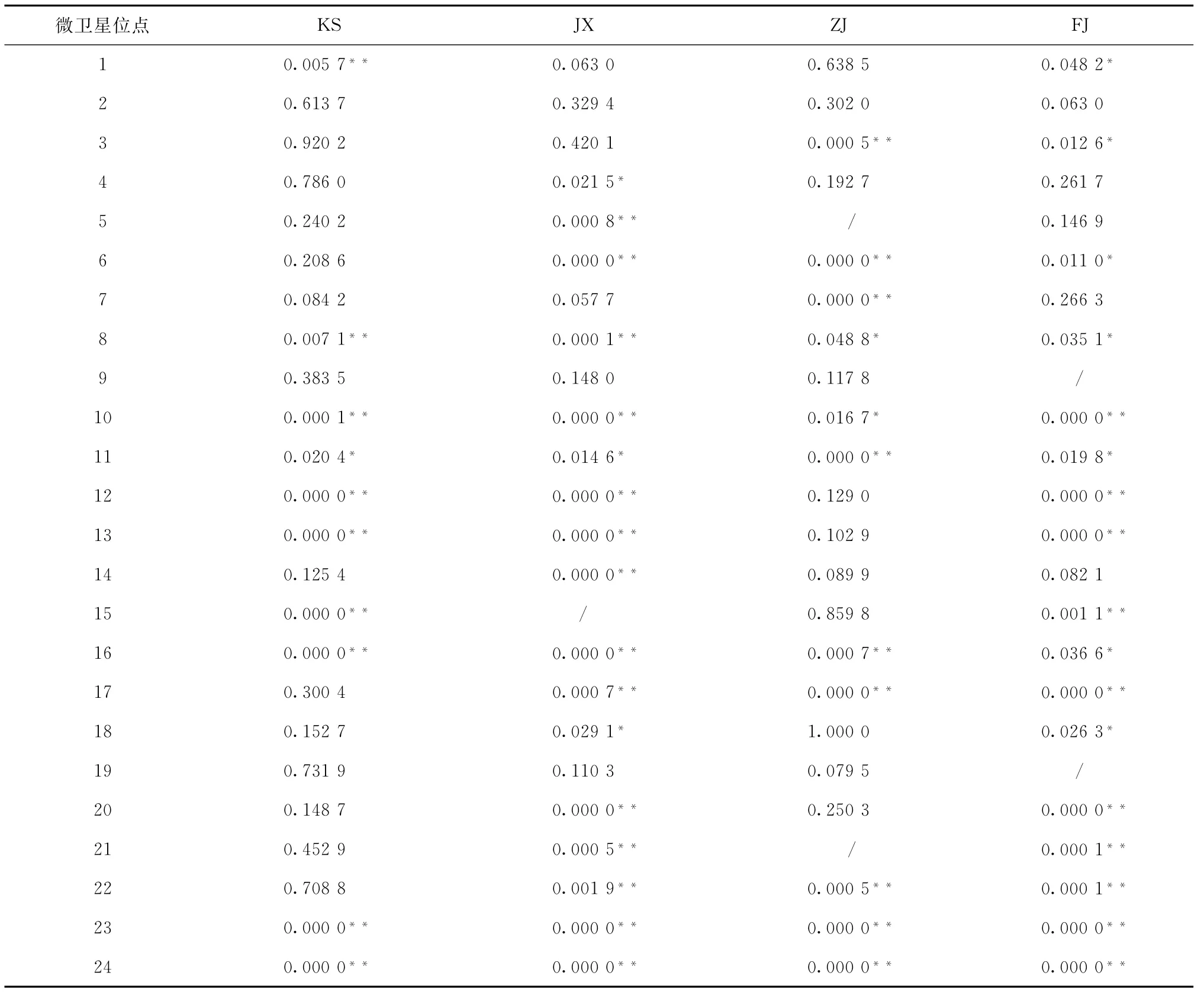
表6 4个牙鲆群体在24个微卫星位点Hardy-Weinberg平衡的卡方检验
3.6 牙鲆群体间遗传距离
各群体间Nei's遗传距离在0.282 5~0.420 5,平均0.336 7;相似性指数在0.656 7~0.753 9,平均0.714 8(见表7)。KS群体和FJ群体的遗传距离最近为0.282 5,遗传相似系数最大为0.753 9;ZJ群体与JX群体的遗传距离最远达到0.420 5,其相似性遗传指数最小0.656 7。根据各群体之间的遗传距离,采用UPGMA法对4个牙鲆群体进行聚类(见图2)。结果表明KS群体首先和FJ群体聚为一支,它们再与JX聚为一支,最后与ZJ聚合。

表7 4个牙鲆群体间的Nei's遗传距离(下)及相似性指数(上)

图2 牙鲆4个群体UPGMA聚类图
4 讨论
牙鲆主要分布于渤海、黄海、东海、南海及朝鲜、日本、俄国远东沿岸[11],是这些国家主要捕捞和养殖鱼类。分布在我国海域的牙鲆被认为有两个生态种群,北种群(黄渤海群)1-2月份分布于33°30′~37° 30′N和122°30′~124°0′E,南种群(东海群)1-2月份分布于27°~27°30′N和121°30′~122°30′E[12]。在牙鲆杂交品种“鲆优1号”的培育过程中,最初利用黄海牙鲆种群,日本牙鲆种群,韩国济州岛牙鲆种群,以及利用人工感染鳗弧菌后筛选出的抗病牙鲆群体[2—3]。分布于太平洋西岸的牙鲆在分类上属于同一个种,但由于地理上的分割,不同的地理群体在外形特征上表现出一定的差异。济州岛牙鲆群体的体色近似于沙滩色,日本牙鲆群体体背具有较大的白色花瓣状花纹,而黄海牙鲆体背具有白色点状花纹。形态上的差异是长期地理隔离和环境选择的结果。利用不同地理群体进行选择和杂交育种,使不同地理群体的优良性状得到重组,从而培育出符合人们需求的养殖新品种,是鱼类育种主要途径之一。“鲆优1号”的培育充分利用了分布在太平洋西岸不同环境下牙鲆种群的优良性状,经过大量家系建立和筛选,从而培育出一个具有生长快、成活率高的牙鲆优良养殖品种。经过几年来在山东海阳、福建东山岛等养殖公司的大量推广养殖,“鲆优1号”体现出生长快、成活高的优良特点,与当地普通牙鲆相比较,可将苗种养殖生长速度提高20%以上,成活率提高30%以上[4],深受养殖用户的好评。
表型性状是判断一个物种或品种区别于其他品种最直观的特征,在鱼类表型性状的描述中为了避免不同年龄造成的生长性状差异,采用了体长/体宽、头长/眼径等比例性状,可有效的减小年龄因素造成的误差,本文中分析牙鲆4个群体的表型性状时也采用了这一传统的方法。表型性状对于鱼类育种群体的筛选和应用可提供直观的信息,例如对牙鲆11个家系后裔不同时期生长性状的分析发现,全长贡献率是形态性状中最高的[5]。对大菱鲆4个地理群体的生长性能进行分析,发现在生长速度上依次为法国、英国、丹麦和挪威群体[13]。对90日龄大菱鲆全长、体长、头长、吻长、体高、尾柄高、尾柄长和体质量等8项性状进行分析,发现其中7个测量性状与体重的相关系数达到极显著水平[14],为育种方案的制定提供了一定的依据。本文对“鲆优1号”及其父本韩国牙鲆、母本F0750(日本牙鲆♂×抗病牙鲆♀的杂交后代)的18个生物学性状进行测量和比较分析,由于韩国牙鲆和F0750都为筛选出的优良亲本,在育种中相当珍贵,在测量时只采集了10尾样本,但经过分析发现其可量性状和可数性状的变动已很小,说明此样本量已能较准确的反映群体的表型性状。研究发现“鲆优1号”体长/体宽,头长/眼径,头长/眼间距、眼径/眼间距,侧线鳞和尾鳍条6个性状与父本或母本具有显著性差异,从此为“鲆优1号”的鉴别找到了标志性的表型性状。
分子标记在鱼类种质鉴别中的应用愈来愈广;利用RAPD技术分析了奥利亚罗非鱼♀×尼罗罗非鱼♂正反杂交子代与亲本的遗传相似系数,显示其反交后代与母本极其相似,而其正交群体的性状介于亲本之间[15]。4个尼罗罗非鱼群体Oreochromis niloticus的种群内遗传相似度为0.745 8~0.815 8[16]。本文利用牙鲆18个表型性状通过多重比较和显著性分析,发现“鲆优1号”与母本F0750有50%的性状无显著差异(p>0.05),与父本有33.33%的性状无显著性差异(p>0.05),说明鲆优1号与母本的相似性大于父本。遗传距离分析和聚类图显示反交群体与父本韩国牙鲆的遗传距离最近,其次是母本F0750,而正交群体“鲆优1号”与父本遗传距离相对较远,与母本遗传距离相对较近,这一点与表型性状研究结果具有相似性。利用24个微卫星标记分析显示“鲆优1号”与母本为遗传相似性指数反而小于父本。相反“鲆优1号”亲本的反交后代与父本韩国牙鲆群体的遗传距离最近,与母本F0750遗传距离较远。是由于分析方法的不同,还是所采用的微卫星标记与表型性状相关性较低造成,有待于进一步研究。
利用16个微卫星位点对丹东、北戴河、威海、青岛、荣成5个牙鲆群体进行遗传分析,显示5个群体遗传多样性差异不显著,群体间基因分化系数(GST)为0.099 1,各群体之间存在中度遗传分化[17]。利用10对微卫星引物对牙鲆普通群体、感病群体和抗病群体进行遗传分析,显示2个选择性养殖群体遗传多样性降低[18]。利用9对多态性微卫星引物对韩国沿海5个野生牙鲆群体和3个养殖群体的遗传多样性进行了分析,显示野生群体与养殖群体具有明显的遗传分离,东、西和南部的野生群体聚为一支,而养殖群体聚为一支[19]。利用11个微卫星位点对日本沿海周围的7个牙鲆群体进行分析,7个群体的遗传分化系数相当低(Fst=0.002 5)[20],可以认为是同一个地理群体。从以上的遗传分析可以认为本文应用韩国牙鲆群体、日本牙鲆群体应当为代表性群体。而本文中涉及4个牙鲆群体的遗传分化系数为0.076 7~0.258 6,分化系数相对较高,主要原因是由于“鲆优1号”父本为韩国群体,母本F0750的父母本分别为日本群体和从养殖群体中人工筛选而来的抗病群体,其遗传背景较为丰富,4个群体之间产生了中度的遗传分化,分化水平分别高于日本牙鲆和中国沿海养殖群体。
观测杂合度(Ho)和期望杂合度(He)是分析种群内遗传变异的2个重要指标,日本海区7个牙鲆种群的平均等位基因No为15.2~18.2,期望杂合度He为0.74~0.78[20],韩国沿海牙鲆野生种群平均有效等位基因AR为10.9~16.1,观测杂合度Ho为0.820 ~0.888[19]。中国北部沿海5个牙鲆养殖群体的观测杂合度Ho为0.220 0~0.800 0,期望杂合度He为0.206 1~0.818 7[17],本文4个群体的观测杂合度Ho为0.538 3~0.619 3,期望杂合度He为0.490 0~0.690 4,本文中牙鲆群体的遗传多样性低于日本和韩国自然群体,但遗传多样性高于国内沿海养殖群体,主要原因是由于本文中群体是从以上群体选育而来,因此遗传多样性低于原产地养殖群体,但经过几代选育,和本地养殖群体相比遗传多样性有所提高。
等位基因数(Na)或有效等位基因数(Ne)易受到外部环境(选择、漂变、遗传瓶颈等)因素的影响[22],适合于评价群体遗传变异[23]。本文4个牙鲆群体的平均有效等位基因数(Nae)小于平均等位基因数(Na),其原因主要是由于群体选育及针对性的家系选育造成的。Locus5、Locus21在ZJ群体中,Locus9 和Locus19在FJ群体中出现了只有1个等位基因的现象,主要是由于ZJ和FJ群体为一对父母本交配产生的全同胞家系群体。而韩国群体为引进的养殖群体,因此利用24个卫微星标记进行检测时,韩国群体在每个位点表现为多态性,而在其ZJ和FJ家系群体中出现了单态现象。
多态信息含量是衡量位点多样性的较好指标,一般认为在某一群体中,当PIC>0.5时该位点表现为高度多态,当0.25<PIC<0.5时该位点表现为中度多态,当PIC<0.25时该位点表现为低度多态[21]。中国北部沿海牙鲆野生群体的30个位点多态信息含量为PIC为0.709~0.892,平均为0.832[23]。本文中4个牙鲆群体的PICa为0.460 1~0.637 0,平均为0.527 7,相对于野生群体较低,但都表现为高度多态,表明这4个牙鲆群体种群内遗传变异较大,信息含量较高,多态信息含量从大到小依次为:韩国牙鲆、F0750、鲆优1号反交群体和鲆优1号。
Hardy-Weinberg遗传偏离指数(d)反映了Ho和He两者之间的平衡关系[24]。北部沿海野生牙鲆群体的遗传偏离指数d变化范围从-0.247到0.512[23],本文中24个微卫星位点在4个牙鲆群体中的遗传偏离指数(D)在-0.759 7到0.188 4之间,其中50%的位点杂合子过剩(d>0),其余为杂合子缺失(d<0)。4个群体中F0750(JX)和反交群体(FJ)显著的偏离位点最多,分别达到16和17个。主要原因是由于奠基者效应(founder effect)和瓶颈效应(bottle effect)造成[25]。韩国牙鲆(KS)是从国外引进,种群数量有限,选育群体F0750(JX)是一个生长快成活率高的家系,父母本为一对个体。鲆优1号(ZJ)和其反交群体(FJ)样本都采自建立的家系群,因而发生了大部分基因位点的偏离。
综上所述,人工培育的牙鲆杂交新品种“鲆优1号”与其父母本相比较,在6个表型性状上具有显著性差异;遗传性状分析显示4个群体之间产生了中度的遗传分化,而且种群内也产生了较大的遗传变异。说明人工培育的“鲆优1号”在表型和遗传上具有一定的特质,这些特点为鉴别“鲆优1号”提供表型和遗传标志,同时为其优良的生产性状(生长快、成活率高)提供了一定的遗传依据。
[1] 杨正勇,王春晓.全球视野下中国鲆鲽类养殖业的发展[J].中国渔业经济,2009,6(27):115-127.
[2] 陈松林,田永胜,徐田军,等.牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J].水产学报,2008,32(5):665-674.
[3] 田永胜,徐田军,陈松林,等.三个牙鲆育种群体亲本效应及遗传参数估计[J].海洋学报,2009,31(6):119-129.
[4] 陈松林,田永胜.全国水产技术推广总站-2010水产新品种推广指南[M].北京:中国农业出版社,2011:242-268.
[5] 刘永新,刘海金.牙鲆不同家系早期形态性状差异比较[J].东北农业大学学报,2008,39(8):82-88.
[6] 赵莹莹,朱晓琛,孙效文.虹鳟6个养殖群体遗传多样性的微卫星分析[J].遗传,2006,28(8):956-962.
[7] 全迎春,孙效文,梁利群.应用微卫星多态分析四个鲤鱼群体的遗传多样性[J].动物学研究,2005,26(6):595—602.
[8] Kang J H,Kim W J,Lee W J.Genetic linkage map of olive flounder,Paralichthys olivaceus[J].Int J Biol Sci,2008,4(3):143-149.
[9] Song W T,Pang R Y,Niu Y Z,et al.Construction of high-density genetic linkage maps and mapping of growth-related quantitative trail loci in the Japanese flounder(Paralichthys olivaceus)[J].Plos One,2012,7(11):e50404.
[10] FujiK,Hasegawa O,HondaK,et al.Marker-assisted breeding of a lymphocystis disease-resistant Japanese flounder(Paralichthysolivaceus)[J]. Aquaculture,2007,272:291-295.
[11] 田永胜,陈松林,严安生.牙鲆胚胎玻璃化冷冻技术研究[J].高技术通讯,2005,15(3):105-110.
[12] 李思忠,王惠民.中国动物志:硬骨鱼纲-鲽形目[M].北京:科学出版社,1995:116-123.
[13] 王新安,马爱军,侯仕营,等.大菱鲆4个不同地理群体生长性能的比较[J].渔业科学进展,2010,31(1):34-39.
[14] 于飞,张庆文,孔杰,等.大菱鲆测量性状对体重的影响效果分析[J].海洋水产研究,2008,29(60):33—40.
[15] 夏德全,曹萤,杨弘,等.罗非鱼杂交F代与亲本的遗传关系及其杂种优势的利用[J].水产科学,1999,6(4):29-32.
[16] 杜诚,卢迈新,叶星,等.5个罗非鱼群体的遗传分析与分子标记[J].大连海洋学院学报,2005,20(1):25-28.
[17] 刘海金,朱晓琛,孙效文,等.牙鲆5个养殖群体的遗传多样性分析[J].中国水产科学,2008,15(1):30-38.
[18] 刘云国,陈松林,李八方,等.牙鲆选择性养殖群体遗传结构的微卫星分析[J].高技术通讯,2006,16(1):94-99.
[19] Kim W J,KimKK,Han H S,et al.Population structure of the olive flounder(Paralichthys olivaceus)inKorea inferred from microsatellite marker analysis[J].J Fish Biol,2010,76:1958-1971.
[20] Sekino M,Hara M.Application of microsatellite markers to population genetics studies of Japanese flounder Paralichthysolivaceus[J].Mar Biotechnol(NY),2001,3:572-589.
[21] Li D,Kang D,Yin Q,et al.Microsatellite DNA marker analysis of genetic diversity in wild common carp(Cyprinuscarpio L.)populations[J].J Genet Genomics,2007,34:984-993.
[22] Nei M,Maruyama T,Chakraborty R.The bottleneck effect and genetic variability in populations[J].Evolution,1975,29(1):1-10.
[23] Wang L,Zhang L D,Wan Y M,et al.Isolation of microsatellite markers from Paralichthysolivaceus and its application in genetic structure analysis[J].Yi Chuan,2010,32:1057-1064.
[24] 李鹏飞,刘萍,柳学周,等.漠斑牙鲆引进种群同工酶的遗传多态性分析[J].中国水产科学,2006,13(1):13-19.
[25] Suci A,Uthairat N N,WorawutK.Study of genetic diversity of orange spotted grouper,Epinepheluscoioides from Thailand and Indonesia using microsatellite markers[J].Mar Biotechnol,2005,8:17-26.
Analysis of phenotype and genetic variation of on“Flounder No.1”Paralichthys Olivaceus and their parental populations
Tian Yongsheng1,Qi Wenshan1,2,Jiang Jing1,2,Wang Lei1,3,Zhang Yingping1,2,Liu Wanjun1,3,Chen Honglin1,2,Chen Songlin1
(1.Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Yellow Sea Fisheries ResearchInstitute,Chinese Academy of Fishery Sciences,Qingdao 266071,China;2.College of Fisheries andLife Science,Shanghai Ocean University,Shanghai 201306,China;3.School of Marine life Sciences,0cean University of China,Qingdao 266003,China)
Japanese flounder(Paralichthys olivaceus)is one of the most popularspecies for fishing and breeding in China and the Atlantic coast,so it is of great importance for the protection of genetic resources and the development of new species.In present study,18 phenotypic traits of“Flounder No.1”(ZJ),a newly breeding species of Japanese flounder,as well as its male(theKorean Japanese flounder stock,KS)and female parents(F0750 family,JX),were measured.The data were compared by ANOVA and SPSS software.The results showed that there were significant differences(p<0.05)between“flounder No.1”and its parents regarding 6 traits,e.g.body length/body width,head length/eye diameter,head length/eye spacing,eye diameter/eye spacing,lateral line scales and caudal fin ray which can be used as typical characters for identification of“Flounder No.1”.In“Flounder No.1”,50%of the traits showed no significant differences(p>0.05)bcompared to its female parent,while the value decreased to 33.3%between“flounder No.1”and its male parent.A total of 24 microsatellite primers were designed to screen the genetic diversity ofKS,JX,ZJand FJ(reciprocal cross offspring),and 143 alleles were identified.For four populations,KS,JX,ZJ and FJ,their mean allelic number(Na)was higher than the effective mean number of alleles(Nae),the mean heterozygosity was higher than the predicted value.The polymorphism information content (PICa)showed thatKS>JX>FJ>ZJ,indicating that the artificial breeding caused the reduction of the genetic heterozygosity.Among the four populations,the genetic deviation index(D)of 24 above mentioned microsatellite loci ranged from-0.759 7 to 0.188 4.And inKS,JX,ZJ and FJ,10,16,11 and 17 loci were significantly(p<0.05)or extremely(p<0.01)deviated from Hardy-Weinberg equilibrium,respectively.The genetic-differentiation-index(Fst)of 24 loci ranged from 0.076 7 to 0.258 6,with the mean value 0.1468,which suggests that 14.68%of the variations result from the interspecies,while 85.32%are intraspecific variations.Furthermore,there was significant difference for Nei's genetic distance among four populations.The nearest genetic distance occured betweenKS and FJ(0.282 5),togehter with the highest genetic similarity coefficient(0.753 9).While the furthest(0.420 5)one was found between ZJ and JX with the lowest(0.656 7)genetic similarity coefficient.In this study,the observation indicated:“flounder No.1”has the obvious phenotypic and genetic characteristics,shows a certain degree of genetic differentiation in intraspecies and interspecies in comparison to its parents and reciprocal cross offspring,which provides the theoretical basis for the germplasm identification of“Flounder No.1”.
Paralichthys Olivaceus;“Flounder No.1”;phenotypic traits;microsatellite markers;genetic diversity
Q959.486
A
0253-4193(2014)06-0075-12
2013-04-18;
2014-02-17。
“863”高技术研究发展计划(2012AA10A408);山东省泰山学者建设工程专项资助。
田永胜(1964-),男,甘肃省会宁县人,研究员,博士,主要从事鱼类低温生物学及遗传育种研究。E-mail:tianys@ysfri.ac.cn
*通信作者:陈松林(1960-),男,研究员,博士,主要从事水产生物技术研究。E-mail:chensl@ysfri.ac.cn
田永胜,齐文山,姜静,等.“鲆优1号”牙鲆和亲本群体的表型及遗传性状变异分析[J].海洋学报,2014,36(6):75—86,
10.3969/j.issn.0253-4193.2014.06.010
Tian Yongsheng,Qi Wenshan,Jiang Jing,et al.Analysis of phenotype and genetic variation of on“Flounder No.1”Paralichthys Olivaceus and their parental populations[J].Acta Oceanologica Sinica(in Chinese),2014,36(6):75—86,doi:10.3969/j.issn.0253-4193.2014.06.010
